محلول جامد
یک محلول جامد، جامدی است که دارای دو یا چند عنصر بوده و اتمهای آنها در یک ساختمان بلوری واحد قرار گرفته و تشکیل یک فاز واحد را بدهند که معمولاً در مورد عناصری که در جدول تناوبی به هم نزدیک هستند، امکان تشکیل محلول جامد وجود دارد.
افزودن اتمهای ناخالصی به یک فلز باعث شکلگیری “محلول جامد” میشود. در این مبحث ماده ای که مقدار آن از همه بیشتر است به عنوان حلال و ماده ای که غلظت آن کمتر است به عنوان حل شونده خوانده میشود. زمانی که اتمهای حل شونده به ماده میزبان افزوده شود محلول جامد شکل میگیرد. در این حالت ساختار کریستالی حفظ شده و ساختار جدیدی شکل نمیگیرد.[1] مانند مایعات در محلولهای جامد نیز اتمها بهطور یکنواخت در محلول تقسیم میشوند.
[1]
محلول جامد خانواده ای از مواد را توصیف میکند که دارای ترکیبات متفاوتی اند. مثال های گوناگونی از محلول جامد در متالورژی و زمین شناسی و شیمی جامدات میتوان یافت. واژهی "محلول" برای توصیف ترکیب اجزا در ابعاد اتمی بکار میرود و این مواد همگن را از مخلوط های فیزیکی متمایز میسازد.
در حالت کلی اگر دو ماده هم ساختار باشند،در نتیجه محلول جامد در عضو های انتهایی به وجود میآید.مانند سدیم کلرید و پتاسیم کلرید که ساختار کریستالی مکعبی یکسان دارند پس امکان به وجود آمدن ترکیب خالص با هر درصدی از سدیم تا پتاسیم وجود خواهد داشت.
عضوی از این خانواده از محلول ها تحت نام "Lo salt " که از ترکیب " Na0.33K0.66)Cl) " تشکیل شده است به فروش میرسد در حالی که حاوی 66% سدیم کمتری از NaCl است.سنگ معدن های طبیعی خالص آنها با نام هالیت وسیلویت یافت میشود.ترکیب فیزیکی مخلوطی از انها سیلوینیت نام دارد.
چون مواد معدنی موادی طبیعی هستند،تمایل به تشکیل ترکیبات متنوعی دارند.در بسیاری از حالات نمونه ها عضوی برای یک خانواده محلول جامدند و زمین شناس ها تمایل دارند درمورد ترکیبات یک خانواده از نمونه ها بجای یک نمونهی خاص صحبت کنند .
"اولیوین" با ترکیب "(Mg, Fe)2SiO4, " که معادل "(Mg1-xFex)2SiO4 " است توصیف میشود.نسبت منیزیم در آهن بین دو انتها با تکیبات محلول جامد : "فروستریت" Mg2SiO4 و "فاوالیت" Fe2SiO4 است. اما نسبت در اولیوین به طور معمول تعریف نشده است.
با افزایش پیچیدگی ترکیب ها جامعهی زمین شناسی بسیار ساده تر از شیمی قابل کنترل است.[2]
تعریف آیوپاک :
جامدی که اجزای آن با هم هماهنگ هستند و یک فاز خاص را ایجاد میکنند.
نکته 1: تعریف " کریستالی شامل یک جزء ثانویه که در ساختار کریستال میزبان توزیع شده و جای گرفته است" تعریف عمومی ای نمیباشد؛ و توصیه نمیشود.
نکته 2: این عبارت فقط برای توصیف فاز جامدی بکار میرود که بیش از دو ماده دارد.برای راحتی یکی از دو یا چند جزء حلال و باقی اجزا حلشونده نامیده میشوند.
نکته3:یک یا چندتا از جزء ها میتوانند درشت مرلکول باشند.برخی از دیگر جزء ها میتوانند به عنوان روانساز عمل کنند.مانند مواد مولکولی توزیع شده که دمای تبدیل شیشه را که در آن فاز آمورف پلیمر بین دو حالت شیشه ای و لاستیکی تبدیل می یابد.
نکته 4: در آماده سازی دارو ها از مفهوم محلول جامد اغلب به معنای ترکیب دارو و پلیمر استفاده میشود.

دیاگرام های فازی
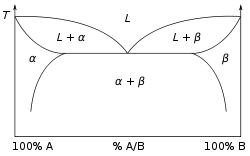
در دیاگرام فازی یک محلول جامد توسط یک ناحیه نشان داده میشود،که اغلب با نوع ساختار خود نمادگذاری میشود،که بازه های دمایی و فشاری متفاوتی را شامل میشود.به گونهای که اعضای ابتدایی و انتهایی در دریاگرام ساختار مشابهی ندارند.آنها اغلب دو بازهی محلول جامد با ساختار های متفاوت هستند.. گاهی همانند دیاگرام مقابل بازه ها میتوانند همپوشانی داشته باشند.و ماده در این بازه ها میتواند هر دو ساختار را دارا باشد،یا ممکن است یک فاصلهی انحلالی در فاز های جامد به وجود بیاید که نشان میدهد تلاش برای تولید مواد در این ناحیه منجر به تشکیل مخیوط ها میشود.در نواحیای از دیاگرام فازی که توسط یک محلول جامد اشغال نشده اند، ممکن است فاز های خطی وجود داشته باشد،اینها ترکیباتی با ساختار کریستالی معلوم و استوکیومتری معین هستند.به گونهای که فاز کریستالی از دو مولکول بدون بار ارگانیک تشکیل شده است.فاز خطی به عنوان "همکریستال" یا "cocrystal" شناخته میشوند.در متالورژی با آلیاژ هایی با یک ترکیب معین به عنوان ترکیبات بین فلزی شناخته میشوند.محلول جامد هنگامی به وجود میآید که دو عنصر (معمولاً فلزات) درگیر ،در جدول تناوبی به هم نزدیک باشند.یک ترکیب بین فلزی غالباً هنگامی به وجود میآید که دو فلز درگیر نزدیک یکدیگر در جدول تناوبی قرار نگرفته باشند.[3]
توضیحات تکمیلی
حل شونده ممکن است درون ساختار کریستالی حلال به صورت "جانشینی" حل شود،به اینصورت که یک ذره از حلال در جای خودش را به حل شونده میدهد. گاهی وقات حل شونده میتواند به صورت "بینشینی" در فضای خالی موجود در ساختار کریستالی حلال قرار گیرد.در هردوحالت خواص ماده با تغییر در شبکهی کریستالی آن تحت تاثیر قرار میگیرد،و خواص فیزیکی و الکتریکی مادهی حلال را تغییر میدهد.هنگامی که شعاع اتمی حلشونده بزرگتر از حلال باشد،باعث افزایش حجم سلول واحد حلال شده تا بتواند در آن قرار گیرد.این بدان معناست که ترکیب ماده در محلول جامد،میتواند از طریق حجم سلول واحد تحت رابطهی وگارد محاسبه شود.
برخی ترکیبات به صورت آماده در بازه های معین تشکیل محلول جامد داده اما برخی اصلاً با هم محلول جامد نمیسازند.تمایل دو ماده برای تشکیل محلول جامد به عوامل پیچیدهای که نیازمند دانش شیمی و کریستالوگرافی و خواص کوانتومی مواد است.محلول جامد هایی که با روش "جانشینی" تشکیل میشوند از قوانین " Hume-Rothery rules " پیروی میکنند.که شامل موارد زیر است:
- شعاع اتمی حلال و حل شونده نزدیک باشد(کمتر از 15 درصد اختلاف)
- ساختار کریستالی مشابه داشته باشند
- الکترونگاتیوی مشابه داشته باشند
- تعداد الکترون لایه والانس مشابه داشته باشند
یک محلول جامد در اثر ترکیب شدن با مواد دیگر میتواند یک محلول جدید را ایجاد کند.
دیاگرام فازی شکل 1 یک آلیاژ متشکل از دو فلز که یک محلول جامد با تمام ترکیب های ممکن ایجاد میکنند را نشان میدهد.
در این حالت فاز خالص هرکدام از عناصر دارای ساختار کریستالی مشابه است،و دارای خواص مشابه دو عنصر برای جانشینی بیطرف در تمام بازههای نسبی است.
محلول های جامد کاربرد های تبلیغاتی و صنعتی بالایی دارند،به گونه ای که ترکیبات دو فلز خواص برتری نسبت به مواد خالص دارد.بسیاری از آلیاژ های فلزی محلول جامدند.حتی مقدار کمی از محلول میتواند خواص الکتریکی و فیزیکی حلال را تغییر دهد.
منابع
- William D. Callister Jr. , David G. Rethwisch. Callister's Materials Science and Engineering. صص. ۱۰۹. شابک ۹۷۸-۱-۱۱۹-۴۵۳۹۱-۸.
- «Penguin Random House. p. 91». Rocks & Minerals: The Definitive Visual Guide:,. Bonewitz, Ronald L. (1993).
- «Penguin Random House. p. 91». An Introduction to Metallurgy Guide:,. Cottrell, Alan Howard(1967) .
- «Materials Science and Engineering: An Introduction». Callister Jr.(2006), William D. John Wiley & Sons .