الکترون ظرفیت
در دانش شیمی، الکترون ظرفیت یک الکترون وابسته به الکترونهای پوسته یا لایه الکترونی یک اتم است و؛ اگر پوستهٔ بیرونی بسته نباشد، این الکترون میتواند در ایجاد و تشکیل یک پیوند شیمیایی شرکت کند. در یک پیوند کووالانسی (تک والانسی)، هر دو اتم درگیر در پیوند به منظور تشکیل یک پیوند کووالانسی، هرکدام یک الکترون ظرفیت عرضه میکنند. رفتار یک عنصر شیمیایی در واکنشهای شیمیایی با حضور و شمار الکترونهای ظرفیت تعیین میشود. خواص شیمیایی هر عنصر را الکترونهای ظرفیت تعیین میکند مانند: ویژگی ظرفیت شیمیایی آن - و اینکه آیا ممکن است به دیگر عنصرها بپیوندد یا نه؛ و اگر چنین است، میزان آمادگی و با چند الکترون؟.
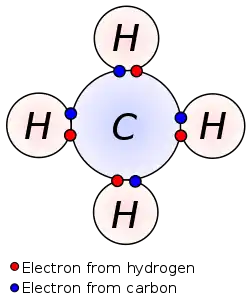
برای یک عنصر از گروه اصلی، الکترون ظرفیت، تنها میتواند در بیرونترین قسمت پوستهٔ بیرونی الکترون وجود داشتهباشد. در یک فلز واسطه، الکترون ظرفیت میتواند در یک پوستهٔ داخلی نیز قرار داشتهباشد.
اتمی که لایههای الکترونی ظرفیت آن بسته باشد؛ (وابسته به آرایش پیکربندی الکترونی s2p6)، از نظر شیمیایی تمایلی به پیوند ندارد و نسبت به دیگر اتمها «بیاثر» است. اتمهای دارای یک یا دو الکترون ظرفیت اضافی در یک لایهٔ بسته، به دلیل داشتن انرژی نسبتاً کم برای خارج ساختن الکترونهای اضافی برای ایجاد یون مثبت، بسیار واکنش پذیر هستند. اتمی با کمبود یک یا دو الکترون در یک لایهٔ بسته، به دلیل تمایل آن برای به دست آوردن الکترونهای از دست رفته و تشکیل یون منفی، یا در غیر این صورت برای به اشتراک گذاشتن الکترونهای ظرفیتی و تشکیل پیوند کووالانسی، واکنشپذیر است.
همانند یک الکترون موجود در پوستهٔ داخلی، یک الکترون ظرفیت نیز توانایی جذب یا آزادسازی انرژی به شکل فوتون را دارد. دریافت انرژی اضافی میتواند باعث شود تا الکترون به لایهٔ بیرونیتری جهش کند. این پدیده به حالت برانگیخته معروف است. در این حالت، اگر الکترون انرژی کافی برای غلبه بر سد بالقوهای که برابر با پتانسیل یونیزاسیون است دریافت کند، الکترون حتی میتواند اتم را ترک و آزاد شود و بنابراین، یک یون مثبت را تشکیل دهد. در شرایطی که الکترون انرژی خود را با انتشار یک فوتون از دست میدهد، میتواند درون یک لایهٔ داخلی که کاملاً اشغال نشده حرکت کند.
سطح انرژی ظرفیت با اعداد کوانتومی اصلی (n = ۱، ۲ ، ۳، ۴ ، ۵ ...) مطابقت داده میشوند، یا با حروف الفبا، با حروف مورد استفاده در نماد پرتو ایکس: (K , L، M ، ...)، برچسب زده میشوند.
شمار الکترونهای ظرفیت
در عناصر دسته ی s الکترون های ظرفیت مساوی تعداد الکترون های زیر لایه s آخرین لایه (n) هست. در عناصر دسته ی p الکترون های ظرفیت مساوی تعداد الکترون های زیر لایه p و s در اخرین لایه اتم(n)هست. در عناصر دسته ی d الکترون های ظرفیت مساوی تعداد الکترون های زیر لایه s آخرین لایه(n) و تعداد الکترون های زیر لایه d لایه قبل(n-1) هست. s(n) + (n-1)d
ظرفیت برخی عناصر
| ظرفیت |
|---|
 |
| مدل اتمی هلیوم در این تصویر عنصر هلیوم نشان داده شدهاست located in its outermost energy level. هلیوم از اعضای گازهای نجیب است و تشکیل شده از دو پروتون، نوترون و الکترون |
| گروه (جدول تناوبی) | الکترونهای ظرفیت |
|---|---|
| گروه ۱ (فلزات قلیایی) | ۱ |
| گروه ۲ فلزات قلیایی خاکی | ۲ |
| گروه ۳–۱۲ (فلزات واسطه) | #[1] |
| گروه ۱۳ (گروه بور) | ۳ |
| گروه ۱۴ (گروه کربن) | ۴ |
| گروه ۱۵ (گروه نیتروژن) | ۵ |
| گروه ۱۶ (chalcogens) | ۶ |
| گروه ۱۷ (هالوژنها) | ۷ |
| گروه ۱۸ (گازهای نجیب) | ۸[2] |
| گروه (جدول تناوبی) | ظرفیت (برای پیوندهای کووالانسی) |
|---|---|
| گروه ۱ (فلزات قلیایی) | - |
| گروه ۲ فلزات قلیایی خاکی | - |
| گروه ۳–۱۲ (فلزات واسطه) | - |
| گروه ۱۳ (گروه بور) | - |
| گروه ۱۴ (گروه کربن) | ۴ (فقط کربن) |
| گروه ۱۵ (گروه نیتروژن) | ۳ |
| گروه ۱۶ (chalcogens) | ۲ |
| گروه ۱۷ (هالوژنها) | ۱ |
| گروه ۱۸ (گازهای نجیب) | ۰ |
یادداشت
- مقدار ظرفیت برابر تعداد الکترونهای لایه دی است.
- به استثنا هلیوم که ظرفیت ۲ دارد.
منابع
- Francis, Eden. Valence Electrons.