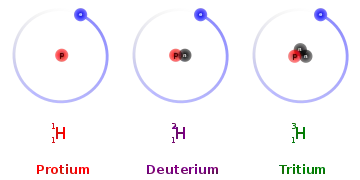
ایزوتوپهای هیدروژن
هیدروژن (۱H بهطور طبیعی دارای ۳ ایزوتوپ است که گاهی به صورت ۲H, ۱H, و ۳H نشان داده می شوند. دوتای اولی (یعنی ۲H, ۱H) پایدار هستند , درحالی که ۳H دارای نیمه-عمر ۱۲.۳۲ سال است. همچنین از هیدروژن ایزوتوپ های سنگین تری نیز وجود دارند که همگی مصنوعی (سنتزی) هستند، و نیمه-عمر آن ها کمتر از یک زپتوثانیه (۱۰−۲۱ ثانیه) است، از این میان، ۵H پایدارترین و، ۷H کمترین پایداری را دارد.[2][3]
| ||||||||||||||||||||||||||||||
| Standard atomic weight (Ar) |
| |||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
هیدروژن تنها عنصری است که ایزوتوپ های آن نام های متفاوتی به صورت عامیانه دارند: ایزوتوپ ۲H (یا هیدروژن-۲) معادل دوتریوم[4] و ایزوتوپ ۳H (یا هیدروژن-۳) معادل تریتیوم است.[5] نمادهای D و T گاهی اوقات برای اشاره به دوتریوم و تریتیوم استفاده میشوند. آیوپاک نمادهای D و T را قبول کرده است، اما پیشنهاد کرده است که به جای آن از "نمادهای استاندارد" (۲H و ۳H) استفاده شود، به جهت جلوگیری از سردرگمی در طبقه بندی حروف در فرمول شیمیایی.[6], هیدروژن معمولی بدون نوترون گاهی، پروتیوم نامیده میشود.[7] (در طول مطالعات اولیه رادیواکتیو به برخی از ایزوتوپ های رادیواکتیو سنگین نام های دیگری داده شد، اما چنین نام هایی امروزه به ندرت مورد استفاده قرار می گیرد.)
جدول ایزوتوپ ها
| نماد | Z(p) | N(n) | جرم ایزوتوپ (u) | نیمه عمر | حالت واپاشی[8] | ایزوتوپ دختر[n 1] | اسپین هستهای | representative isotopic composition (mole fraction)[n 2] |
range of natural variation (mole fraction) |
|---|---|---|---|---|---|---|---|---|---|
| 1H | ۱ | ۰ | ۱٫۰۰۷۸۲۵۰۳۲۰۷(۱۰) | پایدار[n 3][n 4] | 1⁄2+ | ۰٫۹۹۹۸۸۵(۷۰) | ۰٫۹۹۹۸۱۶–۰٫۹۹۹۹۷۴ | ||
| 2H[n 5] | ۱ | ۱ | ۲٫۰۱۴۱۰۱۷۷۷۸(۴) | پایدار | 1+ | ۰٫۰۰۰۱۱۵(۷۰)[n 6] | ۰٫۰۰۰۰۲۶–۰٫۰۰۰۱۸۴ | ||
| 3H[n 7] | ۱ | ۲ | ۳٫۰۱۶۰۴۹۲۷۷۷(۲۵) | ۱۲٫۳۲(۲) y | β- | 3 He |
1⁄2+ | Trace[n 8] | |
| 4 H |
۱ | ۳ | ۴٫۰۲۷۸۱(۱۱) | ۱٫۳۹(۱۰)×۱۰−۲۲ s [۴٫۶(۹) MeV] |
n | 3 H |
2− | ||
| 5 H |
۱ | ۴ | ۵٫۰۳۵۳۱(۱۱) | >۹٫۱×۱۰−۲۲ s ? | n | 4 H |
(1⁄2+) | ||
| 6 H |
۱ | ۵ | ۶٫۰۴۴۹۴(۲۸) | ۲٫۹۰(۷۰)×۱۰−۲۲ s [۱٫۶(۴) MeV] |
3n | 3 H |
2−# | ||
| 4n | 2 H | ||||||||
| 7 H |
۱ | ۶ | ۷٫۰۵۲۷۵(۱۰۸)# | ۲٫۳(۶)×۱۰−۲۳ s# | 4n | 3 H |
1⁄2+# | ||
- ایزوتوپهای پر رنگ شده پایدار هستند
- Refers to that in water.
- Greater than ۶٫۶×۱۰۳۳ yr. See proton decay.
- This and 3He are the only stable nuclides with more protons than neutrons
- Produced during هستهزایی مهبانگ
- Tank hydrogen has a 2
H abundance as low as ۳٫۲×۱۰−۵ (mole fraction). - Produced during Big Bang nucleosynthesis, but not primordial, as all such atoms have since decayed to 3He
- Cosmogenic
جستارهای وابسته
- ایزوتوپهای هلیم
منابع
- Meija, J.; et al. (2016). "Atomic weights of the elements 2013 (IUPAC Technical Report)". شیمی محض و کاربردی(نشریه). 88 (3): 265–91. doi:10.1515/pac-2015-0305.
- Y. B. Gurov; et al. (2004). "Spectroscopy of superheavy hydrogen isotopes in stopped-pion absorption by nuclei". Physics of Atomic Nuclei. 68 (3): 491–497. Bibcode:2005PAN....68..491G. doi:10.1134/1.1891200.
- A. A. Korsheninnikov; et al. (2003). "Experimental Evidence for the Existence of 7H and for a Specific Structure of 8He". فیزیکال ریویو لترز. 90 (8): 082501. Bibcode:2003PhRvL..90h2501K. doi:10.1103/PhysRevLett.90.082501. PMID 12633420.
- IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (1997). Online corrected version: (2006–) "دوتریوم".
- IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (1997). Online corrected version: (2006–) "tritium".
- آیوپاک (2005). Nomenclature of Inorganic Chemistry (IUPAC Recommendations 2005). Cambridge (UK): انجمن سلطنتی شیمی–آیوپاک. شابک ۰−۸۵۴۰۴−۴۳۸−۸. p. 48. Electronic version.
- IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (1997). Online corrected version: (2006–) "protium".
- http://www.nucleonica.net/unc.aspx
- مشارکتکنندگان ویکیپدیا. «Isotopes of hydrogen». در دانشنامهٔ ویکیپدیای انگلیسی، بازبینیشده در ۶ آذر ۱۳۹۲.
پیوند به بیرون
| در ویکیانبار پروندههایی دربارهٔ ایزوتوپهای هیدروژن موجود است. |
- B. Dumé (7 March 2003). "Hydrogen-7 makes its debut". Physics World.