بتالاکتاماز
آنزیمهایی هستند که توسط بعضی باکتریها تولید شده و باعث تخریب حلقه بتالاکتام موجود در آنتیبیوتیکهای گروه بتالاکتام شامل پنیسیلینها و سفالوسپورینها میشوند. بتالاکتامازها حلقه β-lactam را هیدرولیز میکنند. براساس عملکرد بتالاکتامازها به چهار گروه تقسیم میشوند.
| Beta-lactamase | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
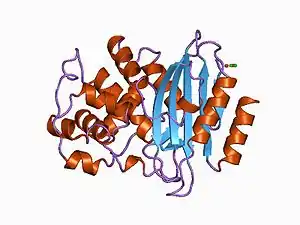 Structure of a Streptomyces albus beta-lactamase | |||||||||||
| شناسهها | |||||||||||
| نماد | β-lactamase domain | ||||||||||
| پیفم | PF00144 | ||||||||||
| پیفم clan | CL0013 | ||||||||||
| اینترپرو | IPR001466 | ||||||||||
| PROSITE | PS00146 | ||||||||||
| SCOPe | 56601 / SUPFAM | ||||||||||
| |||||||||||
مکانیسمهای مقاومت باکتریایی در برابر آنتیبیوتیکها، متفاوت بوده و یکی از مهمترین آنها تولید آنزیمهای بتالاکتاماز توسط باکتریهاست که عامل مقاومت در برابر آنتیبیوتیکهای بتالاکتام است. این آنزیمها از طریق هیدرولیز هسته مرکزی آنتیبیوتیکهای بتالاکتام باعث از بین رفتن اثرات آنها و غیر فعال شدن آنها میشوند. متالوبتالاکتامازها، از جمله آنزیمهای بتالاکتامازی هستند که توسط برخی باکتریهای مقاوم ترشح شده و باعث مقاومت به اکثر آنتیبیوتیکهای بتالاکتام میشود. این آنزیمها بهطور وسیعی در میان باکتریها توزیع شدهاند و نقش اصلی را در مقاومت ذاتی و اکتسابی باکتریها ایفا میکنند. متالوبتالاکتامازها طیف سوبسترایی وسیعی دارند و قادر به هیدرولیز تمام بتالاکتامها به جز منوباکتامها هستند. این آنزیمها داخل اینتگرون قرار گرفته و میتوانند در پلاسمید یا کروموزوم ادغام شوند، لذا قابلیت انتقال به سایر سویههای سودوموناس و باکتریهای دیگر از جمله انترو باکتریاسهها را دارند. اما بهطور برجسته و شاخص ژن این آنزیم در سویههایسودوموناس آئروژینوزا به وفور مشاهده میشود.[1] آنزیمهای متالوبتالاکتاماز، اولین بار در سال 1991 در ژاپن از باکتری سودوموناس آئروژینوزا گزارش شد. پس از آن از نواحی مختلف دنیا شامل آسیا، اروپا، استرالیا، امریکای شمالی و جنوبی نیز گزارش شدهاست. در حال حاضر سویههای سودوموناس آئروژینوزا تولیدکننده متالوبتالاکتامازها از سراسر دنیا گزارش میشود. الگوهای متفاوتی برای طبقهبندی آنزیمهای بتالاکتاماز وجود دارد. یکی از این روشها که بیشتر مورد استفاده قرار میگیرد به وسیله Bush- Jacoby- Medeiros ابداع گردیده است که بر اساس نوع سوبستراها، ممانعتکنندگی و خصوصیات فیزیکی مانند وزن ملکولی و نقطه ایزوالکتریک بنا شده است. متالوبتالاکتامازها از جمله آنزیمهای بتالاکتاماز هستند که در گروه 3 از طبقهبندی Bush و کلاس B از طبقهبندی Ambler قرار گرفتهاند، و به کاتیونهای دو ظرفیتی (مانند فلز روی) به عنوان کوفاکتور برای فعالیت آنزیمی خود نیاز دارند. امروزه شاهد روز افزون مقاومتهای باکتریایی و عفونتهای ناشی از آنها در جهان هستیم. این مسئله یکی از بحرانهای موجود در درمان عفونتهای ناشی از این باکتریهاست. انتقال و انتشار سریع ارگانیسمهایی که قادر به تولید آنزیمهای مذکورند، باعث بالا رفتن میزان عفونتهای بیمارستانی مربوط در سراسر دنیا شدهاست. از جمله باکتریهایی که در ایجاد عفونتهای بیمارستانی دخیل است، میتوان به سودوموناس آئروژینوزا اشاره کرد.[2]
آنتی بیوتیکهای بتالاکتام
باکتریها موجودات هوشمند زندهای هستند که وقتی در مقابل ناسازگاری محیطی قرار میگیرند، عکسالعمل نشان میدهند. به بیان دیگر تغییرات ژنتیکی که در باکتریها رخ میدهد، منجر به مقاوم شدن آنها و ظهور اشکال مقاوم به آنتیبیوتیکها میشود. بیشتر باکتریها بهطور ذاتی حساسند وقتی باکتری در معرض آنتی بیوتیک قرار میگیرد، امکان بروز جهش در آن وجود دارد یعنی تغییر در اطلاعات ژنتیکی باکتری، توانایی مقاومت به آنتیبیوتیک را به باکتری میدهد. بتالاکتامها داروهای مناسبی جهت درمان عفونتهای باکتریایی هستند که در سراسر جهان مورد استفاده قرار میگیرند.[3]
بتالاکتامازها
مکانیسم اصلی مقاومت باسیلهای گرم منفی به عوامل ضد میکروبی بتالاکتام، تولید آنزیمهای بتالاکتاماز است. بتالاکتامازها پروتئینهای گلوبولاری هستند که دارای 11 هلیکس آلفا و5 صفحه بتا میباشند و تاکنون ساختمان سه بعدی تعدادی از آنها تعیین شدهاست. این آنزیمها پیوند آمیدی حلقه بتالاکتام را شکسته و آنتیبیوتیکهای بتالاکتام را برای باکتری بی اثر میکنند، در نتیجه درمان آنتیبیوتیکی را با شکست مواجه میکنند .[4]
مکانیسمهای مقاومت باکتریایی در برابر آنتیبیوتیکها، متفاوت بوده و یکی از مهمترین آنها تولید آنزیمهای بتالاکتاماز توسط باکتریهاست که عامل مقاومت در برابر آنتیبیوتیکهای بتالاکتام است. این آنزیمها از طریق هیدرولیز هسته مرکزی آنتیبیوتیکهای بتالاکتام باعث از بین رفتن اثرات آنها و غیر فعال شدن آنها میشوند.
طبقهبندی بتالاکتامازها
با پیدایش آنزیمهای بتالاکتاماز در میان باکتریها پدیده مقاومت در بسیاری ازآنها، بخصوص باکتریهای ایجادکننده عفونتهای بیمارستانی در حال افزایش است. در نتیجه درمان عفونتهای ناشی از آنها را با مشکلات جدی روبرو ساخته است. بتالاکتامازها به دو صورت مولکولی (Ambler) و عملکردی (Bush- Jacoby- Medeiros) طبقهبندی میشوند. طبقهبندی مولکولی توسط Ambler در سال 1980، هنگامی که فقط سکانس چهار اسید آمینه از بتالاکتامازها شناسایی شده بود، صورت گرفت. بتالاکتامازها براساس ساختاراولیه به چهار کلاس مولکولی A تا D تقسیم میشوند.
کلاس A: باعث هیدرولیز پنی سیلینها و سفالوسپورینها میشود.[5]
کلاس B: متالوبتالاکتامازهای وابسته به روی (zn) میباشد که قادر به هیدرولیز کارباپنمها بوده و در باکتریهایی مانند سراشیامارسسنس و سودوموناس آئروژینوزا گزارش شدهاند. کلاس B بر اساس تفاوت آمینواسیدی که در جایگاه فعال این آنزیمها وجود دارد به 3 زیر کلاس B3، B2،B1 تقسیم میشود.
کلاسC : که از آنها میتوان به Ampc بتالاکتامازها اشاره نمود که توانایی هیدرولیز سفالوسپورینها و سفومایسینها را دارند .
کلاس D : بتالاکتامازهایی با قدرت هیدرولیز فراوان مثل اوکساسی لیناز علیه کلوکسازینها و اکساسیلینها هستند.
در طبقهبندی Bush، که در سال 1995 ارائه شد بتالاکتامازها براساس پروفایل سوبسترایی و پروفایل مهارکنندگی به سه گروه و چندین زیر گروه تقسیم میشوند:
گروه1: سفالوسپورینازهایی هستند که توسط مهارکنندههای بتالاکتامازی مانند کلاولانیک اسید مهار نمیشوند.
گروه2: پنی سیلینازها یا سفالوسپورینازها یا هر دو را شامل میشود. توسط مهارکنندههای بتالاکتامازی مهار میشوند. بر اساس سوبسترای خود به 8 زیر گروه2 f ،2e ،2d،2c، 2br 2be، 2b ،2a تقسیم میشوند.
گروه3: شامل متالوبتالاکتامازهایی هستند که در سایت فعال آنها فلز روی وجود دارد که برای تخریب حلقه بتالاکتام مورد استفاده قرار میگیرد. این آنزیمها طیف سوبسترائی وسیعی دارند و قادر به هیدرولیز تمام بتالاکتامها به جز منوباکتام (آزترئونام) هستند. این آنزیمها داخل اینتگرون قرار گرفته و میتوانند در پلاسمیدها یا کروموزوم ادغام شوند. لذا قابلیت انتقال به سایر سویههای سودوموناس و باکتریهای دیگر از جمله انتروباکتریاسهها را دارند. متالوبتالاکتامازها توسط مهارکنندههای بتالاکتامازی مهار نمیشوند. بلکه توسط شلاته کنندههای فلزی از قبیل اتیلن دی آمین تترا استیک اسید (EDTA) و گروه تیول مهار میشوند .[5]
متالوبتالاکتامازها
یکی از مهمترین دستاوردهای علم پزشکی، کشف و معرفی آنتیبیوتیکهای بتالاکتام بود که در اواخر جنگ جهانی دوم صورت گرفت. ظهور مقاومت در میان باکتریها نسبت به داروها، به ویژه آنتیبیوتیکهای خانواده بتالاکتام به زمان استفاده بیرویه پنیسیلین در جنگ جهانی دوم برمیگردد. در آن دوران، پنیسیلین به عنوان داروی اعجاز قرن معرفی شد اما در اثر مصرف بیش از حد این دارو گزارشهایی مبنی بر مقاومت افراد نسبت به این دارو در نقاط مختلف جهان گزارش شدهاست. یکی از مهمترین مکانیسمهایی که، باکتریها علیه آنتیبیوتیکهای بتالاکتام به کار میبرند تولید آنزیمهای بتالاکتاماز است. از آنزیمهای بتالاکتاماز، میتوان به متالوبتالاکتامازها اشاره کرد که توسط برخی باکتریهای مقاوم ترشح شده و باعث مقاومت به اکثر آنتیبیوتیکهای بتالاکتام میشود. متالوبتالاکتامازها طیف سوبسترایی وسیعی دارند و قادر به هیدرولیز تمام بتالاکتامها به جز منوباکتامها هستند. ژن این آنزیمها داخل اینتگرون قرار گرفته و میتوانند در پلاسمید یا کروموزوم ادغام شوند، لذا قابلیت انتقال به سایر سویههای سودوموناس و باکتریهای دیگر از جمله خانواده انترو باکتریاسهها را دارند. اما بهطور برجسته و شاخص ژن این آنزیم در سویههای سودوموناس آئروژینوزا به وفور مشاهده میشود . آنزیمهای متالوبتالاکتاماز، اولین بار سال 1991 در ژاپن از باکتری سودوموناس آئروژینوزا گزارش شد. پس از آن از نواحی مختلف دنیا شامل آسیا، اروپا، استرالیا، امریکای شمالی و جنوبی نیز گزارش شدهاست. در حال حاضر سویههای سودوموناس آئروژینوزا مولد متالوبتالاکتامازها از سراسر دنیا گزارش میشود .[2]
مهارکنندههای متالوبتالاکتامازها
در سال 1980 آموکسی سیلین-کلاولانات معرفی شد این دارو، حاوی یک بتالاکتام (آمپی سیلین) و مهارکننده بتالاکتامازی (کلاولانیک اسید) است. و در درمان عفونتهای ناشی از باکتریهای مقاوم به ESBL مورد استفاده قرار می گیرد. . مهار کنندههایی از این قبیل و یا مهار کنندههایی مثل سولباکتام و تازوباکتام که برای مهار ESBLها بکار میرود، در مورد MBLها کاربردی ندارد. بلکه این آنزیمها توسط شلاته کنندههای فلزی از قبیل اتیلن دی آمین تترا استیک اسید (EDTA)، سدیم مرکاپتو استیک اسید، ۲ مرکاپتو پروپیونیک اسید و گروه تیول مهار میشوند .[6]
تشخیص متالوبتالاکتامازها
روشهای موجود برای تشخیص متالوبتالاکتامازها شامل روشهای فنوتیپی و روشهای ژنوتیپی میباشد :[6]
شناسایی فنوتیپی متالوبتالاکتامازها
متأسفانه روشهای فنوتیپی استانداری برای تشخیص متالوبتالاکتامازها وجود ندارد. تستهای معتبر برای تشخیص احتمالاً وابسته به ژنهایی است که توسط سودوموناس یا تعدادی از اعضای خانواده انتروباکتریاسهها حمل میشود و میزان مقاومت را نشان میدهد . از روشهای فنوتیپی که برای تشخیص MBLها به کار میرود،میتوان به روش دیسک دیفیوژن آگار،MIC،Hodge test،
DDST Method،Combined Disk و E- test اشاره کرد.
لیکن پر کاربردترین روشهای فنوتیپی مورد استفاده، اجرای غربالگری پلیت به روش دیسک دیفیوژن و MIC،همچنین تستهای تاییدی مانند دیسک ترکیبی و E- test است.[6]
تستهای غربالگری
تعیین حداقل غلظت بازدارندگی رشد باکتری (MIC):
حداقل غلظتی از دارو که سبب ممانعت از رشد باکتری در محیط شده و به عنوان حداقل غلظت ممانعتکنندگی از رشد نامیده میشود. تست براث دایلوشن باید در محیط مولر هینتون براث پس از تلقیح سوسپانسیون میکروبی استاندارد و آنتیبیوتیک مورد نظر صورت گیرد. پس از 16 الی 18 ساعت انکوباسیون، درصورتی ایزولههای سودوموناس مولد MBL در نظر گرفته میشود که میزان MIC برای سیپروفلوکسازین و سفپیم g/mlμ4 <، سفتازیدیم g/mlμ32<و برای ایمیپنم g/mlμ16<باشد.[7]
روش دیسک آگار دیفیوژن
تست غربالگری دیسک دیفیوژن باید بر روی محیط کشت مولر هینتون آگار که توسط سوسپانسیون میکروبی مطابق با کدورت نیم مک فارلند تلقیح شدهاست، صورت گیرد و پس از 16 الی 18 ساعت انکوباسیون در دمای 35-37 درجه سانتی گراد، قرائت شود. دیسکهای آنتیبیوتیکی مورد نیاز و همچنین قطر هاله عدم رشد ارگانیسمها در برابر هر یک از دیسکها طبق استانداردهای CLSI صورت میگیرد.[8]
تستهای تاییدی
تست دیسک ترکیبی:
این تست متعاقب، آزمایش دیسک دیفیوژن انجام میگیرد. در این روش برای تشخیص وجود MBLها از پلیتی که حاوی ایمیپنم با یا بدون EDTA است، استفاده میگردد. سویههای مقاوم به ایمیپنم (هاله عدم از رشد کمتر از mm16) جهت بررسی تولید متالو بتالاکتاماز (MBL) انتخاب میشوند،افزایش منطقه ممانعت از رشد دیسک IPM-EDTA به مقدارمقدارmm۷≤ نسبت به دیسک ایمیپنم به تنهایی به عنوان متالوبتالاکتاماز مثبت در نظر گرفته میشود.[8]
E- test
در این تست از نوارهای Sweden, Solna , AB BioDisk استفاده میشود. این نوارها از دو نیمه تشکیل شده، در یک نیمه (IP) گرادیانی از غلظتهای مختلف ایمیپنم( g/mlμ256-4 ) و در نیمه دیگر (IPI) گرادیانی از غلظتهای مختلف ایمیپنم همراه با غلظت ثابتی g/mlμ64-1) EDTA) قرار دارد. تفسیر E- test mbl به صورت کاهش سه رقت یا بیشتر،MIC ایمیپنم در حضور EDTA یا اگر نسبت IPMIC به IPI بزرگتر یا مساوی 8 باشد بیانگر تولید متالوبتالاکتاماز میباشد. همچنین اگر ناحیه اضافی به نام (Phantom Zone) بین قسمتهای IP وIPI مشاهده شود و یا هاله عدم رشد
IP یا IPI در انتهای باریک شونده بیضی مهار دچار تغییر شکل گردند بدون در نظر گرفتن نسبت IP MIC به IPI مولد متالوبتالاکتاماز تلقی میگردد .[9]
شناسایی ژنوتیپی متالوبتالاکتامازها
روشهای ژنتیکی که برای تشخیص MBLها مورد استفاده قرار میگیرد، همانند روشهای استفاده شده برای شناسایی بتالاکتامهای وسیع الطیف میباشد. از جمله این روشها میتوان به روش PCR،DNA پروب و توالی یابی اشاره کرد .[6]
PCR
واکنش زنجیره پلیمراز اولین بار در اواسط دهه 1980 توسط کریمولیس ابداع گردید که مجموعهای از واکنشهای بیوشیمیایی است که طی آن قطعه مشخصی از DNA بهطور اختصاصی و با حساسیت فوقالعاده به تعداد زیادی تکثیر میگردد. به این ترتیب میتوان قطعه کوچکی از یک ژنوم بزرگ را که قابل دستیابی نیست بهطور انبوه تولید و استفاده کرد. این فرایند، کاربردهای زیادی در تحقیقات بیولوژیکی از جمله تشخیص مولکولی، تشخیص سریع عوامل بیماریهای عفونی، تشخیص قبل از تولد امراض ژنتیکی، تجزیه و تحلیل مولکولی نمونههای تاریخی و صدها مورد دیگر دارد.[6]
هیبریداسیون به وسیله پروبهای DNA
این روش برای هر ژن اختصاصی است، برای هر ژن یک پروب نیاز است در این روش بین انواع مختلف ژنها نمیتوان افتراق قائل شد. پروبهای الیگونوکلئوتیدی نشاندار شده با بیوتین یا رادیوایزوتوپ جهت شناسایی جهشهای نقطهای، تحت شرایط هیبریداسیون طراحی شدند .[6]
درمان باکتریهای مولد متالوبتالاکتامازها
ژنهای کدکننده آنزیمهای MBL بیشتر روی پلاسمیدها قرار دارند. از باکتریهایی که حامل این ژنهای پلاسمیدی هستند، میتوان به سودوموناس آئروژینوزا و اسینتو باکتر اشاره کرد و به مقدار کمتر گروه انتروباکتریاسه نیز دارای این ژنها میباشند. این باکتریها به علت دارا بودن بتالاکتامازهای وسیع الطیف، به اکثر کلاسهای آنتیبیوتیکی مقاومت طبیعی پیدا کردند. سویههای مولد MBL، به دلیل پیوستگی ژنتیکی، به اکثر خانوادههای آنتیبیوتیکی از جمله سولفانامیدها، کینولونها و آمینوگلیکوزیدها مقاومت نشان میدهند.کارباپنمها از جمله ایمیپنم و مروپنم از مهمترین آنتیبیوتیکهای ضدمیکروبی هستند که برای درمان عفونتهای ناشی از باکتریهای مولد MBL به کار میروند. اما به دلیل افزایش مقاومت برخی باکتریها به ایمیپنم و مروپنم، امروزه بیشتر از آزترئونام با دوزهای بالا استفاده میشود که داروی مؤثری علیه این باکتریها محسوب میشود. مهارکنندههای متالو آنزیمی که در آزمایشگاه مورد استفاده قرار میگیرند در درمان عفونتهای ناشی از این باکتریها کاربردی ندارند. همچنین برای درمان این عفونتها از پلیمیکسین B و کلسیتین نیز میتوان استفاده کرد .[1]
اپیدمیولوژی متالوبتالاکتامازها
متالوبتالاکتامازهای پلاسمیدی اولین بار از سویه GN17203 سودوموناس آئروژینوزا در ژاپن سال 1998 شناسایی گردید. آنزیم IMP انتشار و گسترش وسیعی در شرق دور بخصوص ژاپن، اروپا (ایتالیا)، امریکای جنوبی دارد. امروزه ژنهای VIM گسترش و پراکندگی وسیعی در سراسر دنیا دارند و باعث مقاومت نسبت به آنتیبیوتیکهای بتالاکتامی شدهاند. این آنزیم بیشتر در کشورهایی نظیر ایتالیا، کره جنوبی، یونان، ژاپن و تایوان مشاهده میشود. SPM از برزیل و امریکای جنوبی و GIMاز آلمان گزارش شدهاست .[1][6]
| β-Lactamase | |||||||||
|---|---|---|---|---|---|---|---|---|---|
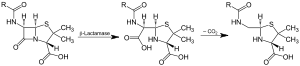 Action of β-lactamase and decarboxylation of the intermediate | |||||||||
| شناساگرها | |||||||||
| شمارهٔ ایسی | 3.5.2.6 | ||||||||
| شمارهٔ سیایاس | 9073-60-3 | ||||||||
| پایگاههای داده | |||||||||
| اینتنز | نمایش اینتنز | ||||||||
| برندا | مدخل برندا | ||||||||
| اکسپسی | نمایش NiceZyme | ||||||||
| کیایجیجی | مدخل کیایجیجی | ||||||||
| متاسایک | گذرگاه سوختوساز | ||||||||
| پریام | نمایه | ||||||||
| ساختارهای پیدیبی | RCSB PDB PDBe پیدیبیسام | ||||||||
| هستیشناسی ژن | AmiGO / QuickGO | ||||||||
| |||||||||
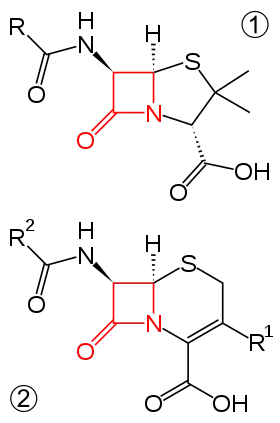
برخی از این آنزیمها ناشی از نوعی جهش بوده و آنزیم در عضوی به نام پلاسمید باکتری ساخته میشود. جهت جلوگیری از گسترش این گونهها باید از مصرف بی رویه آنتیبیوتیکها خودداری نمود و در مواجه با این گونهها برای درمان از آنتیبیوتیکهای مقاوم به بتالاکتاماز استفاده میشود...
جستارهای وابسته
منابع
- Van Gorkom, Hans J.; Pulles, Martin P.J.; Wessels, Jan S.C. (1975-12). "Light-induced changes of absorbance and electron spin resonance in small Photosystem II particles". Biochimica et Biophysica Acta (BBA) - Bioenergetics. 408 (3): 331–339. doi:10.1016/0005-2728(75)90134-6. ISSN 0005-2728. Check date values in:
|date=(help) - Mendiratta, DK; Narang, P; Buchunde, S; Deotale, V (2012). "Comparison of disc and MIC reduction methods with polymerase chain reaction for the detection of metallo-β-lactamase in Pseudomonas aeruginosa". Indian Journal of Medical Microbiology. 30 (2): 170. doi:10.4103/0255-0857.96683. ISSN 0255-0857.
- Wilke, Mark S; Lovering, Andrew L; Strynadka, Natalie CJ (2005-10). "β-Lactam antibiotic resistance: a current structural perspective". Current Opinion in Microbiology. 8 (5): 525–533. doi:10.1016/j.mib.2005.08.016. ISSN 1369-5274. Check date values in:
|date=(help) - Galliard, T.; Phillips, D.R.; Matthew, J.A. (1975-11). "Enzymic reactions of fatty acid hydroperoxides in extracts of potato tuber II. Conversion of 9- and 13-hydroperoxy-octadecadienoic acids to monohydroxydienoic acid, epoxyhydroxy- and trihydroxymonoenoic acid derivatives". Biochimica et Biophysica Acta (BBA) - Lipids and Lipid Metabolism. 409 (2): 157–171. doi:10.1016/0005-2760(75)90151-4. ISSN 0005-2760. Check date values in:
|date=(help) - Caras, Ingrid; Shapiro, B. (1975-11). "Partial purification and properties of microsomal phosphatidate phosphohydrolase from rat liver". Biochimica et Biophysica Acta (BBA) - Lipids and Lipid Metabolism. 409 (2): 201–211. doi:10.1016/0005-2760(75)90154-x. ISSN 0005-2760. Check date values in:
|date=(help) - Koivula, Timo; Koivusalo, Martti (1975-11). "Partial purification and properties of a phenobarbital-induced aldehyde dehydrogenase of rat liver". Biochimica et Biophysica Acta (BBA) - Enzymology. 410 (1): 1–11. doi:10.1016/0005-2744(75)90202-8. ISSN 0005-2744. Check date values in:
|date=(help) - Elgart, Edward S.; Gusovsky, Tatiana; Rosenberg, Murray D. (1975-11). "Preparation and characterization of an enzymatically active immobilized derivative of myosin". Biochimica et Biophysica Acta (BBA) - Enzymology. 410 (1): 178–192. doi:10.1016/0005-2744(75)90219-3. ISSN 0005-2744. Check date values in:
|date=(help) - Barry، Arthur (۲۰۰۷-۰۵-۲۲). An Overview of the Clinical and Laboratory Standards Institute (CLSI) and Its Impact on Antimicrobial Susceptibility Tests. CRC Press. صص. ۱–۶. شابک ۹۷۸۰۸۲۴۷۴۱۰۰۶.
- Tan, Agnes W.H.; Nuttall, Frank Q. (1975-11). "Characteristics of the dephosphoryated form of phosphorylase purified from rat liver and measurement of its activity in crude liver preparations". Biochimica et Biophysica Acta (BBA) - Enzymology. 410 (1): 45–60. doi:10.1016/0005-2744(75)90206-5. ISSN 0005-2744. Check date values in:
|date=(help)