توان سلولی
توان سلولی مفهومی است که توانایی یک سلول برای متمایز شدن و تبدیل شدن آن سلول به سلولهای دیگر تعریف میشود.[1] هرچه یک سلول پتانسیل این را داشتهباشد که به انواع بیشتری از سلولهای دیگر تبدیل شود، قدرت یا پتانسیل آن سلول بیشتر است. پتانسیل سلولی همینطور با تعریف پتانسیل فعالسازی ژنها در داخل یک سلول نیز مطرح میشود، مانند زنجیرهای که با همهتوان آغاز میشود که این نوع از سلولها بیشترین پتانسیل تمایز را دارند و سپس دانههای بعدی زنجیر که درجهٔ پتانسیل آنها به ترتیب کاهش میابد شامل سلولهای پرتوان، چندتوان، کمتوان و در نهایت تکتوان. واژهٔ (potency) یا توان (پتانسیل) از لغت لاتین (potens) آمدهاست که به معنی داشتن قدرت و پتانسیل میباشد.
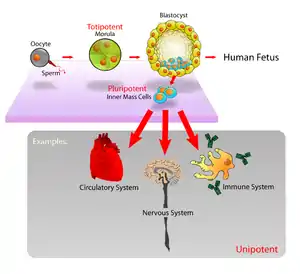
همهتوان (به انگلیسی: Totipotency) همهتوان به معنی این است که یک سلول، توانایی این را داشته باشد که با تقسیم شدن، تمام انواع سلولهای متمایز در یک جاندار را ایجاد کند. هاگ (یا اسپور) و یاختهٔ تخم نمونههایی از سلولهای همهتوان هستند.[2] در طیف مربوط به پتانسیل سلولها، همهتوان، بیشترین پتانسیل ایجاد تمایز سلولی را دارد. واژهٔ Toti از لغت لاتین totus به معنی «کامل» ریشه گرفتهاست.
برای سلولی که بهطور کامل تمایز پیدا کردهاست و به یک سلول مشخص تبدیل شدهاست، این قابلیت وجود دارد که به سلول با وضعیت همهتوان برگردد.[3] این تبدیل به همهتوان پیچیدهاست و هنوز بهطور کامل فهمیده و کشف نشده و از موضوعات تحقیقاتی روز میباشد. تحقیقات در سال ۲۰۱۱ نشان دادهاند که سلولها به یک سلول کاملاً همهتوان تبدیل نمیشوند، بلکه به انواع پیچیدهٔ سلولی از قابلیت همهتوان تبدیل میشوند.[4] سلولهای بنیادینی که همانند جوانهساهای همهتوان در ۲ مرحلهٔ جنینی هستند، بهطور خودبخود در محیط کشت سلولهای بنیادین جنینی میتوانند رشد کند.[5][6]
با استفاده از مدل تکامل انسان میتوان توضیح داد که سلولهای همهتوان چگونه ایجاد میشوند و رشد میکنند.[7] تکامل انسان زمانی آغاز میشود که یک اسپرم یک تخم را بارور میکند و تخم بارور شدهٔ حاصل، یک سلول همهتوان به نام زایگوت (یاختهٔ تخم) را به وجود میآورد.[8] چند ساعت ابتدایی پس از عملیات بارورسازی، این سلول زایگوت به سلولهای همهتوان یکسان تبدیل میگردد، که هر کدام از این سلولها میتواند به یکی از سه لایهٔ جنینی انسانی (درونپوست، میانپوست و برونپوست)، یا به سلولهای لایهٔ cytotrophoblast یا لایهٔ synsytiotrophoblast از جفت تکامل یابد. پس از اینکه تعداد این سلولهای تقسیم شده به ۱۶ عدد رسید، سلولهای همهتوان توته یا توتاله به سلولهایی متمایز و مشتق میشوند که نهایتاً به inner cell mass بلاستوسیست یا trophoblast خارجی تبدیل میگردند. تقریباً به مدت چهار روز پس از باروری وا انجام شدن تعداد زیادی چرخهٔ تقسیم سلولی، این سلولهای همهتوان شروع به اختصاصی شدن میکنند. Inner cell mass، یا همان منبع سلولهای بنیادین جنینی، به سلولهای پرتوان تبدیل میشوند.
تحقیقات روی کرم الگانس نشان دادهاست چند مکانیزم شامل تنظیمات rna میتوانند در حفظ ویژگی همهتوانی در مراحل مختلف تکامل در بعضی از گونهها نقش داشته باشند.[9] کار روی گورخرماهی و پستانداران، تعاملات بیشتری بین ریزآرانایها و (RNA binding proteins(RBPs در تشخیص تفاوتهای تکاملی پیشنهاد میدهد.[10]
پرتوانی
در زیستشناسی سلولی، پرتوانی یا pluripotency (از واژهٔ لاتین plurimus، به معنای خیلی زیاد و potens به معنای داشتن قدرت)[11] به سلول بنیادینی اشاره میکند که پتانسیل این را دارد که به یکی از سه لایهٔ جنینی زیر متمایز و تبدیل شود: درونپوست (پوشش درونی شکم، دستگاه گوارش، ریهها)، میانپوست (ماهیچهها، استخوان، خون)، یا برونپوستی (بافتهای اپیدرمی و سیستم عصبی).[12]
پرتوانی سلول، یک زنجیره است که از سلول همهتوان که قابلیت ایجاد همهٔ انواع سلولهای جنینی مانند سلولهای بنیادین جنینی، و IPSCs را دارند، آغاز میشود و به دستهای از سلولها میرسد که بخشی از ویژگی پ همهتوانی را دارا هستند و میتوانند به هر سه نوع سلولهای لایههای جنینی تبدیل شوند ولی تمام خصیصههای سلولهای همهتوان را ندارند.
پرتوانی القایی
سلولهای بنیادین پرتوان القایی (Induced pluripotency)، که به اختصار سلولهای iPS یا iPSCs نامیده میشوند، انواعی از سلولهای بنیادین پرتوان هستند که به صورت مصنوعی از یک سلول غیر پرتوان بدست میآیند، که معمولاً این سلولها، یاختههای پیکری بالغ هستند و این کار از طریق فرایندهایی است که سلول را به اجبار و از طریق مکانیزمهایی وادار به بیان ژنها و عوامل رونویسی مشخصی میکنند.[13] این عوامل رونویسی، نقش کلیدی تعیینکنندهای در ایجاد وضعیت سلول دارند و هم چنین تأکیدی بر این حقیقت است که این سلولهای پیکری، اطلاعات ژنتیکی مشابه سلولهای جنینی اولیه را حفظ میکنند.[14] قابلیت القای سلولها به وضعیت پرتوانی، اولین بار در سال ۲۰۰۶ با استفاده از فیبروبلاست موش و چهار عامل رونویسی Oct4، Sox2، Klf4 و c-Myc انجام شد.[15] این تکنیک که بازبرنامهریزی نامیده میشود، باعث شد شنایا یاماناکا (Shinya Yamanaka) و جان گوردون (John Gurdon) جایزهٔ نوبل در روانشناسی و پزشکی را در سال ۲۰۱۲ بگیرند.[16] در راستای این تلاش، در سال ۲۰۰۷ القائ موفقیتآمیز iPSC انسانی که از فیبروبلاست پوستی و غشایی استخراج شده بود، با روشی مشابه متد مورد استفاده برای القای سلول موشی، انجام شد.[17] این سلولهای القا شده، ویژگیها و خصیصههای مشابه سلولهای بنیادین جنینی (ESCs) را دارند، اما نیازی به استفاده از جنین نیست. بعضی از شباهتهای بینESCها و iPSCها شامل پرتوانی، مورفولوژی، توانایی خودبازیابی، خصیصهای که نشان میدهد آنها میتوانند بهطور نامحدود تقسیم و تکرار شوند و بیان ژنآنها میباشد.[18]
فاکتورهای اپیژنتیک نیز به نظر میرسد در بازبرنامهریزی یاختههای پیکری در القای پرتوانی درگیر هستند. این تئوری مطرح است که فاکتورهای اپیژنتیک خاصی، نشانها و علائم اپیژنتیک پیکری اولیه (original somatic epigenetic marks) را پاک میکنند تا علائم اپیژنتیکی جدیدی را بدست آورند که بخشی از اکتساب وضعیت پرتوانی است. کروماتین نیز در iPSC مانند ESC شناخته شدهاست به طوریکه در آن کمتر فشرده و در نتیجه بیشتر قابل دسترسی است. تغییرات Euchromatin نیز رایج است بطوریکه با وضعیت euchromatin در ESCها سازگار است.[18]
به خاطر شباهت زیاد iPSCها به ESCها، iPSCها در پزشکی و تحقیقات اجتماعی بسیار مورد توجه هستند. iPSCها پتانسیل این را دارند که کاربردها و پیامدهای درمانی مشابه ESCها را بدون استفادهٔ بحثبرانگیز و جنجالی جنین در طی این فرایند که یک بحث اخلاقی در زیست میباشد، داشته باشند. علاوه بر این، مشخص شدهاست که بیان پیکریِ ترکیبی از عواملرونویسی بهطور مستقیم، میتواند انواع دیگری از سلولهای پیکری مشخص شده را (transdifferentiation) القا کند. محققان سه نسب عوامل رونویسی سلولهای عصبی را شناسایی کردهاند که میتواند بهطور مستقیم فیبروبلاست موشی را به نورونهای با کارکرد کامل تبدیل کنند.[19] این نتایج، طبیعت دگرگونی یاخته و درستی الزام نسب و مراحل تکوین را به چالش کشیدند و نشان میدهند که با ابزارهای مناسب و دقیق، تمام سلولها، همهتوان هستند و میتوانند انواع بافتها را ایجاد کنند. بعضی از کاربردهای پزشکی و درمانی iPSCها از بیمارانی بدست آمدهاست که کار پیوند بافت و سلولی را بدون ریسک پس زدن (که رایج است) انجام دادهاند.[20]
چندتوانی
_diagram_en.svg.png.webp)
چندتوانی یا multipotency، سلولهای نیایاخته یا پروژنیتوری هستند که پتانسیل فعالسازی ژنها برای ایجاد تمایز به سلولهای متفاوت جدا از یکدیگر را دارا هستند. برای مثال، یک سلول بنیادی خونی چندتوانی، یک سلول hematopoietic میباشد و این نوع از سلول میتواند خودش را به انواع بسیاری از سلولهای خونی مانند لنفوسیت، مونوسیت و نوتروفیل و غیره تمایز دهد. اما نمیتواند به سلولهای مغز یا استخوان یا سلولهایی غیر از سلولهای خونی تمایز پیدا کند.
تحقیقات اخیر مرتبط با سلولهای چندتوانی، این موضوع را مطرح میکنند که سلولهای چندتوانی ممکن است بتوانند به سلولهایی غیر مربوط تبدیل شوند. در مورد دیگری، سلولهای بنیادین خون بند ناف به سلولهای نورون انسانی تبدیل شدهاند.[21] تحقیقات روی تبدیل سلولهای چندتوانی به سلولهای پرتوان تمرکز دارند.[22]
سلولهای چندتوانی نه در همهٔ سلولها، بلکه در بسیاری از انواع سلولها وجود دارند. سلولهای چندتوان در خون بند ناف،[23] بافتهای چربی،[24] سلولهای قلب،[25] مغز استخوان و سلولهای بنیادین مزانشیم (MSCs) که در دندان آسیا وجود داشت، کشف شدند.[26]
کمتوان
کمتوانی در زیستشناسی، توانایی سلول پروژنیتور برای تمایز به چند نوع سلول است. در حقیقت بحت در رابطه با درجهٔ پتانسیل سلولها برای تمایز به انواع سلولها میباشد و درجهٔ این نوع از سلول و انواعی که میتواند به آنها تمایز پیدا کند نسبت به مدلهای بالا کمتر است. مثالهایی از سلولهای بنیادین کمتوانی، سلولهای بنیادین لنفوئید و میلوئید (وابسته به مغز استخوان) میباشند. بهطور خاص، سلولهای لنفوئید میتوانند باعث ایجاد انواع سلولهای خونی مانند سلولهای B و سلولهای T شوند، ولی نمیتوانند به انواع دیگری از سلولهای خونی مانند سلولهای قرمز خون تبدیل شوند. مثالی از سلولهای پروژنیتور، سلولهای بنیادین عروقی هستند که ظرفیت تبدیل شدن به هر دو نوع سلول لایهٔ درونرگی یا ماهیچههای صاف را دارند.
تکتوانی
در زیستشناسی سلولی، یک سلول تکتوان یا unipotent به مفهوم این است که یک سلول بنیادی ظرفیت این را دارد که تنها به یک نوع سلول تبدیل شود، توان یا پتانسیل این نوع از سلولها نسبت به دستههای دیگر برای ایجاد گونههای متفاوت سلولی، کمتر است. در حال حاضر اینکه آیا سلولهای بنیادین تکتوان واقعی وجود دارند یا نه مشخص نیست.[1]
جستارهای وابسته
- دگرگونی یاخته
- یاخته تخم
- یاخته بنیادی جنینی
منابع
- Hans R. Schöler (2007). "The Potential of Stem Cells: An Inventory". In Nikolaus Knoepffler; Dagmar Schipanski; Stefan Lorenz Sorgner. Human biotechnology as Social Challenge. Ashgate Publishing, Ltd. p. 28. ISBN 978-0-7546-5755-2.
- Mitalipov S, Wolf D (2009). "Totipotency, pluripotency and nuclear reprogramming". Advances in Biochemical Engineering/Biotechnology. 114: 185–99. Bibcode:2009esc..book..185M. شابک ۹۷۸−۳−۵۴۰−۸۸۸۰۵−۵ . PMC 2752493 Freely accessible. PMID 19343304. doi:10.1007/10_2008_45.
- Western P (2009). "Foetal germ cells: striking the balance between pluripotency and differentiation". Int. J. Dev. Biol. 53 (2–3): 393–409. PMID 19412894. doi:10.1387/ijdb.082671pw.
- Sugimoto K, Gordon SP, Meyerowitz EM (April 2011). "Regeneration in plants and animals: dedifferentiation, transdifferentiation, or just differentiation?". Trends Cell Biol. 21 (4): 212–8. PMID 21236679. doi:10.1016/j.tcb.2010.12.004.
- Macfarlan T.S. ; Gifford W.D. ; Driscoll S. ; Lettieri K. ; Rowe H.M. ; Bonanomi D. ; Firth A. ; Singer O. ; Trono D. & Pfaff S.L. (2012). "Embryonic stem cell potency fluctuates with endogenous retrovirus activity". Nature. 487: 57–63. PMC 3395470 Freely accessible. PMID 22722858. doi:10.1038/nature11244.
- Morgani S.M. ; Canham M.A. ; Nichols J. ; Sharov A.A. ; Migueles R.P. ; Ko M.S. & Brickman J.M. (2013). "Totipotent Embryonic Stem Cells Arise in Ground-State Culture Conditions". Cell Rep. 3: 1945–1957. PMC 3701323 Freely accessible. PMID 23746443. doi:10.1016/j.celrep.2013.04.034.
- Seydoux G, Braun RE (December 2006). "Pathway to totipotency: lessons from germ cells". Cell. 127 (5): 891–904. PMID 17129777. doi:10.1016/j.cell.2006.11.016.
- Asch R, Simerly C, Ord T, Ord VA, Schatten G (July 1995). "The stages at which human fertilization arrests: microtubule and chromosome configurations in inseminated oocytes which failed to complete fertilization and development in humans". Hum. Reprod. 10 (7): 1897–906. PMID 8583008.
- Ciosk, R. ; Depalma, Michael; Priess, James R. (10 February 2006). "Translational Regulators Maintain Totipotency in the Caenorhabditis elegans Germline". Science. 311 (5762): 851–853. Bibcode:2006Sci...311..851C. PMID 16469927. doi:10.1126/science.1122491.
- Kedde M, Agami R (April 2008). "Interplay between microRNAs and RNA-binding proteins determines developmental processes". Cell Cycle. 7 (7): 899–903. PMID 18414021. doi:10.4161/cc.7.7.5644.
- "Biology Online". Biology-Online.org. Retrieved 25 April 2013.
- Binder, Marc D. ; Hirokawa, Nobutaka; Uwe Windhorst, eds. (2009). Encyclopedia of neuroscience. Berlin: Springer. ISBN 978-3-540-23735-8.
- Baker, Monya (2007-12-06). "Adult cells reprogrammed to pluripotency, without tumors". Nature Reports Stem Cells. doi:10.1038/stemcells.2007.124.
- Stadtfeld, M. ; Hochedlinger, K. (15 October 2010). "Induced pluripotency: history, mechanisms, and applications". Genes & Development. 24 (20): 2239–2263. doi:10.1101/gad.1963910.
- Takahashi, Kazutoshi; Yamanaka, Shinya (August 2006). "Induction of Pluripotent Stem Cells from Mouse Embryonic and Adult Fibroblast Cultures by Defined Factors". Cell. 126 (4): 663–676. PMID 16904174. doi:10.1016/j.cell.2006.07.024.
- "The Nobel Prize in Physiology or Medicine 2012". Nobelprize.org. Nobel Media AB 2013. Web. 28 Nov 2013.
- Takahashi, Kazutoshi; Tanabe, Koji; Ohnuki, Mari; Narita, Megumi; Ichisaka, Tomoko; Tomoda, Kiichiro; Yamanaka, Shinya (1 November 2007). "Induction of Pluripotent Stem Cells from Adult Human Fibroblasts by Defined Factors". Cell. 131 (5): 861–872. PMID 18035408. doi:10.1016/j.cell.2007.11.019.
- Liang, Gaoyang; Zhang, Yi (18 December 2012). "Embryonic stem cell and induced pluripotent stem cell: an epigenetic perspective". Cell Research. 23 (1): 49–69. PMC 3541668 Freely accessible. PMID 23247625. doi:10.1038/cr.2012.175.
- Vierbuchen T, Ostermeier A, Pang ZP, Kokubu Y, Südhof TC, Wernig M (2010). "Direct conversion of fibroblasts to functional neurons by defined factors". Nature. 463 (7284): 1035–41. PMC 2829121 Freely accessible. PMID 20107439. doi:10.1038/nature08797.
- Park, IH; Lerou, PH; Zhao, R; Huo, H; Daley, GQ (2008). "Generation of human-induced pluripotent stem cells.". Nature Protocols. 3 (7): 1180–6. PMID 18600223. doi:10.1038/nprot.2008.92.
- Giorgetti A, Marchetto MC, Li M, Yu D, Fazzina R, Mu Y, Adamo A, Paramonov I, Cardoso JC, Monasterio MB, Bardy C, Cassiani-Ingoni R, Liu GH, Gage FH, Izpisua Belmonte JC (2012). "Cord blood-derived neuronal cells by ectopic expression of Sox2 and c-Myc". Proc. Natl. Acad. Sci. U.S.A. 109 (31): 12556–61. PMC 3412010 Freely accessible. PMID 22814375. doi:10.1073/pnas.1209523109.
- Guan K, Nayernia K, Maier LS, Wagner S, Dressel R, Lee JH, Nolte J, Wolf F, Li M, Engel W, Hasenfuss G (2006). "Pluripotency of spermatogonial stem cells from adult mouse testis". Nature. 440 (7088): 1199–203. PMID 16565704. doi:10.1038/nature04697.
- Yong Zhao; Theodore Mazzone (Dec 2010). "Human cord blood stem cells and the journey to a cure for type 1 diabetes". Autoimmun Rev. 10 (2): 103–107. PMID 20728583. doi:10.1016/j.autrev.2010.08.011.
- Tallone T; Realini C; Böhmler A; et al. (April 2011). "Adult human adipose tissue contains several types of multipotent cells". J Cardiovasc Transl Res. 4 (2): 200–10. PMID 21327755. doi:10.1007/s12265-011-9257-3.
- Beltrami AP; Barlucchi L; Torella D; et al. (September 2003). "Adult cardiac stem cells are multipotent and support myocardial regeneration". Cell. 114 (6): 763–76. PMID 14505575. doi:10.1016/S0092-8674(03)00687-1.
- Ohgushi H, Arima N, Taketani T (December 2011). "[Regenerative therapy using allogeneic mesenchymal stem cells]". Nippon Rinsho (in Japanese). 69 (12): 2121–7. PMID 22242308.