دگرشکلیهای فسفر
عنصر فسفر میتواند در قالب دگرشکلیهای گوناگونی دیده شود که آنچه از آن بیشتر دیده شده، فسفرهای سفید و قرمز جامد بودهاست. فسفر جامد بنفش و سیاه نیز از دیگر دگرشکلیهای این عنصراند. حالت گازی این ماده نیز به صورت P۲ و اتمی یافت میشود.

فسفر سفید

فسفر سفید یا فسفر زرد یا به بیان سادهتر تترافسفر (P۴) به صورت مولکولی یافت میشوند. این مولکولها از چهار اتم ساخته شدهاند. آرایش چهاروجهی دچار کشش حلقه و در نتیجه ناپایداری میشود.
فسفر سفید جامد شفاف و مومی شکل است و اگر در برابر نور قرار گیرد خیلی زود زرد میشود به همین دلیل است که به آن فسفر زرد نیز میگویند. در تاریکی درخشش سبز دارد (اگر در برابر اکسیژن قرار گیرد). به شدت آتش زا است و ممکن است خود به خود در تماس با هوا آتش بگیرد. بویی که از سوختن آن تولید میشود شبیه بوی سیر است. فسفر سفید خیلی کم در آب حل میشود برای همین میتوان آن در زیر آب به صورت جامد نگهداری کرد. البته فسفر سفید در بنزن، روغن، کربن دیسولفید و دیسولفور دیکلرید نیز حل میشود.
فرآوری و کاربرد
راههای گوناگونی برای تولید فسفر سفید وجود دارد. یک فرایند آن است که فسفات کلسیم که از سنگهای فسفاتی بدست میآید را در حضور کربن و سیلیس[1] در کورههای برقی یا فسیلی حرارت دهیم با این کار عنصر فسفر به صورت بخار آزاد میگردد و میتوان آن را به صورت فسفریک اسید جمعآوری کرد.

چگالی فسفر در حالت گازی نشان دادهاست که این ماده در دمای کمتر از ۸۰۰ درجهٔ سانتی گراد به صورت چهار اتمی (P۴) است و در دماهای بالاتر به صورت دو اتمی (P۲) در میآید.
این ماده در دمای نزدیک به ۵۰ درجهٔ سانتی گراد اگر در هوای آزاد باشد، خود به خود آتش میگیرد البته برشهای نازک آن در دماهای پایینتر نیز میتوانند آتش بگیرند. این سوختگی به صورت زیر است:
- P
۴ + ۵ O
۲ → P
۴O
۱۰
به دلیل همین ویژگی فسفر سفید است که از آن در اسلحهسازی استفاده میشود.
مکعب ناموجود P۸
فسفر سفید میتواند به فسفر قرمز که از نظر ترمودینامیکی پایدارتر است تبدیل میشود. شکل مکعبی فسفر، P۸ در محیطهای فشرده دیده نشدهاست ولی مشتقاتی از این مولکول فرضی از فسفالکینها بدست آمدهاست.[2]
فسفر قرمز

فسفر قرمز از حرارت دادن فسفر سفید تا دمای ۲۵۰ °C یا ۴۸۲ °F یا با قرار دادن آن در برابر نور خورشید بدست میآید. این ماده به عنوان یک آمورف شبکهای در دسترس است. اگر فسفر قرمز آمورفی را بیشتر حرارت دهیم بلوری میشود. این دگرشکلی از فسفر در هوای آزاد و در دماهای پایینتر از ۲۴۰ °C آتش نمیگیرد در حالی که فسفر سفید در دمای ۳۰ درجه نیز میتواند شعله ور شود. اگر فسفر قرمز را تا دمای ۲۶۰ °C حرارت دهیم میتواند به فسفر سفید دگرگون شود. هنگامی که کبریت کشیده میشود نیز پدیدهای شبیه این رخ میدهد.
دسترسی به این ماده در روسیه و باقیماندهٔ کشورهای اتحاد جماهیر شوروی به دلیل کاربرد آن در تولید غیرقانونی آمفتامین، کنترل شده و محدود است.
فسفر بنفش هیتورف

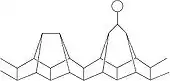
فسفر تکشیب (فسفر مونوکلینیک) یا فسفر بنفش همچنین با نام دیگر فسفر فلزی هیتورف.[3][4] هیتورف در سال ۱۸۶۵ فسفر قرمز را در یک ظرف دو سر بسته تا دمای ۵۳۰ °C حرارت داد. قسمت بالایی آن در دمای ۴۴۴ °C نگه داشته شد
فسفر سیاه
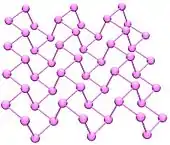
از نگاه ترمودینامیکی، فسفر سیاه شکل پایدار فسفر در دما و فشار اتاق است. این دگرشکلی از حرارت دادن فسفر سفید در فشار بالا (۱۲٬۰۰۰ اتمسفر) بدست میآید. این ماده در ظاهر، ویژگیها و ساختار بسیار به گرافیت شبیهاست. رنگ سیاه، پوسته پوسته بودن، رسانایی الکتریکی و صفحههای اتمها که در هم تنیده شدهاند، همگی از این ویژگیهایند.
سامانهٔ بلوری فسفر سیاه، راستلوزی است. این ماده در میان دگرشکلیهای فسفر از کمترین واکنشپذیری برخوردار است و این به دلیل پیوندهای داخلی شش تایی میان اتمهای آن است. هر اتم با سه اتم دیگر در همسایگی اش پیوند خوردهاست.[5][6] آخرین گزارشها نشان دادهاست که شیمیدانان توانستهاند ترکیبهای مصنوعی از فسفر سیاه با کمک نمک فلزات به عنوان کاتالیزور تولید کنند.[7]
یکی دیگر از ساختارهای بلوری فسفر سیاه/قرمز جامد بلوری مکعبی است.[8]
منابع
- Threlfall, R.E. , (1951). 100 years of Phosphorus Making: 1851–1951. Oldbury: Albright and Wilson Ltd
- Streubel, Rainer (1995). "Phosphaalkyne Cyclooligomers: From Dimers to Hexamers—First Steps on the Way to Phosphorus–Carbon Cage Compounds". Angewandte Chemie International Edition in English. ۳۴ (۴): ۴۳۶. doi:10.1002/anie.199504361.
- «Lateral Science – Phosphorus Topics». بایگانیشده از اصلی در ۲۱ فوریه ۲۰۰۹. دریافتشده در ۱۲ دسامبر ۲۰۱۱.
- Monoclinic phosphorus formed from vapor in the presence of an alkali metal U.S. Patent ۴۶۲۰۹۶۸
- Brown, A.; Rundqvist, S. (1965). "Refinement of the crystal structure of black phosphorus". Acta Crystallographica. ۱۹ (۴): ۶۸۴. doi:10.1107/S0365110X65004140.
- Cartz, L.; Srinivasa, S. R.; Riedner, R. J.; Jorgensen, J. D.; Worlton, T. G. (1979). "Effect of pressure on bonding in black phosphorus". The Journal of Chemical Physics. ۷۱ (۴): ۱۷۱۸. Bibcode:1979JChPh..71.1718C. doi:10.1063/1.438523.
- Lange, Stefan; Schmidt, Peer; Nilges, Tom (2007). "Au3SnP7@Black Phosphorus: An Easy Access to Black Phosphorus". Inorganic Chemistry. ۴۶ (۱۰): ۴۰۲۸–۳۵. doi:10.1021/ic062192q. PMID 17439206.
- Ahuja, Rajeev (2003). "Calculated high pressure crystal structure transformations for phosphorus". Physica status solidi (b). ۲۳۵ (۲): ۲۸۲. Bibcode:2003PSSBR.235..282A. doi:10.1002/pssb.200301569.