طلای کلوئیدی
طلای کلوئیدی یک سول (کلوئید) یا کلوئید از نانوذرات طلا در یک مایع، معمولاً آب است. کلوئید معمولاً به رنگ قرمز شدید (برای ذرات کروی کمتر از ۱۰۰ نانومتر) یا آبی / بنفش (برای ذرات کروی بزرگتر یا نانومیله) است.[1] با توجه به خصوصیات نوری، الکترونیک و خواص شناختی مولکولی، نانوذرات طلا موضوع تحقیق قابل توجهی هستند که بسیاری از آنها در زمینههای متنوعی از جمله میکروسکوپ الکترونی، الکترونیک، فناوری نانو، علم مواد و زیست پزشکی کاربرد دارند.[2][3][4][5]

| در ویکیانبار پروندههایی دربارهٔ طلای کلوئیدی موجود است. |
خواص نانوذرات طلا کلوئیدی و به همین ترتیب کاربردهای بالقوه آنها به شدت به اندازه و شکل آنها بستگی دارد. [۶] به عنوان مثال، ذرات میله مانند هر دو جذب (الکترومغناطیس) عرضی و طولی را دارند و ناهمسانگردی شکل بر خودمختاری آنها تأثیر میگذارد.[6]
تاریخچه

از دوران باستان به عنوان یک روش رنگ آمیزی شیشه ای(ویترای)، طلای کلوئیدی در جام Lycurgus در قرن چهارم مورد استفاده قرار گرفت که رنگ آن بسته به محل منبع نور تغییر میکند.[7][8] در طول قرون وسطی، طلای محلول، محلولی حاوی نمک طلا، برای خواص درمانی خود برای بیماریهای مختلف شهرت داشت. ارزیابی علمی مدرن از طلا کلوئیدی از زمان کارهای مایکل فارادی در سالهای ۱۸۵۰ آغاز شد.[9][10] در سال ۱۸۵۶، در یک آزمایشگاه زیرزمینی مؤسسه سلطنتی، فارادی تصادفی یک محلول قرمز یاقوتی ایجاد کرد در حالی که قطعاتی از برگ طلا بر روی اسلایدهای میکروسکوپ نصب شده بود.[11] از آنجا که او در حال حاضر علاقهمند به خواص نور و ماده بود، فارادی بیشتر خواص نوری طلای کلوئیدی را بررسی کرد. او اولین نمونه خالص طلای کلوئیدی را در سال ۱۸۵۷ به عنوان «طلای فعال» آماده کرد. او از فسفر برای کاهش یک محلول کلرید طلا استفاده کرد. طلای کلوئیدی که فارادی ۱۵۰ سال پیش تولید کرد، هنوز فعال است. برای مدت زمان طولانی، ترکیب طلای یاقوتی نامشخص بود. تعدادی از شیمیدانان با توجه به آمادهسازی آن، آن را ترکیب قلع طلا شناختهاند.[12][13] فارادی متوجه شد که رنگ در واقع به دلیل اندازه کوچک ذرات طلا است. او به ویژگیهای پراکندگی نور میکرو ذرات طلای معلق اشاره کرد که در حال حاضر به نام اثر فارادی تیندال (اثر تیندال)شناخته میشود.[10] در سال ۱۸۹۸، ریچارد آدولف زیگموندی (ریچارد ژیگموندی) اولین طلای کلوئیدی را در محلول رقیق ساخت.[14] به غیر از زیگموندی، تئودور سودبرگ که دستگاه فرامیانگریز و گوستاو مای از اختراعات اوست، تئوری ای را برای پراکندگی و جذب ذرات کروی ارائه داد، او همچنین علاقهمند به ترکیب و خواص طلا کلوئیدی بود.[6][15] با پیشرفت فناوریهای مختلف تحلیلی در قرن بیستم، مطالعات روی نانوذرات طلا سرعت گرفتهاست. روشهای میکروسکوپی پیشرفته، مانند میکروسکوپ نیروی اتمی و میکروسکوپ الکترونی، بیشترین تأثیر را در تحقیقات نانوذرات داشتهاند. با توجه به ترکیب نسبتاً آسان و پایداری بالا، ذرات طلای مختلف برای کاربرد عملی آنها مورد مطالعه قرار گرفتهاست. انواع مختلف نانوذرات طلا در بسیاری از صنایع مانند پزشکی و الکترونیک استفاده میشود. به عنوان مثال، چندینFDA سازمان غذا و دارو (آمریکا) نانوذرات مورد تأیید در حال حاضر در دارورسانی استفاده میشود.[16]
خواص فیزیکی
نوری
طلای کلوئیدی توسط هنرمندان برای قرنها به علت تعامل نانوذرات با نور مرئی مورد استفاده قرار گرفتهاست. نانوذرات طلا نور را و در نتیجه رنگ از قرمز به آبی، به سیاه و در نهایت روشن و بیرنگ، بسته به اندازه ذرات، شکل، شاخص انکسار محلی، و وضعیت تجمع جذب و پراکنده میکنند.[17] این رنگها به دلیل یک پدیده به نام تشدید پلاسمون سطحی(LSPR) ایجاد میشوند که در آن الکترونهای هدایت شده روی سطح نانوذرات در رزونانس با نور اولیه نوسان دارند.
تأثیر اندازه
به عنوان یک قاعده کلی، طول موج نور جذب شده با افزایش اندازه ذرات نانو افزایش مییابد.[18] به عنوان مثال، نانوذرات شبه کروی با قطرهای حدوداً ۳۰ نانومتر حداکثر جذب LSPR در حدود ۵۳۰ نانومتر دارند.[18]
تأثیر شاخص انکسار محلی
تغییرات در رنگ ظاهری یک محلول نانوذره طلا همچنین میتواند ناشی از محیط زیستی باشد که طلای کلوئیدی در آن به حالت تعلیق درآمده است.[19][20] خواص نوری نانوذرات طلا به شاخص شکست در نزدیکی سطح نانوذرات وابسته است، بنابراین هر دو مولکول مستقیماً بر روی سطح نانوذره چسبیدهاند. (یعنی لیگاندهای نانوذرات) و/یا حلال (شیمی) نانوذرات هردو ممکن است روی ویژگیهای نوری مشاهده شده تأثیر گذارند.[19] همانطور که شاخص شکست در نزدیکی سطح طلا افزایش مییابد، LSPR به طول موجهای طولانی تغییر مییابد.[20] علاوه بر محیط حلال، ضریب شکست را میتوان با پوشش نانوذرات با پوستههای نارسانا مانند سیلیکا، مولکولهای زیستی یا اکسید آلومینیوم وفق داد.[21]
تأثیر تراکم
وقتی ذرات نانو ذرات طلا جمع میشوند، خواص نوری ذرات تغییر میکنند، زیرا اندازه مؤثر ذرات، شکل و محیط دی الکتریک همه تغییر میکند.[22]
ترکیب
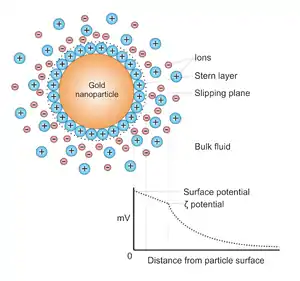
بهطور کلی، نانوذرات طلا در یک مایع ("روشهای شیمیایی مایع") با کاهش (اکسایش-کاهش) کلروآریک اسید تولید میشود. برای جلوگیری از جمع شدن ذرات، عوامل ثبات دهنده اضافه میشوند. سیترات هر دو به عنوان عامل کاهش دهنده و تثبیت کننده کلوئیدی عمل میکند. آنها میتوانند با لیگاندهای آلی مختلف برای ایجاد هیبریدهای آلی-معدنی با قابلیتهای پیشرفته مورد استفاده قرار گیرند.[9]
روش ترکویچ
این روش ساده توسط J. Turkevich و همکاران در سال 1951[23][24] ابداع و توسط G. Frens در ۱۹۷۰ اصلاح شدهاست.[25][26] این روش نانوذرات طلای کروی نیمه نازک تقریباً یکنواخت ۱۰–۲۰ نانومتر را تولید میکند. در این روش، کلروآریک اسید گرم در واکنش با محلول سدیم سیترات (نمک میوه) طلای کلوئیدی را تولید میکند. واکنش Turkevich از طریق تشکیل نانوسیمهای گذرا حاصل میشود. این نانوسیمهای طلا دلیل تیرگی ظاهر محلول واکنش قبل از تبدیل به قرمز یاقوتی است.[27]
روش پرالت
این رویکرد، که توسط Perrault و Chan در سال ۲۰۰۹ کشف شد،[28] از هیدروکینون برای کاهش در یک محلول آبی که حاوی ۱۵ نانومتر دانههای نانو ذرات طلا است استفاده میکند. این روش ترکیب مبتنی بر بذر شبیه آنچه که در گسترش فیلمهای عکاسی استفاده شدهاست میباشد، که در آن دانههای نقره درون فیلم از طریق افزودن نقره بر روی سطح آنها رشد میکنند. به همین ترتیب، نانوذرات طلا میتوانند در ارتباط با هیدروکینون عمل کنند تا کاهش یون طلا بر روی سطح آنها را کاتالیز کنند. وجود یک تثبیت کننده مانند سیترات، باعث رسوب اتمهای طلا به ذرات و رشد میشود. بهطور معمول دانههای نانو ذرات با استفاده از روش سیترات تولید میشوند. این روش هیدروکینون روش Frens را تکمیل میکند،[25][26] زیرا گستره ای از اندازه ذرات کروی مونو دی اسپرزی را که میتوان تولید کرد، گسترش میدهد. در حالی که روش Frens ایدهآل برای ذرات ۱۲–۲۰ نانومتر است، روش هیدروکینون میتواند ذرات حداقل ۳۰ تا ۳۰۰ نانومتر تولید کند.
روش مارتین
این روش ساده، که توسط مارتین و ائه در سال 2010 کشف شده است، [29] نانوذرات طلای "برهنه" تقریباً یکنواخت را در آب تولید می کند. دقیقاً کنترل استوکیومتری کاهش را با تنظیم نسبت یون NaBH4-NaOH به یون HAuCl4-HCl در منطقه شیرین همراه با حرارت، امکان تنظیم قطر مجاز بین 3-6 نانومتر را فراهم می کند. ذرات آبی به دلیل غلظت بالا از یون های اضافی در محلول، به شکل کلوئیدی پایدار هستند. این ذرات می توانند با ویژگی های مختلف هیدروفیلی پوشش داده شوند یا با لیگاند های آبگریز برای کاربرد در حلال های غیر قطبی مخلوط شوند. در حلالهای غیر قطبی، نانوذرات به شدت شارژ باقی می مانند و خود را در قطرات مایع قرار می دهند تا از دوزهای نانو ذرات نانو تشکیل شوند.
مطالعات نانوتکنولوژی
Bacillus licheniformis (نوعی باکتری) را می توان در سنتز نانوکابل های طلای با اندازه های بین 10 تا 100 نانومتر مورد استفاده قرار داد. [30] نانوذرات طلا معمولاً در دمای بالا در حلال های آلی یا با استفاده از واکنش های سمی تولید می شوند. باکتری ها آنها را در شرایط بسیار ملایم تولید می کند.
روش ناوارو و همکاران
برای ذرات بزرگتر از 30 نانومتر، کنترل اندازه ذرات با پلییدیزاسیون کم از نانوذرات کروی طلایی چالش برانگیز است. به منظور ارائه حداکثر کنترل بر ساختار NP، ناوارو و همکاران از یک روش Turkevitch-Frens اصلاح شده با استفاده از استیل ساتون سدیم سدیم (acac) به عنوان عامل کاهش دهنده و سدیم سیترات به عنوان تثبیت کننده استفاده کردند.[31]
پیوند به بیرون
- Moriarty, Philip. "Au – Gold Nanoparticle". Sixty ( دانشگاه ناتینگهام )Symbols. Brady Haran for the University of Nottingham.
- روشهای نقطه به نقطه برای سنتز سیترات و سنتز هیدروکینون نانوذرات طلا در اینجا موجود است .
منابع
- Sapsford KE, Algar WR, Berti L, Gemmill KB, Casey BJ, Oh E, Stewart MH, Medintz IL (March 2013). "Functionalizing nanoparticles with biological molecules: developing chemistries that facilitate nanotechnology". Chemical Reviews. 113 (3): 1904–2074. doi:10.1021/cr300143v. PMID 23432378.
- Yang X, Yang M, Pang B, Vara M, Xia Y (October 2015). "Gold Nanomaterials at Work in Biomedicine". Chemical Reviews. 115 (19): 10410–88. doi:10.1021/acs.chemrev.5b00193. PMID 26293344.
- The beauty and elegance of Nanocrystals: How invisibly small particles will colour and shape our future. (Report). University of Melbourne. 2003. Archived from the original on 28 اكتبر 2004. https://web.archive.org/web/20041028230241/http://uninews.unimelb.edu.au/articleid_791.html. Retrieved 11 ژوئن 2019.
- Rao CN, Kulkarni GU, Thomas PJ, Edwards PP (2000). "Metal nanoparticles and their assemblies". Chemical Society Reviews. 29 (1): 27–35. doi:10.1039/A904518J.
- Dreaden EC, Alkilany AM, Huang X, Murphy CJ, El-Sayed MA (April 2012). "The golden age: gold nanoparticles for biomedicine". Chemical Society Reviews. 41 (7): 2740–79. doi:10.1039/c1cs15237h. PMC 5876014. PMID 22109657.
- Sharma V, Park K, Srinivasarao M (2009). "[[پرونده:Vintage cranberry glass.jpg|بندانگشتی|چپ|This cranberry glass". Material Science and Engineering Reports. 65 (1–3): 1–38. doi:10.1016/j.mser.2009.02.002.
- "The Lycurgus Cup". British Museum. Retrieved 2015-12-04.
- Freestone I, Meeks N, Sax M, Higgitt C (2007). "The Lycurgus Cup — A Roman nanotechnology". Gold Bulletin. 40 (4): 270–277. doi:10.1007/BF03215599.
- Reddy VR (July 2006). "Gold nanoparticles: synthesis and applications". Synlett. 11: 1791–2.
- Faraday M (January 1857). "The Bakerian Lecture: Experimental Relations of Gold (and Other Metals) to Light". Philosophical Transactions of the Royal Society of London. 147: 145–181. doi:10.1098/rstl.1857.0011.
- "Michael Faraday's gold colloids | The Royal Institution: Science Lives Here". www.rigb.org. Retrieved 2015-12-04.
- Gay-Lussac (1832). "Ueber den Cassius'schen Goldpurpur". Annalen der Physik. 101 (8): 629–630. Bibcode:1832AnP...101..629G. doi:10.1002/andp.18321010809.
- Berzelius JJ (1831). "Ueber den Cassius' schen Goldpurpur". Annalen der Physik. 98 (6): 306–308. Bibcode:1831AnP....98..306B. doi:10.1002/andp.18310980613.
- Zsigmondy R (December 11, 1926). "Properties of colloids" (PDF). Nobel Foundation. Retrieved 2009-01-23.
- Zeng S, Yu X, Law W, Zhang Y, Hu R, Dinh X, H o H, Yong K (2013). "Size dependence of Au NP-enhanced surface plasmon resonance based on differential phase measurement". Sensors and Actuators B: Chemical. 176: 1128–1133. doi:10.1016/j.snb.2012.09.073.
- Eifler AC, Thaxton CS (2011-01-01). "Nanoparticle Therapeutics: FDA Approval, Clinical Trials, Regulatory Pathways, and Case Study". In Hurst SJ. Biomedical Nanotechnology. Methods in Molecular Biology. 726. Humana Press. pp. 325–338. doi:10.1007/978-1-61779-052-2_21. ISBN 978-1-61779-051-5. PMID 21424459.
- Anderson ML, Morris CA, Stroud RM, Merzbacher CI, Rolison DR (1999-02-01). "Colloidal Gold Aerogels: Preparation, Properties, and Characterization". Langmuir. 15 (3): 674–681. doi:10.1021/la980784i.
- Link S, El-Sayed MA (1999-05-01). "Size and Temperature Dependence of the Plasmon Absorption of Colloidal Gold Nanoparticles". The Journal of Physical Chemistry B. 103 (21): 4212–4217. CiteSeerX 10.1.1.596.6328. doi:10.1021/jp984796o.
- Ghosh SK, Nath S, Kundu S, Esumi K, Pal T (2004-09-01). "Solvent and Ligand Effects on the Localized Surface Plasmon Resonance (LSPR) of Gold Colloids". The Journal of Physical Chemistry B. 108 (37): 13963–13971. doi:10.1021/jp047021q.
- Underwood S, Mulvaney P (1994-10-01). "Effect of the Solution Refractive Index on the Color of Gold Colloids". Langmuir. 10 (10): 3427–3430. doi:10.1021/la00022a011.
- Xing S, Tan LH, Yang M, Pan M, Lv Y, Tang Q, Yang Y, Chen H (2009-05-12). "Highly controlled core/shell structures: tunable conductive polymer shells on gold nanoparticles and nanochains". Journal of Materials Chemistry. 19 (20): 3286. doi:10.1039/b900993k.
- Ghosh SK, Pal T (November 2007). "Interparticle coupling effect on the surface plasmon resonance of gold nanoparticles: from theory to applications". Chemical Reviews. 107 (11): 4797–862. doi:10.1021/cr0680282. PMID 17999554.
- Turkevich J, Stevenson PC, Hillier J (1951). "A study of the nucleation and growth processes in the synthesis of colloidal gold". Discuss. Faraday. Soc. 11: 55–75. doi:10.1039/df9511100055.
- Kimling J, Maier M, Okenve B, Kotaidis V, Ballot H, Plech A (August 2006). "Turkevich method for gold nanoparticle synthesis revisited". The Journal of Physical Chemistry B. 110 (32): 15700–7. doi:10.1021/jp061667w. PMID 16898714.
- Frens, G. (1972). "Particle size and sol stability in metal colloids". Colloid & Polymer Science. 250 (7): 736–741. doi:10.1007/bf01498565.
- Frens, G. (1973). "Controlled nucleation for the regulation of the particle size in monodisperse gold suspensions". Nature. 241 (105): 20–22. Bibcode:1973NPhS..241...20F. doi:10.1038/physci241020a0.
- Pong BK, Elim HI, Chong JX, Trout BL, Lee JY (2007). "New Insights on the Nanoparticle Growth Mechanism in the Citrate Reduction of Gold(III) Salt: Formation of the Au Nanowire Intermediate and Its Nonlinear Optical Properties". J. Phys. Chem. C. 111 (17): 6281–6287. doi:10.1021/jp068666o.
- Perrault SD, Chan WC (December 2009). "Synthesis and surface modification of highly monodispersed, spherical gold nanoparticles of 50-200 nm". Journal of the American Chemical Society. 131 (47): 17042–3. doi:10.1021/ja907069u. PMID 19891442.
- Martin MN, Basham JI, Chando P, Eah SK (May 2010). "Charged gold nanoparticles in non-polar solvents: 10-min synthesis and 2D self-assembly". Langmuir. 26 (10): 7410–7. doi:10.1021/la100591h. PMID 20392108. A 3-min demonstration video for the Martin synthesis method is available at YouTube
- Kalishwaralal K, Deepak V, Ram Kumar Pandian S, Gurunathan S (November 2009). "Biological synthesis of gold nanocubes from Bacillus licheniformis". Bioresource Technology. 100 (21): 5356–8. doi:10.1016/j.biortech.2009.05.051. PMID 19574037.
- Navarro JR, Lerouge F, Cepraga C, Micouin G, Favier A, Chateau D, Charreyre MT, Lanoë PH, Monnereau C, Chaput F, Marotte S, Leverrier Y, Marvel J, Kamada K, Andraud C, Baldeck PL, Parola S (November 2013). "Nanocarriers with ultrahigh chromophore loading for fluorescence bio-imaging and photodynamic therapy". Biomaterials. 34 (33): 8344–51. doi:10.1016/j.biomaterials.2013.07.032. PMID 23915950.