نظریه اوربیتال مولکولی مرزی
در شیمی، نظریه اوربیتال مولکولی مرزی (به انگلیسی: Frontier molecular orbital theory) در واقع استفاده از نظریه اوربیتال مولکولی (به انگلیسی: Molecular orbital theory) برای بررسی و پیشبینی نوع محصولات واکنشهای آلی از طریق توصیف بالاترین اوربیتالهای مولکولی پرشده و پایینترین اوربیتالهای مولکولی پرنشده (بهترتیب، موسوم به HOMO و LUMO) است

تاریخچه
در سال ۱۹۵۲، کنیچی فوکویی شیمیدان ژاپنی، مقالهای با عنوان « تئوری مولکولیِ واکنش پذیری در هیدروکربن های آروماتیک» را در مجله فیزیک شیمیایی (به انگلیسی: Journal of Chemical Physics) منتشر کرد.[1] اگرچه مقاله او در آن زمان بسیار مورد انتقاد قرار گرفت، اما بعداً او جایزه نوبل شیمی را با روالد هافمن به خاطر کار خود در زمینه سازوکار واکنشها به اشتراک گذاشت. هافمن برروی ایجاد مجموعهای از چهار دسته واکنش پریسیکلی در شیمی آلی بر اساس تقارن اوربیتالی تمرکز کرد. او در این مسیر با رابرت برنز وودوارد همکاری کرد که این همکاری در نهایت منجر به ارائه مجموعهای تحت عنوان «بقای تقارن اوربیتالی (به انگلیسی: The Conservation of Orbital Symmetry)» شد.
تحقیقات فوکویی بهصورت متمرکز برروی نوع اثر بالاترین اوربیتال مولکولی پرشده (به انگلیسی: Highest occupied molecular orbital) و پایینترین اوربیتال مولکولی پرنشده (به انگلیسی: Lowest unoccupied molecular orbital) بر سازوکار واکنشها بود که در نهایت منجر به نظریهای شد که امروز با نام نظریه اوربیتال مولکولی مرزی شناخته میشود. او با کمک بررسی این تعاملات، درک بهتر قوانین وودوارد–هافمن را ممکن ساخت.
نظریه
فوکویی دریافت که با بررسی اوربیتالهای مرزی (بالاترین اوربیتال مولکولی پرشده و پایین ترین اوربیتال مولکولی پرنشده)، میتوان تقریب خوبی برای واکنش پذیری پیدا کرد. در زمان برهمکنش دو مولکول، با کمک نظریه اوربیتال مولکولی مرزی، سه مشاهده اصلی زیر بهدست میآید که اساس یافتههای فوکویی را تشکیل دادند:
- اوربیتالهای پرشده از مولکولهای متفاوت، یکدیگر را دفع میکنند.
- بارهای مثبت یک مولکول بارهای منفی موجود بر روی مولکول دیگر را جذب میکنند.
- اوربیتالهای پرشده از یک مولکول و اوربیتالهای خالی مولکول دیگر (خصوصاً دو مورد بالاترین اوربیتال مولکولی پرشده و پایین ترین اوربیتال مولکولی پرنشده) با یکدیگر برهمکنش میکنند و موجب جذب یکدیگر میشوند.
کاربردها
حلقهزایی
یک واکنش حلقهزایی، واکنشی است که طی آن همزمان حداقل دو پیوند جدید تشکیل میشود و با این کار، دو یا چند مولکول زنجیره باز به حلقه تبدیل میشود.[2] نوع محصولات و مجاز بودن/نبودن این واکنشها در شرایط انجام واکنش را میتوان با کمک قوانین وودوارد-هافمن پیشبینی کرد و با نظریه اوربیتال مولکولی مرزی نه تنها میتوان به تقریب خوب مشابهی رسید بلکه میتوان شیمی فضایی محصول را نیز تعیین کرد.
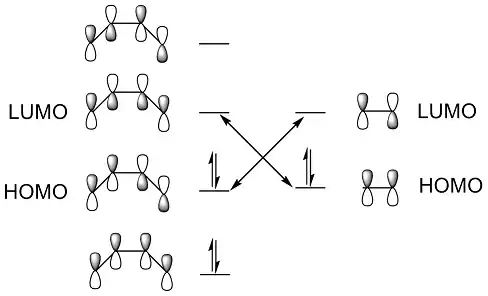
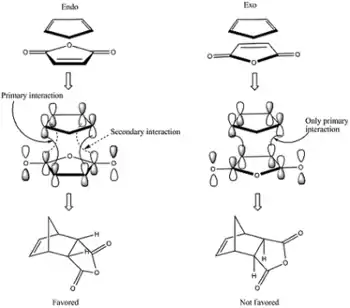
یک مثال مناسب از واکنشهای حلقهزایی واکنش دیلز-آلدر است. واکنش میان یک مالئیک انیدرید و یک سیکلوپنتادیان الگوی خوبی برای یک واکنش دیلز-آلدر است. واکنش میان این دو مولکول براساس قوانین وودوارد-هافمن مجاز است (مطابق این قانون: اگر تعداد کل الکترونهای پای درگیر در فرایند واکنش زوج باشد اکنش در شرایط گرمایی مجاز است). نظریه اوربیتال مولکولی نیز مجاز بودن این واکنش را بهمانند قوانین وودوارد-هافمن تایید میکند و حتی شیمی فضایی محصولات را هم پیشبینی میکند، موضوعی قوانین وودوارد-هافمن از انجام آن ناتوان هستند.
در مسیر انجام یک واکنش دیلز-آلدر مواد اولیه میتوانند به دو صورت اِندو یا اِگزو به یکدیگر نزدیک شده و موجب ایجاد پیوند و تشکیل محصول شوند. مسیر اِگزو دارای پوشیدگی فضایی و همپوشانی اوربیتالی بیشتر و مسیر اضافه شدن اِندو، پوشیدگی فضایی و همپوشانی اوربیتالی کمتری است. محصول اِگزو به لحاظ گرمایی پایدارتر و محصول اِندو به لحاظ تشکیل سریعتر است. در نتیجه، محصول اِگزو یک محصول ترمودینامیکی و محصول اِندو یک محصول سینتیکی است. با کمک نظریه اوربیتال مولکولی مرزی میتوان به بررسی اوربیتالهای درگیر در این دو نوع روش نزدیک شدن مواد اولیه به یکدیگر پرداخت و نوع محصول نهایی و مجاز بودن/نبودن آن از لحاظ همپوشانی اوربیتالی را پیشبینی کرد.
واکنشهای سیگماتروپی
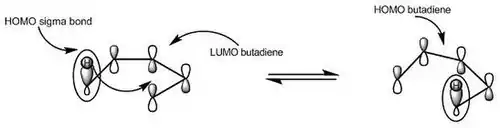
یک واکنش سیگماتروپی، واکنشی است که طی آن یک پیوند سیگما در طول یک سیستم مزدوج پیوسته حرکت میکند و به این صورت، بهطور همزمان تغییر موقعیت میدهد. تغییر موقعیت پیوند سیگما و افزوده شدن آن به سمت دیگر مولکول، نسبت به صفحه تقارن مولکول، میتواند از دو سمت انجام شود: از سطح موافق که اصطلاحا به افزایش تکرخی (Suprafacial) گفته میشود یا از سطح مخالف که افزایش دورخی (Antarafacial) نامیده میشود. بسته نوع مولکول، آرایش اوربیتال مولکولی و شرایط واکنش (حرارتی یا نوری) هرکدام از این دو مسیر که منجر به آرایش فضایی متفاوتی میشود میتواند مجاز یا غیرمجاز باشد که با کمک نظریه اوربیتال مولکولی مرزی قابل پیشبینی است.
واکنشهای الکتروسیکلی
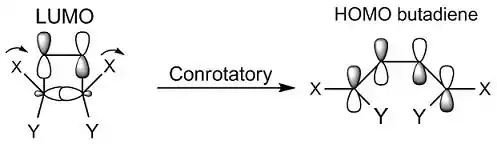
یک واکنش الکتروسیلی، واکنشی است که طی آن شامل بهطور خالص یک پیوند پای از بین میرود و در ادامه یک پیوند سیگما به همراه تشکیل یک حلقه رخ میدهد. این واکنشها بر اساس چرخش اوربیتالی بهپیش میروند که به دو صورت هستند: چرخش همسو/همجهت (Conrotatory) و چرخش غیرهمسو/غیرهمجهت (Disrotatory). با کمک نظریه اوربیتال مولکولی میتوان پیشبینی نمود که بر اساس آرایش اوربیتال مولکولی در مولکول مورد نظر، کدام یک از این روشهای چرخش در شرایط انجام واکنش (حرارتی/نوری) مجاز است.
منابع
- Fukui, Kenichi; Yonezawa, Teijiro; Shingu, Haruo (1952). "A Molecular Orbital Theory of Reactivity in Aromatic Hydrocarbons". The Journal of Chemical Physics. 20 (4): 722. Bibcode:1952JChPh..20..722F. doi:10.1063/1.1700523.
- Miller, Bernard (2004). Advanced Organic Chemistry: Reactions and Mechanisms. Upper Saddle River, NJ: Pearsons. pp. 53–54. ISBN 0-13-065588-0.