هندسه مولکولی دو هرمی مثلثی
در دانش شیمی، مطابق نظریه دافعه زوج الکترون لایه ظرفیتی هندسه مولکولی دوهرمی مثلثی شامل یک اتم مرکزی و پنج گروه (شامل اتمها یا الکترونهای ناپیوندی) است. در شکل دوهرمی مثلثی دو نوع زاویه پیوندی متفاوت (۱۲۰ درجه و ۹۰ درجه) وجود دارد. زیرا هیچ آرایش هندسی با پنج گروه کاملاً هم ارز در حوالی آن وجود ندارد. از شاخصترین نمونههای واجد این ساختار میتوان به پنتاکلرید فسفر و پنتافلوئورید فسفر اشاره کرد. هیبریداسیون این ترکیبات sp3d2 است.
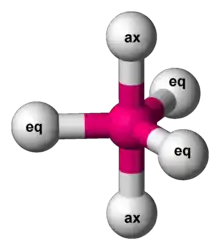
گروههای محوری و استوایی
از آن جایی که در این ساختار، امکان وجود یک زاویه پیوندی واحد وجود ندارد، پس دو نوع گروه در این ساختارها دیده میشود. ساختارهایی که بر روی مثلث میانی قرار میگیرند استوایی و ساختارهای روی رئوس دو هرم، محوری نامیده میشوند. گزینش پذیری و تمایل گروههای گوناگون برای انتخاب یکی از این حالتهای فضایی به اثرات فضاالکترونی بستگی دارد.
شبه چرخش بری
گاهی اوقات در صورت مساعد بودن شرایط فضایی و الکترونی، اتمها میتوانند به سرعت موقعیت محوری و استوایی خود را با یکدیگر تعویض کنند که اصطلاحاً شبه چرخش بری نامیده میشود. علت وجود فقط یک پیک در طیف 19FNMR در ترکیب پنتافلوئورید فسفر همین شبه چرخش بری است.
مشتقات
در صورت وجود یک، دو یا سه الکترون در ساختار، شکل مولکول به ترتیب الاکلنگی، T شکل و خطی خواهد شد. واضح است که الکترونها به علت تمایلات فضایی و الکترونی به موقعیتهای استوایی تمایل دارند.
جستارهای وابسته
منابع
- General chemistry, Charls Mortimer, 1986
- inorganic chemistry, Catherine E. Housecroft, Alan G.Shape, 5ed, 2018
پیوند به بیرون
- Indiana University Molecular Structure Center
- Interactive molecular examples for point groups
- Molecular Modeling
- Animated Trigonal Planar Visual