گذار اپیتلیال-مزانشیمی
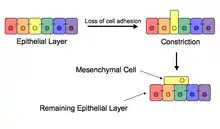
گذار اپیتلیال-مزانشیمی (به انگلیسی: (EMT) Epithelial–mesenchymal transition) فرایندی است که طی آن سلولهای اپیتلیال قطبیت سلولی و چسبندگی سلول به سلول خود را از دست میدهند و خواص مهاجرتی و تهاجمی به دست میآورند و تبدیل به سلولهای بنیادی مزانشیمی میشوند. سلولهای بنیادی مزانشیمی در واقع سلولهای استرومای چندتوان هستند که میتوانند به انواع مختلفی از سلولها تمایز پیدا کنند. EMT برای بسیاری از مراحل تکوینی از جمله تشکیل مزودرم و تشکیل لوله عصبی ضروری است. نشان داده شدهاست که EMT در ترمیم زخمها، در فیبروز اندام و شروع متاستاز در پیشرفت سرطان نیز رخ میدهد.
مقدمه
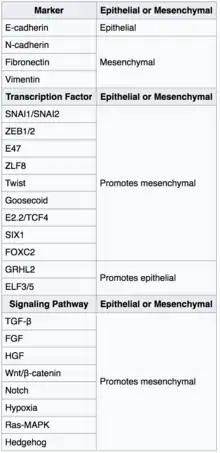
گذار اپیتلیال-مزانشیمی اولین بار به عنوان یکی از ویژگیهای جنینزایی توسط بتی هی در دهه ۱۹۸۰ شناسایی شد.[1][2] EMT و روند معکوس آن، MET (گذار مزانشیمی - اپیتلیال) برای تکوین بسیاری از بافتها و اندامها در جنین در حال تکوین بسیار مهم است، و وقایع جنینی متعددی مانند گاسترولاسیون، تشکیل ستیغ عصبی، تشکیل دریچه قلب، تکوین ثانویه کام و میوژنز دخیل میباشد.[3] سلولهای اپیتلیال و مزانشیمی در فنوتیپ و همچنین عملکرد متفاوت هستند، هر چند هر دو نوع این سلولها دارای ویژگی انعطافپذیری ذاتی هستند. سلولهای اپیتلیال از طریق اتصالات محکم، اتصالات شکافدار و اتصالات adherens از نزدیک به هم متصل میشوند و دارای قطبیت در apico-basal و اسکلت سلولی اکتین میباشند. از طرف دیگر سلولهای مزانشیمی فاقد این قطبش، دارای یک مورفولوژی دوکی شکل بوده و تنها از طریق نقاط کانونی با یکدیگر در تعامل هستند.[4] سلولهای اپیتلیال سطح بالایی از E-cadherin را بیان میکنند، در حالی که سلولهای مزانشیمی N-cadherin، فیبرونکتین و vimentin را بیان میکنند؛ بنابراین، EMT مستلزم تغییرات زیاد مورفولوژیکی و فنوتیپی در یک سلول است.
بر اساس فاکتورهای بیولوژیکی، EMT به ۳ نوع طبقهبندی میشود: تکوینی (نوع I)، فیبروز[5] و بهبود زخم (نوع II)، و سرطان (نوع III).[6][7][8]
القاکنندهها
منابع
- Kong D, Li Y, Wang Z, Sarkar FH (2011). "Cancer Stem Cells and Epithelial-to-Mesenchymal Transition (EMT)-Phenotypic Cells: Are They Cousins or Twins?". Cancers (Basel). 3 (1): 716–29. doi:10.3390/cancers30100716. PMC 3106306. PMID 21643534.
- Lamouille, Samy; Xu, Jian; Derynck, Rik (March 2014). "Molecular mechanisms of epithelial-mesenchymal transition". Nature Reviews Molecular Cell Biology. 15 (3): 178–196. doi:10.1038/nrm3758. PMC 4240281. PMID 24556840.
- Thiery JP, Acloque H, Huang YJ, Nieto MA (2009). "Epithelial-Mesenchymal Transitions in Development and Disease". Cell. 139 (5): 871–890. doi:10.1016/j.cell.2009.11.007. PMID 19945376.
- Thiery JP, Sleeman JP (2006). "Complex networks orchestrate epithelial-mesenchymal transitions". Nature Reviews Molecular Cell Biology. 7 (2): 131–142. doi:10.1038/nrm1835. PMID 16493418.
- Phua, YL; Martel, N; Pennisi, DJ; Little, MH; Wilkinson, L (April 2013). "Distinct sites of renal fibrosis in Crim1 mutant mice arise from multiple cellular origins". The Journal of Pathology. 229 (5): 685–96. doi:10.1002/path.4155. PMID 23224993.
- Kalluri R, Weinberg RA (2009). "The basics of epithelial-mesenchymal transition". Journal of Clinical Investigation. 119 (6): 1420–1428. doi:10.1172/JCI39104. PMC 2689101. PMID 19487818.
- Sciacovelli, Marco; Frezza, Christian (2017-04-26). "Metabolic reprogramming and epithelial-to-mesenchymal transition in cancer". The FEBS Journal. 284 (19): 3132–3144. doi:10.1111/febs.14090. PMC 6049610. PMID 28444969.
- Li, Linna; Li, Wenliang (June 2015). "Epithelial-mesenchymal transition in human cancer: comprehensive reprogramming of metabolism, epigenetics, and differentiation". Pharmacology & Therapeutics. 150: 33–46. doi:10.1016/j.pharmthera.2015.01.004. PMID 25595324.