تجمع ذرات
تجمع ذرات به تشکیل مجموعه در یک سوسپانسیون اشاره دارد و نشان دهنده مکانیسمی است که سبب بیثباتی سیستمهای کلوئیدی می شود. در طی این فرایند، ذرات در فاز مایع به یکدیگر میچسبند و به صورت خود به خودی خوشههای ذره ای نامنظم تشکیل میدهند. این پدیده همچنین به عنوان انعقاد یا انقباض شناخته میشود و چنین سوسپانسیونی نیز بیثبات است. تجمع ذرات میتواند با اضافه کردن نمکها یا یک ماده شیمیایی دیگر به نام کلاژن یا فلوکولانت ایجاد شود.[1] بعضی از افراد بهطور خاص به جوش خوردگی اشاره میکنند هنگامی که تجمع توسط پلیمرها یا پلی الکترولیتها بهوجود میآید، در حالی که انعقاد در معنای وسیع تر استفاده میشود.
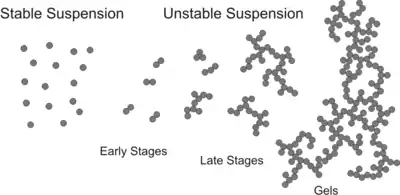
تجمع ذرات بهطور معمول یک روند غیرقابل برگشت است. هنگامی که ذرات دانه تشکیل شدهاند، آنها به آسانی نمیتوانند اختلال ایجاد کنند. در طول تجمع، دانهها در اندازه رشد میکنند و به همین علت ممکن است به پایین ظرف، که به عنوان رسوب شناخته میشود، حل و فصل شود. در عوض، یک ژل کلوئیدی ممکن است در سوسپانسیونهای متمرکز ایجاد شود که خواص رئولوژیکی آن را تغییر میدهد. فرایند معکوس که به موجب آن ذرات به صورت ذرات منفرد به نام پپتیسیون پراکنده میشوند، به سختی به صورت خود به خود اتفاق میافتند، اما ممکن است در اثر متلاشی شدن یا برش اتفاق بیفتد
ذرات کلوئیدی نیز ممکن است برای مدت زمان طولانی (روز به سال) در مایعات پراکنده شوند. این پدیده به عنوان ثبات کلوئیدی نامیده میشود و گفته میشود که سوسپانسیون ثابت است. سوسپانسیونهای پایدار اغلب در غلظتهای کم نمک یا با افزودن مواد شیمیایی به نام تثبیت کنندهها یا عوامل تثبیت کننده به دست میآیند. ثبات ذرات، کلوئیدی یا غیره، بیشتر از نظر پتانسیل زتا مورد ارزیابی قرار میگیرد. این پارامتر یک معیار سنجش قابل اندازهگیری از تجمع بین پارامتر را فراهم میکند که مهار کننده کلیدی تجمع ذرات است.
فرایندهای تجمعی مشابه نیز در سایر سیستمهای پراکنده وجود دارد. در امولسیونها، آنها همچنین میتوانند به همبستگی قطره ای متصل شوند و نه تنها منجر به رسوب و همچنین خیس شدن میشوند. در آئروسلها، ذرات هوایی، بهطور مساوی جمع میشوند و خوشههای بزرگتری (مانند دوده) را تشکیل میدهند.
مراحل اولیه
تعادل کلوئیدی به خوبی پراکنده شده از ذرات جدا شده فردی است و با نیروهای بین ذرات خللی تثبیت شدهاست. هنگامی که نیروهای رقیق کننده از طریق افزودن یک انعقاد ضعیف میشوند، ذرات شروع به جمع شدن میکنند. در ابتدا، تشکیل دوبل A 2 از انه A 1 با مطابق طرح تشکیل میشوند ذرات شروع به جمع شدن میکنند.
- A 1 + A 1 → A 2
در مرحله اولیه روند تجمع، تعلیق عمدتاً شامل مونومرهای ذرات و برخی از دیمرها است. میزان این واکنش با ضریب تجمع k مشخص میشود. از آنجا که تشکیل دوبل یک فرایند فرایند مرتبه دوم است، واحدهای این ضرایب m 3 s -1 هستند زیرا غلظت ذرات به صورت ذره در واحد حجم (m -3) بیان میشود. از آنجایی که میزان انباشتگی مطلوب برای اندازهگیری دشوار است، اغلب به صورت بدون بعد W = kfast / k بیان میشود. kfast ضریب تجمع در رژیم سریع است و k ضریب در شرایط مورد علاقه، اغلب به بعد نسبت ثبات W = K اشاره سریع / K که در آن k سریع ضریب نرخ تجمع در رژیم سریع است، و k ضریب در شرایط مورد نظر و مشخص است. نسبت ثبات نزدیک به وحدت در رژیم سریع است، افزایش در رژیم آهسته و زمانی که سوسپانسیون پایدار است بسیار بزرگ میشود.
هنگامی که پتانسیل تعامل بین ذرات کاملاً جذاب است، فرایند تجمع تنها توسط حرکت براونی ذرات محدود میشود،DLA اشاره به تجمع محدود سریع، سریع یا انتشار دارد. هنگامی که پتانسیل تعامل یک مانع متوسط را نشان میدهد، تجمع توسط این واقعیت آهسته میشود که تلاشهای متعدد برای غلبه بر این مانع ضروری است. RLA به تجمع محدود آهسته یا واکنش اشاره می کند. تجمع را میتوان با تغییر غلظت نمک، pH یا افزودنی دیگری تنظیم کرد. از آنجا که انتقال از تجمع سریع تا آهسته در یک محدوده غلظت محدود اتفاق میافتد،CCC به غلظت به عنوان غلظت انعقاد حیاتی اشاره دارد.
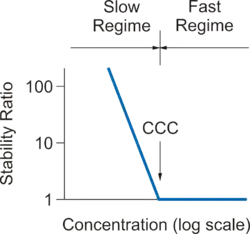
ذرات کلوئیدی اغلب در آب غوطه ور میشوند. در این حالت، یک بار سطحی به وجود میآیند و یک لایه الکتریکی دو لایه در اطراف هر ذره تشکیل میشود.[2] همپوشانی بین لایههای پخش شده از دو ذره نزدیک، باعث ایجاد پتانسیل متقابل دو لایه میشود که منجر به تثبیت ذرات میشود. هنگامی که نمک به سوسپانسیون اضافه میشود، انفجار دو لایه الکتریکی نمایش داده میشود و جاذبه واندر دروالس غالب میشود و باعث تجمع سریع میشود. شکل سمت راست نشانگر وابستگی معمول نسبت ضریب پایداری W نسبت به غلظت الکترولیت است، بدین ترتیب رژیمهای تجمع آهسته و سریع نشان داده میشوند.
جدول زیر خلاصه ای از محدوده CCC برای خالص یونی ضد آن است. شارژ در واحدهای شارژ ابتدایی بیان میشود. این وابستگی، قاعده شولتز-هاردی را نشان میدهد، CCC به عنوان قدرت ششم قدرت شارژ با یون متفاوت است. CCC تا حدودی بستگی به نوع یون دارد، حتی اگر شارژ همان هزینه را داشته باشد. این وابستگی ممکن است منعکس کننده خواص ذرات مختلف یا وابستگیهای مختلف یون به سطح ذرات باشد. از آنجا که اغلب ذرات بهطور غیر منفی شارژ میشوند، کاتیونهای چند فلزی نشان دهنده کلاژنها بسیار مؤثر هستند.
| ردیف | CCC (× -3 -3 مول / لیتر) |
|---|---|
| ۱ | ۵۰–۳۰۰ |
| ۲ | ۲–۳۰ |
| ۳ | ۰٫۰۳–۰٫۵ |
جذب گونههای مخالف شارژ (به عنوان مثال، پروتونها، بهطور خاص جاذب یونها، سورفکتانتها یا پلی الکترولیتها) ممکن است تعلیق ذرات را از طریق خنثی سازی شارژ بیثبات کنند یا آن را با افزایش هزینه شارژ کنند، که منجر به تجمع سریع در نزدیکی نقطه خنثی شدن شارژ میشود از آن.
تفسیر کمی از ثبات کلوئیدی در ابتدا در قالب تئوری DLVO صورت پذیرفت. این نظریه تأیید رژیمهای تجمع آهسته و سریع را میدهد، گرچه در رژیم آهسته وابستگی به غلظت نمک اغلب پیشبینی میشود که بسیار قوی تر از تجربیات مشاهده شدهاست. نظریه Schulze-Hardy نیز میتواند از نظریه DLVO حاصل شود.
مکانیسمهای دیگر تثبیت کلوئید بهطور مساوی امکانپذیر است، به خصوص، شامل پلیمرها. پلیمرهای جذب شده یا پیوندی ممکن است یک لایه محافظ در اطراف ذرات تشکیل دهند، باعث ایجاد نیروهای منفذ استریک شده و منجر به تثبیت استریک در مورد پلی کربوکسیلات اتر (PCE)، آخرین نسل از فوقالعاده پلاستیسایزر شیمیایی که بهطور خاص برای افزایش کارایی بتن طراحی شدهاست در حالی که محتوای آب آن را کاهش میدهد تا خواص و دوام آن بهبود یابد. وقتی که پلیمرهای زنجیری بهطور آزاد جذب میشوند، یک زنجیره پلیمری ممکن است دو ذره را به هم متصل کند و باعث ایجاد نیروهای پایدار شود. این وضعیت به عنوان «جابجایی پل» نامیده میشود.
هنگامی که تجمع ذرات تنها توسط انتشار منتشر میشود، یک اشاره به تجمع پرکینتیک است. جمع شدن میتواند از طریق استرس برشی افزایش یابد (به عنوان مثال، هم زدن). مورد دوم، تجمع اورتوکینتیک نامیده میشود.
مراحل بعدی
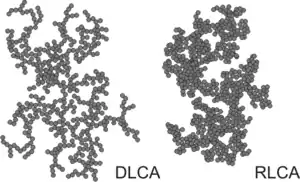
همانطور که روند تجمع ادامه مییابد، خوشههای بزرگتر تشکیل میشوند. این رشد بهطور عمده از طریق روابط بین خوشههای مختلف اتفاق میافتد و بنابراین به یک فرایند تجمع خوشه-خوشه اشاره میشود. خوشههای نتیجه نامنظم هستند، اما از لحاظ آماری مشابه خودشان هستند. آنها نمونههایی از انبوه فرکتال، به موجب آن جرم خود را M با اندازه معمولی خود است که با شعاع گردش R گرم به عنوان یک قدرت قانون رشد میکند. جایی که d عدد فراکتال جرم است. با توجه به اینکه آیا تجمع سریع یا آهسته است، یکی به عنوان تجمع خوشه ای محدود (DLCA) یا تجمع خوشه ای واکنش واکنش (RLCA) اشاره دارد. خوشهها در هر رژیم ویژگیهای متفاوت دارند. در d ≈ ۱٫۸خوشههای DLCA شل و تقسیم شدهاند، در حالی که در d ≈ ۲٫۱خوشههای RLCA فشرده تر هستند. توزیع اندازه خوشه نیز در این دو رژیم متفاوت است. خوشههای DLCA نسبتاً یکپارچه هستند، در حالی که توزیع اندازه خوشههای RLCA بسیار وسیع است. هرچه اندازه خوشه بزرگتر باشد سریعتر سرعت استقرار آنها میرسد؛ بنابراین مکانیزم رسوب ذرات جمعآوری شده راهی برای جدا شدن آنها از تعلیق فراهم میکند. در غلظت ذرات بالاتر، خوشههای در حال رشد ممکن است به یکدیگر متصل شوند و یک ژل ذرات تشکیل دهند. چنین ژل یک بدن جامد الاستیک است، اما با داشتن یک مدول الاستیک بسیار کم، از جامدات معمولی متفاوت است.
تجمع یکنواخت در مقابل تجمع غیر یکنواخت
هنگامی که تجمع در یک واکنش متشکل از ذرات کلوئیدی مشابه جدا جدا اتفاق میافتد، این فرایند تجمع یکنواخت نامیده میشود. هنگامی که تجمع در یک تعلیق متشکل از ذرات کلوئیدی متفاوتی اتفاق میافتد، یک اشاره به تجمع غیریکنواخت است. سادهترین فرایند تجمع غیریکنواخت زمانی رخ میدهد که دو نوع ذرات کلوئیدی جدا جدا مخلوط شوند. در مراحل اولیه، ممکن است شکلهای مختلفی از دوطرف تشکیل شود.
- A + A → A 2
- B + B → B 2
- A + B → AB
در حالی که دو فرایند اول مربوط به تجمع یکنواخت در سوسپانسیونهای خالص حاوی ذرات A یا B هستند، آخرین واکنش نشان دهنده روند واقعی تجمع غیریکنواخت است. هر یک از این واکنشها با ضریب تجمع مربوط k AA , k BB و k AB مشخص میشود. به عنوان مثال، هنگامی که ذرات A و B دارای بار مثبت و منفی هستند، به ترتیب، سرعت تجمع یکنواخت ممکن است آهسته باشد، در حالی که سرعت تجمع غیر یکنواخت سریع است. در مقایسه با تجمع یکنواخت، میزان تجمع غیریکنواخت با کاهش غلظت نمک تسریع میشود. خوشههای تشکیل شده در مراحل بعدی چنین فرایندهای تجمع غیر یکنواخت حتی بیشتر از آنچه که در طول d ≈ ۱٫۴در DLCAبه دست آمدهاست. یک مورد خاص مهم در فرایند تجمع غیریکنواخت رسوب ذرات بر روی بستراست. مراحل اولیه فرایند، متصل شدن به ذرات بهصورت فرد به بستر است که میتواند به عنوان یک ذره بسیار بزرگتر به نظر برسد. مراحل بعدی ممکن است انعطافپذیری زیربخش را از طریق تداخلهای بین ذرات بین ذرات بازتاب دهند، در حالی که تعاملات جذاب میتواند به رشد چند لایه منجر شود، و همچنین به عنوان رسیدن به آن خوانده میشود. این پدیدهها با ضایعات غشایی یا فیلتر مرتبط است.
تکنیکهای تجربی
تکنیکهای تجربی متعددی برای بررسی تجمع ذرات ایجاد شدهاند. اغلب موارد استفاده از تکنیکهای نوری حل شده با زمان است که بر پایه انتقال یا پراکندگی نور میباشد.
- انتقال نور
- تنوع نور عبور شده از طریق یک سوپاپ جمعکننده را میتوان با اسپکتروفتومتر منظم در منطقه قابل مشاهده مورد مطالعه قرار داد. از آنجا که درآمد حاصل از تجمع، محیط کمتر میشود و جذب آن افزایش مییابد. افزایش جذب میتواند به ثابت ثابت k تبدیل شود و نسبت ثبات را میتوان از این طریق اندازهگیری کرد. مزیت این روش سادگی آن است.
- پراکندگی نور
- این تکنیکها بر اساس بررسی نور پراکنده از یک تعلیق جمعکننده در یک زمان حل شدهاست. پراکندگی نور استاتیک تغییر در شدت پراکندگی را میدهد، در حالی که پویایی نور پویا تغییر در شعاع هیدرودینامیکی ظاهری است. در ابتدای مراحل تجمع، تغییر هر یک از این مقادیر بهطور مستقیم با ثابت ثابت تجمع k برابر است. در مراحل بعد میتوان اطلاعاتی در مورد خوشههای شکل داده شده (به عنوان مثال، ابعاد فراکتال) بدست آورد. پراکندگی نور به خوبی برای طیف گستردهای از اندازه ذرات کار میکند. اثرات پراکندگی چندگانه را باید در نظر گرفت، زیرا پراکندگی برای ذرات بزرگتر یا سنگهای بزرگتر اهمیت بیشتری پیدا میکند. چنین اثرات را میتوان در تعلیقهای ضعیف آشفته نادیده گرفت. فرایندهای انباشتگی در سیستمهای بسیار پراکنده با روشهای انتقال، تکنولوژی بازگشتی یا اسپکتروسکوپی موج پخش شده مورد مطالعه قرار گرفتهاست.
- شمارش ذرات تنها
- این تکنیک، تحلیل عالی ارائه میدهد، به این ترتیب خوشههای ساخته شده از دهم ذرات میتواند به صورت جداگانه حل شود. تعلیق مخلوط از طریق یک شمش تیتانیوم مویرگی مجبور میشود و اندازه هر ترکیب با پراکندگی نور تجزیه میشود. از شدت پراکندگی، میتوان اندازه هر یک از مقادیر را محاسبه کرد و یک توزیع اندازه دقیق جمع شد. اگر سوسپانسیون حاوی مقادیر زیاد نمک باشد، میتوان بهطور یکسان از یک شمارنده Coulter استفاده کرد. با گذشت زمان، توزیع اندازه نسبت به مقادیر بزرگتر تغییر میکند و از این تجمع و تنزل تنوع و خوشههای مختلف میتواند نتیجهگیری شود. ناکارآمدی این تکنیک این است که سازهها از طریق یک مویرگ باریک تحت برش بالا مجبور میشوند و در این شرایط ممکن است این ترکیبها اختلال ایجاد کنند.
- تکنیکهای غیر مستقیم
- همانطور که بسیاری از خواص سوسپانسیونهای کلوئیدی بستگی به حالت تجمع ذرات معلق دارند، روشهای مختلف غیر مستقیم برای نظارت بر تجمع ذرات نیز مورد استفاده قرار گرفتهاند. در حالی که ممکن است اطلاعات کمی در مورد میزان تجمع یا خواص خوشه ای از چنین آزمایشهایی بدست آید، آنها میتوانند برای برنامههای عملی بسیار مفید باشند. در میان این تکنیکها، تکنیک حل تست دارای ارتباط بیشتری میباشد. هنگامی که یک سری از لولههای آزمایش با سوسپانسیونهای آماده شده در انبوهی از غلظتهای مختلف بررسی میشود، تعلیقهای پایدار اغلب پراکنده میشوند، در حالی که آنها ناپایدار هستند. ابزارهای خودکار مبتنی بر پراکندگی / انتقال نور برای نظارت بر تعلیق توسعه یافتهاند و از آنها میتوان برای تجمع ذرات استفاده کرد. با این حال باید بدانید که این تکنیکها همیشه نمیتوانند وضعیت واقعی تجمع تعلیق را درست نشان دهند. به عنوان مثال، ذرات اولیه بزرگتر ممکن است حتی در غیاب تجمع حل شوند، یا آلیاژهایی که ژل کلوئیدی ایجاد کردهاند، در تعلیق باقی خواهند ماند. دیگر روشهای غیر مستقیم که قادر به نظارت بر حالت تجمع هستند، شامل، فیلتر کردن، رولوژی، جذب امواج التراسونیک یا خواص دی الکتریک میباشند.
- ارتباط
تجمع ذرات یک پدیده گستردهاست که به صورت خود به خود در طبیعت رخ میدهد اما در تولید نیز بهطور گستردهای مورد بررسی قرار میگیرد. بعضی از نمونهها شامل: تشکیل دلتای رودخانه:هنگامی که آبهای رودخانه حمل ذرات رسوب معلق به آب نمکی میرسند، تجمع ذرات ممکن است یکی از عوامل مؤثر در تشکیل دلتا رود باشد. ذرات شارژ در آب شیرین رودخانه که حاوی مقادیر کم نمک هستند، پایدار هستند، اما در آب دریا حاوی مقادیر زیاد نمک است. در محیط آخر ذرات جمع شدهاند، رسوبات بزرگتری را تشکیل میدهند و در آخر دلتای رودخانه تشکیل میشود. کاغذ سازی: الیاف نگهداری به پالپ اضافه میشود تا سرعت تشکیل کاغذ را افزایش دهد. این کمکها، کمکهای انعقادی هستند که تجمع بین الیاف سلولز و ذرات پرکننده را تسریع میکند. اغلب پلی اتیلنهای کاتیونی برای این منظور استفاده میشوند. درمان آب:درمان با فاضلاب شهری بهطور معمول شامل مرحله ای است که ذرات جامد جامد را حذف میکند. این جداسازی با افزودن یک عامل فلوکالی یا انعقاد دهنده حاصل میشود که باعث جمع شدن مواد جامد معلق میشود. این سازهها معمولاً با رسوب گذاری جداسازی میشوند و منجر به لجن فاضلاب میشوند. معمولاً مواد فلوکولتیک کننده در تصفیه آب شامل یونهای چند واسطه فلز (به عنوان مثال Fe 3+ یا Al 3+)، پلی الکترولیتها یا هر دو میباشند. ساخت پنیر: گام کلیدی در تولید پنیر، جداسازی شیر در فراوردههای جامد و آب مایع است. این جداسازی بوسیله القاء فرایند تجمع بین ریزه سازههای پروتئین شیر (کازئین) بوسیله اسید شیر یا اضافه کردن شیره به دست میآید. اسیدی کردن گروههای کربوکسیلات را بر روی ریزه سازهها خنثی میکند و باعث تجمع میشود.
منابع
- M. Elimelech, J. Gregory, X. Jia, R. Williams, Particle Deposition and Aggregation: Measurement, Modelling and Simulation, Butterworth-Heinemann, 1998.
- D. F. Evans, H. Wennerstrom, The Colloidal Domain, John Wiley, 1999.