واکسن RNA
واکسن RNA یا واکسن mRNA نوعی واکسن است که از کپی یک ماده شیمیایی طبیعی به نام RNA پیامبر (mRNA) برای ایجاد پاسخ ایمنی استفاده میکند.[1] این واکسن مولکولهای سنتز شدهٔ RNA (یعنی RNAهای مصنوعی) را به سلولهای ایمنی ترافرست میکند، هنگامی که واکسن RNA درون سلولهای ایمنی جای گیرد به عنوان mRNA عمل کرده و باعث میشود تا سلول پروتئین خارجی که بهطور معمول توسط پاتوژن (مانند ویروس) یا سلول سرطانی ساخته میشود را بسازد. این مولکولهای پروتئینی یک واکنش ایمنی سازگار را تحریک میکنند که به بدن میآموزد چگونه پاتوژن یا سلولهای سرطانی مربوط را شناسایی کرده و از بین ببرد.[1] تحویل mRNA با هم-فرمولاسیون مولکولی به نانوذرات لیپیدی حاصل میشود که از رشتههای RNA حفاظت کرده و به جذبشان توسط سلول کمک میکند.[2][3]
واکنشزایی (Reactogenicity)، از ویژگیهای واکسنی است که قادر به تولید واکنشهای سوء «مورد انتظار» باشد، همچون واکنشهای سوئی که بقیه واکسنهای غیر RNA تولید میکنند.[4] افرادی که نسبت به پاسخ خودایمنی آسیب پذیرند، ممکن است نسبت به واکسنهای RNA واکنش سوء از خود بروز دهند.[4] از مزایای واکسنهای RNA نسبت به واکسنهای پروتئینی سنتی، میتوان به طراحی آسانتر، سرعت تولید بیشتر، هزینه اندک تولید،[5][4] و القای ایمنی هومورال و همچنین سلولی اشاره کرد.[6] از نقاط ضعف واکسنهای mRNA کووید ۱۹ که توسط Pfizer–BioNTech تولید شدهاند، این است که قبل از توزیع مستلزم نگهداری در دمای فوق پایین میباشند.[1]
در میان روشهای درمانی RNA، واکسنهای mRNA، به عنوان واکسنهایی برای کووید ۱۹، به میزان قابل توجهی مورد استقبال قرار گرفتهاند. تا دسامبر ۲۰۲۰، دو واکسن mRNA جدید معرفی شدند که دوره هشت هفتهای مورد نیاز برای تکمیل آزمایشهای انسانی پسا-پایانی را گذرانده، و منتظر مجوز استفاده اورژانسی (EUA) بودند: واکسن کووید-۱۹ مدرنا (mRNA-1273) و واکسن کووید-۱۹ فایزر-بیوانتک (BNT162b2)[1] در ۲ دسامبر ۲۰۲۰، آژانس تنظیم تولیدات سلامتی و پزشکی بریتانیا (MHRA)، تبدیل به اولین تنظیمکننده پزشکی شد که یک واکسن mRNA را تأیید کرده و بدین صورت به استفاده گسترده از واکسن کووید-۱۹ فایزر-بیوانتک (با نام تجاری Comirnaty) مجوز داد.[7][8][9] در ۱۱ دسامبر ۲۰۲۰، سازمان غذا و داروی آمریکا (FDA)، یک مجوز اورژانسی (EUA) برا واکسن کووید-۱۹ فایزر-بیوانتک صادر کرده و مراکز کنترل و پیشگیری بیماریها (CDC)، در ۱۲ دسامبر ۲۰۲۰ استفاده از آن را برای سنین ۱۶ به بالا توصیه نمود.[10][11] در ۱۹ دسامبر ۲۰۲۰، CDC استفاده از واکسن COVID-19 مدرنا را پس از کسب EUA از FDA در بالغین توصیه نمود.[12][13]
استفاده از RNA برای واکسن، موجب به جریان افتادن اطلاعات نادرستی در مورد آن درون شبکههای اجتماعی شده که به غلط ادعا میکنند که استفاده از RNA موجب تغییر DNA افراد شده، یا بر روی سوابق ایمنی نامعلوم آن در گذشته تأکید میکنند، در حالی که تجمع شواهد ناشی از آزمایشهای مربوط به دهها هزار نفر را نادیده میانگارند.[14]
تاریخچه
محققان مؤسسهٔ سالک دانشگاه کالیفرنیا سان دیگو با یک شرکت بیوتکنولوژی مستقر در آمریکا (Vical Incorporated) در سال ۱۹۸۹ اثری منتشر کردند که نشان میدهد mRNA با استفاده از یک نانو ذره لیپیدی برای تحویل دارو میتواند، mRNA را به سلولهای یوکاریوتی گوناگون انتقال دهد. در سال ۱۹۹۰ دانشگاه ویسکانسین نتایج مثبتی را در زمینه تزریق mRNA برهنه (محافظت نشده) به عضله موش گزارش داد؛ این مطالعات اولین شاهد حاکی بر این بود که mRNA در رونویسی آزمایشگاهی (IVT) قادر است اطلاعات ژنتیکی را برای تولید پروتئین در بافت سلول زنده فراهم کند.
استفاده از واکسنهای RNA به اوایل دهه ۱۹۹۰ برمیگردد. نمایش آزمایشگاهی mRNA در حیوانات اولین بار در سال ۱۹۹۰ گزارش شد و مدتی کوتاهی پس از آن به عنوان واکسیناسیون استفاده شد. در سال ۱۹۹۳ مارتینون نشان داد که RNA کپسول شده با لیپوزوم میتواند سلولهای T را در بدن تحریک کند و در سال ۱۹۹۴ زوو و برگلوند اولین شواهد مبنی بر استفاده از RNA به عنوان واکسن برای برانگیختن پاسخ ایمنی هومورال و سلولی در برابر پاتوژن را منتشر کردند.
بیوشیمی دان مجارستانی کاتالین کاریکو تلاش کرد تا برخی از موانع فنی اصلی در ورود mRNA به سلولها را در دهه ۱۹۹۰ حل کند. کاریکو با ایمونولوژیست آمریکایی درو ویسمن مشارکت داشت و تا سال ۲۰۰۵ آنها مقاله مشترکی منتشر کردند که یکی از موانع اصلی فنی را با استفاده از نوکلئوزیدهای اصلاح شده برای به دست آوردن mRNA در داخل سلولها بدون تحریک سیستم دفاعی بدن، را برطرف میکند. زیستشناس سلولهای بنیادی هاروارد، درک روسی (سپس در استنفورد) مقاله کاریکو و وایسمن را خواند و فهمید که کار آنها «پیشگامانه» بوده و در سال ۲۰۱۰ مدرنا بایوتک به همراه رابرت لانگر mRNA متمرکز را تأسیس نمود و همچنین مجوز تولید واکسنی همچون مدرنا، بایو ان تک و مجوز کارها کاریکو و ویسمن را داد.
در سال ۲۰۰۰، اینگمار هورر زیستشناس آلمانی مقاله ای در مورد کارایی واکسنهای حاوی RNA منتشر نمود که وی آن را به عنوان بخشی از درجه دکترا مطالعه کرد. وی پس از اتمام دوره دکترا همراه با سرپرست دکترای خود گونتر یونگ، استیو پاسکولو، فلوریان فون در مولبه و هانس-گئورگ رامنسی CureVac را تأسیس کرد.
این شرکتهای بیوتکنولوژی mRNA تا سال ۲۰۲۰ نتایج ضعیفی در آزمایش داروهای mRNA برای بیماریهای قلبی عروقی، متابولیکی و کلیوی، اهداف انتخاب شده برای سرطان؛ و بیماریهای نادری مانند سندرم کریگلر-نجار داشتند. بسیاری از آنان دریافتند عوارض جانبی الحاق mRNA بسیار جدی است. واکسنهای mRNA برای استفادهٔ انسانی نظیر بیماریهای هاری، زیکا، سیتومگالوویروس و آنفلوانزا توسعه یافته و آزمایش شدهاند، اگرچه این واکسنهای mRNA مجوز ندارند اما بسیاری از شرکتهای بزرگ دارویی این فناوری را رها کرده در حالی که دوباره برخی از فناوریهای زیستی روی محدوده کم سود واکسنها متمرکز شدند تا جایی که با کاهش دوزها در سطوح پایینتر عوارض جانبی نیز کاهش مییابد.
تا پیش از شیوع بیماری کووید ۱۹، هیچ داروی یا واکسنی حاوی mRNA مجوز استفاده در انسان را نداشت. در دسامبر سال ۲۰۲۰، هر دو مدرنا و پی فایزر_ بایو ان تک مجوز استفاده اضطراری خود را برای واکسنهای کووید ۱۹ حاوی mRNA دریافت کردند که توسط عملیات Warp Speed (مستقیماً در مورد مدرنا و غیرمستقیم برای پی فایزر_ بایو ان تک) تأمین شده بود. در ۲ دسامبر سال ۲۰۲۰، هفت روز پس از آخرین آزمایشها ی هشت هفته ای، آژانس تنظیم مقررات محصولات پزشکی و مراقبت از سلامت انگلیس (MHRA)، اولین تنظیم کننده داروهای جهانی در تاریخ است که واکسن mRNA را تأیید کرده و «مجوز اضطراری» را به کووید ۱۹ پی فایزر_ بایو ان تک BNT162b2 برای استفاده گسترده اعطا میکند. جون راین، مدیر عامل MHRA گفت: «هیچ اهمالی در تصویب آن صورت نگرفتهاست»، و «مزایای آن بیشتر از هر گونه خطر است». در ۱۱ دسامبر ۲۰۲۰، FDA مجوز استفاده اضطراری را برای واکسن پی فایزر_ بایو ان تک کووید ۱۹ داد.
سازوکار
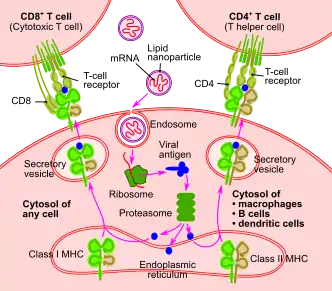
هدف واکسن این است که سیستم ایمنی انطباقی را تحریک کرده تا پادتنهایی را ایجاد کند که دقیقاً این پاتوژن خاص را هدف قرار میدهد. نشانگرهای پاتوژن که هدف پادتنها هستند، آنتیژنها نامیده میشوند.
واکسنهای mRNA به شیوه ای بسیار متفاوت از یک واکسن سنتی عمل میکنند. واکسنهای سنتی، یک پاسخ آنتیبادی را با تزریق آنتیژنهای یک ویروس ضعیف (ویروس ضعیف یا بیضرر) یا یک وکتور ویروسی رمزگذار آنتیژن نوترکیب (ویروس حامل آنتیژنها مهندسی شده) به عضلات وارد کرده؛ این مواد حاوی آنتیژن، خارج از بدن ترکیب شده و رشد میکنند.
در مقابل، واکسنهای mRNA یک قطعه کوتاه مدت ایجاد شده که توالی RNA یک ویروس را به فرد واکسینه معرفی میکنند. این قطعات mRNA توسط سلولهای دندریتیک - یک نوع سلول سیستم ایمنی بدن - توسط فاگوسیتوز مصرف میشود. سلولهای دندریتیک از اندامکهای داخلی خود (ریبوزومها) استفاده میکنند تا mRNA را بخوانند و رمزگردانی کند تا قبل از اینکه mRNA از بین برود آنتیژنهای ویروسی را تولید کند.
هنگامی که آنتیژنهای ویروسی توسط سلول میزبان تولید میشوند، روند طبیعی سیستم ایمنی اختصاصی دنبال میشود. آنتیژنها توسط پروتئازومها تجزیه شده و سپس مولکولهای کلاس I و کلاس II MHC به آنتیژن متصل میشوند و آن را به غشای سلولی منتقل میکنند تا سلول دندریتیک را «فعال» کنند. سلولهای دندریتیک پس از فعال شدن، به غدد لنفاوی مهاجرت کرده؛ همان محلی که آنتیژن به سلولهای T و سلولهای B ارائه میشود و منجر به تولید پادتنهایی که بهطور خاص برای آنتیژن، هدف قرار میگیرند شده و در نهایت منجر به ایمنی میشوند.
مزایای استفاده از mRNA برای تولید آنتیژن از سلولهای میزبان این است که تولید mRNA برای سازندگان واکسن بسیار آسانتر از پروتئینهای آنتیژنی یا ویروس ضعیف شدهاست. مزیت دیگر سرعت طراحی و تولید است؛ مدرنا واکسن mRNA-1273 خود را تنها در مدت ۲ روز برای کویید۱۹ طراحی کرد؛ از آنجا که آنتیژنها در داخل سلول تولید میشوند شایان ذکر است یکی دیگر از مزایای واکسنهای RNA تحریک ایمنی هومورال و نیز ایمنی سلولی است.
واکسنهای mRNA بر برنامهریزی مجددDNA درون سلول اثری ندارد؛ قطعه یmRNA مصنوعی، یک کپی از قسمت خاص RNA ویروس است که دستورالعمل ساخت آنتیژن ویروس را به همراه دارد. (سنبله پروتئینی، در مورد واکسنهای اصلی mRNA ویروس کرونا) است که به DNA مربوط نیست. این تصور غلط هنگامی که واکسنهای mRNA کووید ۱۹ به شهرت عمومی رسیدند ، منتشر شد که یک تئوری توطئه بیبها بیش نیست.
mRNA پس از تولید پروتئین خارجی باید در سلولها تخریب شود. با این حال، از آنجا که فرمولاسیون خاص (شامل ترکیب دقیق پوشش دارویی نانوذرات لیپیدی) توسط تولیدکنندگان کاندیدا واکسنهای mRNA محرمانه نگه داشته میشود، هنوز جزئیات و زمان آن توسط اشخاص ثالث تحقیق نشدهاست.
انتقال
روش انتقال واکسن را میتوان بهطور کلی به دو دسته طبقهبندی کرد: انتقال RNA به سلولها در داخل بدن موجود زنده (in vivo) یا خارج از بدن(ex vivo) موجود زنده انجام میشود.
خارج از بدن
سلولهای دندریتیک نوعی سلول ایمنی هستند که آنتیژنهایی را در سطح خود دارند که برای آغاز پاسخ ایمنی با سلولهای T به فعل و انفعالاتی میپردازد. سلولهای دندریتیک را میتوان از بیماران گردآوری و با mRNA مورد نظر ترکیب کرد. سپس، میتوان آنها را مجدداً برای بیماران تجویز کرد تا پاسخ ایمنی ایجاد کند.
داخل بدن
از زمان کشف و معرفی mRNA، رونویسی در شرایط (in vitro)که پس از تجویز مستقیم منجر به بیان داخل بدن میشود، رویکردهای in vivo جذابیت بیشتری پیدا میکند. آنها مزایایی نسبت به روشهای ex vivo دارند، به ویژه با جلوگیری از هزینه برداشت و سازگاری با سلولهای دندریتیک بیماران به واسطهٔ تقلید از عفونت منظم، هنوز هم موانعی برای غلبه بر این اسلوب وجود دارد تا واکسیناسیون RNA یک روش قوی باشد. مکانیسمهای تکاملی که از نفوذ مواد هسته ای ناشناخته جلوگیری کرده و باعث تخریب توسط RNases میشوند، برای شروع ترجمه باید دور زده شوند. علاوه بر این، RNA برای حرکت در داخل سلول از طریق انتشار بیش از حد سنگین است و باعث میشود توسط سلول میزبان کشف و از بین برود.
تزریق mRNA برهنه
تزریق برهنه به این معنی است که محتویات واکسن به راحتی در یک بافر نگهداری میشود. این حالت جذب، از اوایل سال ۲۰۰۰ شناخته شدهاست. اولین مطالعات بالینی گستردهٔ جهانی (توبینگن، آلمان) از تزریق mRNA برهنه، داخل پوست برای واکسیناسیون استفاده کردهاست.
استفاده از RNA به عنوان ابزاری برای واکسن در دهه ۱۹۹۰ به صورت mRNA خود تقویت کننده کشف شد. دو دسته اصلی واکسنهای mRNA غیر تقویت کننده (حاملهای ویروسی مرسوم) و mRNA خود تقویت کننده مولکولی (حاملهای غیر ویروسی) هستند. وقتی mRNA به صورت غیر ویروسی منتقل میشود، وارد سیتوپلاسم سلول شده و میتواند پروتئین آنتی ژنیک را تقویت و بیان کند.
همچنین مشخص شدهاست که راههای مختلف تزریق، مانند: وارد شدن به پوست، خون یا عضلات منجر به تغییر سطوح مختلف جذب mRNA میشود بنابراین انتخاب مسیر اجرایی جنبه اساسی پذیرش است. یک مطالعه، در مقایسه مسیرهای مختلف نشان داد که تزریق غدد لنفاوی منجر به بیشترین پاسخ سلول T میشود.
مکانیسمها و در نتیجه ارزیابی mRNA خود تقویت کننده ممکن است متفاوت باشد، زیرا mRNA خود تقویت کننده با داشتن یک مولکول بسیار بزرگتر، از نظر اندازه تفاوت اساسی دارد.
وکتور پلی پلکس
پلیمرهای کاتیونی را میتوان با mRNA مخلوط کرد تا پوششهای محافظتی به نام پلی پلکس ایجاد شود. وکترهای پلی پلکس از mRNA نوترکیب در برابر ریبونوکلئازها محافظت کرده و به نفوذ آن در سلول کمک میکنند. پروتامین یک پپتید کاتیونی طبیعی است که برای کپسول کردن mRNA برای واکسیناسیون استفاده شدهاست. (منبع غیر اولیه مورد نیاز است)
وکتور (حامل) نانوذرات لیپید
در سال ۲۰۱۸ اولین بار FDA استفاده از نانوذرات لیپید را به عنوان سیستم تحویل دارو تأیید کرد. زمانی که آژانس اولین داروی siRNA , Onpattro را تصدیق نمود؛ کپسوله سازی مولکول mRNA در نانوذرات لیپیدی یک موفقیت اساسی برای تولید واکسنهای زنده mRNA محسوب میشد که تعدادی از موانع فنی اصلی را در رساندن مولکول mRNA به سلول میزبان حل میکرد. اصولاً، لیپید یک لایه محافظ در برابر تخریب ایجاد میکند تا خروجی ترجمهٔ قوی تری را فراهم کند. علاوه بر این، سفارشی سازی لایه خارجی لیپید اجازه میدهد تا از طریق فعل و انفعالات لیگاند، انواع سلولهای مورد نظر را هدف قرار دهیم. با این حال، بسیاری از مطالعات همچنین دشواری مطالعه این نوع انتقال را برجسته کرده و نشان میدهد که از نظر میزان مصرف سلول بین نانوذرات و in vitro موارد ناسازگاری وجود دارد. نانوذرات میتوانند به بدن تزریق شده و از طریق چندین مسیر همچون وریدی یا از طریق سیستم لنفاوی منتقل شوند.
وکتور ویروسی
علاوه بر روشهای غیر ویروسی تحویلی، ویروسهای RNA برای دستیابی به پاسخهای ایمنی مشابه طراحی شدهاند. ویروسهای RNA معمولی که به عنوان وکتور استفاده میشوند شامل ویروسهای خونی، ویروسها لنتی، آلفا ویروسها و ویروسهای ربدو که هر یک از نظر ساختار و عملکرد متفاوت هستند. مطالعات بالینی بر روی طیف وسیعی از بیماریها در گونههای حیوانی همانند موش، مرغ و پستانداران از وکتورهای ویروسی استفاده کردهاست.
عوارض جانبی و خطرات
واکنش زایی، مشابه واکسنهای معمولی و غیر RNA است. با این حال، افرادی که مستعد پاسخ خود ایمنی هستند ممکن است واکنش نامطلوبی به واکسنهای RNA داشته باشند. رشتههای mRNA موجود در واکسن ممکن است یک واکنش ایمنی ناخواسته ایجاد کند که برای به حداقل رساندن این معضل، توالیهای mRNA در واکسنهای mRNA به منظور تقلید از تولید سلولهای میزبان طراحی شدهاست.
در آزمایشها ی واکسن جدید RNA کووید ۱۹ اثرات واکنش زا قوی اما گذرا گزارش شدهاست. بیشتر افراد عوارض جانبی شدیدی را تجربه نمیکنند عوارض جانبی فقط شامل تب و خستگی است. عوارض جانبی شدید به عنوان آنچه که فعالیت روزمره را محدود میکند تعریف میشود.
کلیات
قبل از سال ۲۰۲۰، هیچ بستر فناوری mRNA (دارو یا واکسن) برای استفاده در انسان مجاز نبودهاست، بنابراین خطر اثرات ناشناخته وجود دارد. شیوع ویروس کرونا در ۲۰۲۰ به تولید سریعتر واکسنهای mRNA نیاز داشت و آنها را برای سازمانهای بهداشت ملی جذاب کرد که منجر به بحث در مورد مجوزهای اولیه واکسنهای mRNA (از جمله مجوز استفاده اضطراری یا مجوز دسترسی گسترده) پس پایان دورهٔ هشت هفته ای آزمایشهای انسانی شد.
ذخیرهسازی
از آنجا که mRNA شکننده است، واکسن باید در دمای بسیار پایین نگه داشته شود تا از تخریب آن جلوگیری کند بنابراین ایمنی مؤثر کمی به گیرنده میدهد. واکسن BNT162b2 mRNAباید بین −۸۰ تا −۶۰ درجه سانتیگراد (−۱۱۲ تا −۷۶ درجه فارنهایت) نگهداری شود. مدرنا میگوید واکسن mRNA-1273 آنها میتواند بین ۲۵ تا ۱۵ درجه سانتیگراد (۱۳ تا ۵ درجه فارنهایت) ذخیره شود که قابل مقایسه با فریزر خانگی است، و بین ۲ تا ۸ درجه سانتیگراد تا ۳۰ روز پایدار میماند (۳۶ و ۴۶ درجه فارنهایت) در نوامبر ۲۰۲۰، به گزارش نیچر، «گرچه این احتمال وجود دارد که تفاوت در فرمولاسیون LNP یا ساختارهای ثانویه mRNA بتواند باعت اختلاف مقاومت حرارتی [بین مدرنا و بایو ان تک] بشود، اما بسیاری از کارشناسان گمان میکنند که هر دو واکسن در نهایت دارای الزامات ذخیره سازی مشابه در مخزنهای حیاتی، تحت شرایط مختلف دمایی هستند».
مزایا
واکسنهای سنتی
واکسن RNA مزایای خاصی نسبت به واکسنهای پروتئینی سنتی ارائه میدهد. از آنجا که واکسنهای RNA از یک پاتوژن فعال (یا حتی یک پاتوژن غیرفعال شده) ساخته نشدهاند، غیر عفونی هستند. در مقابل، واکسنهای سنتی، نیاز به تولید پاتوژنها دارند که اگر در حجم بالا انجام شود، میتواند خطرات شیوع ویروس را در تأسیسات تولیدی افزایش دهد. واکسنهای RNA را میتوان سریعتر، ارزانتر و با استاندارد بیشتر (با نرخ خطای کمتر در تولید) تولید کرد، که میتواند حساسیت در برابر شیوع جدی را کاهش دهد.
واکسن DNA
واکسیناسیون RNA علاوه بر مزایای مشترک با واکسنهایی نظری DNA نسبت به واکسنهای پروتئینی سنتی مزایای دیگری نیز دارد. mRNA در سیتوزول ترجمه میشود، بنابراین نیازی به ورود RNA به هسته سلول نیست و از خطر ادغام با ژنوم میزبان جلوگیری میشود. نوکلئوزیدهای اصلاح شده (به عنوان مثال، سودوریدینها، نوکلئوزیدهای 2'-O-متیله شده) میتوانند برای مهار تحریک پاسخ ایمنی برای جلوگیری از تخریب فوری و ایجاد اثر پایدارتر از طریق افزایش ظرفیت ترجمه، در mRNA قرار گیرند. چهارچوب خواندن باز (ORF) و مناطق ترجمه نشده (UTR) mRNA را میتوان برای اهداف مختلف بهینهسازی کرد (فرایندی که مهندسی توالی mRNA نامیده میشود)، به عنوان مثال از طریق غنی سازی محتوای گوانین-سیتوزین یا انتخاب UTRهای خاص شناخته شده، فرایند ترجمه را افزایش میدهد.
به علاوه برای تقویت ترجمه آنتیژن و در نتیجه پاسخ ایمنی، میتوان یک کد اضافی ORF را برای یک مکانیسم تکثیر اضافه کرد؛ بنابراین مقدار مواد اولیه مورد نیاز کاهش مییابد.
فرهنگ و جامعه
اساس اطلاعات غلط قابل توجهی که در رسانههای اجتماعی منتشر شدهاست درمورد استفاده از واکسنهای حاوی RNA که به اشتباه ادعا میشود، استفاده از RNA به نوعی DNA فرد را تغییر میدهد، یا تأکید بر سابقه ایمنی قبلی فناوری ناشناخته دارد، در حالی که مجموعه شواهد اخیر از آزمایشها بر روی دهها هزار نفر را نادیده میگیرند.
در نوامبر سال ۲۰۲۰، واشینگتن پست در مورد تردید واکسن mRNA جدید در میان متخصصان مراقبتهای بهداشتی در ایالات متحده گزارش داد، با استناد به نظرسنجیها: «برخی نمیخواستند در مرحله اول قرار بگیرند، بنابراین میتوانند صبر کنند تا ببینند که آیا عوارض جانبی بالقوه وجود دارد یا خیر.»
کارایی واکسن mRNA برای کووید ۱۹
مشخص نیست که چرا باوجود اینکه که واکسنهای جدید mRNA کویید ۱۹ مدرنا و پی فایزر_بایو ان تک میزان اثربخشی بالقوه ۹۰ تا ۹۵ درصدی را نشان میدهد، آزمایشها ی دارویی mRNA سابق بر روی عوامل بیماریزا به غیر از کووید ۱۹ چندان امیدبخش نبوده که مجبور به کنار گذاشتن آنها در مراحل اولیه آزمایشها شدند. مارگارت لیو، دانشمند پزشک اظهار داشت که این امر میتواند به دلیل "حجم زیادی از منابع در حال توسعه تولید شده و یا واکسنها باعث پاسخ التهابی غیر اختصاصی به mRNA شود که میتواند پاسخ ایمنی خاص آن را افزایش دهد، با توجه به اینکه روش اصلاح شده نوکلئوزید التهاب را کاهش داده اما التهاب را کاملاً از بین نمیبرد. " همچنین ممکن است واکنشهای شدید مانند درد و تب گزارش شده در برخی از دریافت کنندگان واکسن SARS-CoV-2 mRNAرا توضیح دهد ". این واکنشها هرچند شدید اند اما گذرا بوده به عبارت دیگر اعتقاد بر این است که آنها واکنشی به مولکولهای داروی لیپیدی هستند.
بر خلاف مولکولهای DNA، مولکول mRNA یک مولکول بسیار شکننده است که در عرض چند دقیقه در یک محیط در معرض تخریب قرار میگیرد و بنابراین واکسنهای mRNA باید در دمای بسیار پایین حمل و انباشت شوند. در خارج از سلول یا سیستم انتقال دارو، مولکول mRNA نیز به سرعت توسط میزبان تجزیه میشود. این شکنندگی مولکول mRNA مانعی بر اثربخشی هر واکسن mRNA ناشی از تجزیه توده mRNA قبل از ورود به سلولها است؛ که میتواند افراد را به باوری سوق دهد که به گونه ای رفتار کنند که گویی از ایمنی برخوردار نیستید.
منابع
- Park KS, Sun X, Aikins ME, Moon JJ (December 2020). "Non-viral COVID-19 vaccine delivery systems". Advanced Drug Delivery Reviews. 169: 137–151. doi:10.1016/j.addr.2020.12.008. PMC 7744276 Check
|pmc=value (help). PMID 33340620 Check|pmid=value (help). - Kowalski PS, Rudra A, Miao L, Anderson DG (April 2019). "Delivering the Messenger: Advances in Technologies for Therapeutic mRNA Delivery". Mol Ther. 27 (4): 710–728. doi:10.1016/j.ymthe.2019.02.012. PMC 6453548. PMID 30846391.
- Verbeke R, Lentacker I, De Smedt SC, Dewitte H (October 2019). "Three decades of messenger RNA vaccine development". Nano Today. 28: 100766. doi:10.1016/j.nantod.2019.100766.
- Pardi N, Hogan MJ, Porter FW, Weissman D (April 2018). "mRNA vaccines – a new era in vaccinology". Nature Reviews. Drug Discovery. 17 (4): 261–279. doi:10.1038/nrd.2017.243. PMC 5906799. PMID 29326426.
- PHG Foundation (2019). "RNA vaccines: an introduction". University of Cambridge. Retrieved 18 November 2020.
- Kramps T, Elders K (2017). "Introduction to RNA Vaccines". RNA Vaccines: Methods and Protocols. Methods in Molecular Biology. 1499. pp. 1–11. doi:10.1007/978-1-4939-6481-9_1. ISBN 978-1-4939-6479-6. PMID 27987140.
- "UK authorises Pfizer/BioNTech COVID-19 vaccine" (Press release). Department of Health and Social Care. 2 December 2020.
- Boseley S, Halliday J (2 December 2020). "UK approves Pfizer/BioNTech Covid vaccine for rollout next week". The Guardian. Retrieved 2 December 2020.
- "Conditions of Authorisation for Pfizer/BioNTech COVID-19 Vaccine" (Decision). Medicines & Healthcare Products Regulatory Agency. 8 December 2020.
- "FDA Takes Key Action in Fight Against COVID-19 By Issuing Emergency Use Authorization for First COVID-19 Vaccine". U.S. Food and Drug Administration (FDA) (Press release). 11 December 2020. Retrieved 6 February 2021.
- Oliver SE, Gargano JW, Marin M, Wallace M, Curran KG, Chamberland M, et al. (December 2020). "The Advisory Committee on Immunization Practices' Interim Recommendation for Use of Pfizer-BioNTech COVID-19 Vaccine - United States, December 2020" (PDF). MMWR Morb Mortal Wkly Rep. 69 (50): 1922–24. doi:10.15585/mmwr.mm6950e2. PMC 7745957 Check
|pmc=value (help). PMID 33332292 Check|pmid=value (help). - "FDA Takes Additional Action in Fight Against COVID-19 By Issuing Emergency Use Authorization for Second COVID-19 Vaccine". U.S. Food and Drug Administration (FDA) (Press release). 18 December 2020.
- Oliver SE, Gargano JW, Marin M, Wallace M, Curran KG, Chamberland M, et al. (January 2021). "The Advisory Committee on Immunization Practices' Interim Recommendation for Use of Moderna COVID-19 Vaccine - United States, December 2020" (PDF). MMWR Morb Mortal Wkly Rep. 69 (5152): 1653–56. doi:10.15585/mmwr.mm695152e1. PMID 33382675 Check
|pmid=value (help). S2CID 229945697. - Carmichael F, Goodman J (2 December 2020). "Vaccine rumours debunked: Microchips, 'altered DNA' and more" (Reality Check). BBC.
- مشارکتکنندگان ویکیپدیا. «RNA vaccine». در دانشنامهٔ ویکیپدیای انگلیسی.
پیوندهای بیرونی
- Roberts J (April 2020). "Five things you need to know about: mRNA vaccines". Horizon.
- Blackburn L (October 2020). "RNA vaccines: an introduction". PHG Foundation. دانشگاه کمبریج.
- "Understanding mRNA COVID-19 Vaccines". مرکز کنترل و پیشگیری بیماری.
- "Understanding and Explaining mRNA COVID-19 Vaccines". مرکز کنترل و پیشگیری بیماری.