تعیین جنسیت وابسته به دما
تعیین جنسیت وابسته به دما (TSD) نوعی تعیین جنسیت محیطی است که در آن درجه حرارت تعیین شده در حین رشد جنینی/لارویی، جنسیت فرزند را تعیین میکند.[1] این موضوع تنها در خزندگان و ماهیان (پیوسته استخوانان) قابل مشاهده است.[2][3][4][5] TSD یا (تعیین جنسیت وابسته به دما) با سیستمهای تعیین جنسیت کروموزومی در بین مهره داران متفاوت است. این روش، محبوبترین و مورد مطالعهترین نوع تعیین جنسیت محیطی (ESD) است. برخی از شرایط دیگرمانند چگالی، pH و رنگ پسزمینهٔ محیطی نیز برای تعیین نسبت جنسیت، که میتواند بسته به عوامل مؤثر، به عنوان تعیین جنسیت وابسته به دما، یا تمایز جنسی وابسته به دما طبقهبندی شود، مورد مشاهده قرار میگیرند.[6] این عوامل به عنوان مکانیسمهای تعیین جنسیت، TSD و تعیین جنسینگی (GSD) باید بهصورت یکسان در نظر گرفته شوند،[7] که میتواند منجر به تعییر وضعیت گونههای ماهی در هنگام تعییر درجه حرارت شود. درجه حرارت ایجاد شده در طول دوران رابطه مستقیمی با جنسیت فرزند دارد.
در حالی که TSD در بسیاری از گونههای خزنده و ماهی مشاهده شدهاست، تفاوتهای ژنتیکی بین جنسها و مکانیسمهای مولکولی TSD آشکار نشدهاست.[6] تصور میشود که مسیر واسطه کورتیزول و مسیر نظارتی اپی ژنتیک مکانیسمهای بالقوه درگیر در TSD هستند.[8]
تخمها وقتی که در طی یک سوم میانی رشد جنینی خود هستند بسیار تحت تأثیر دما هستند. این دورهٔ حساسی در تولید مثل است که به عنوان دوره حساسیت به گرما شناخته میشود
بسیاری از دانشمندان بر این باورند که تمایز جنسی یعنی تعیین جنسیت تخم در گنادهای لاک پشتها وابسته به دما است برای اینکه بتوانیم دقیق جنسیت را تعیین کنیم محدوده زمانی مشخصی داریم
دوره گرماسنجی یا حساس به دما (TSP) دوره ای است که در هنگام رشد غیرقابل برگشت میباشد. از آن با استفاده از گونههایی با تعیین جنسیت وابسته به دما، مانند تمساحها و لاک پشتها استفاده میشود.[9] TSP معمولاً دوره یک سوم میانی جوجه کشی که نقطه پایانی مرحله جنینی است. محدوده زمانی TSP کمی در میان گونههای متفاوت است، رشد و نمو دیر هنگام جنین در مجاری عبور تخم باید در نظر گرفته شود (به عنوان مثال بسیاری از مارمولک). ارسال پالس گرما در طی دوره حساسیت گرمایی اغلب برای تعیین جنسیت کافی است، اما پس از TSP، جنسیت نسبت به دما جواب نمیدهد. با این حال، پس از این دوره، تغییر جنسیت امکانپذیر نیست.
انواع
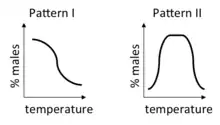
در درون این سازوکار، دو الگوی مشخص کشف شده و نام آنرا الگوی (Pattern)یک و الگوی دو گذاشتهاند الگوی یک به دو الگوی IA و IB تقسیم میشود.
الگو IA یک منطقه انتقال منفرد دارد، که تخمها عمدتاً در صورت انکوبه شدن در این منطقه در دمای زیر آن نرها بهوجود میآیند، و در صورت انکوبه شدن در دمای بالاتر عمدتاً مادهها را تخم میگذارند. الگو IA در بیشتر لاک پشتها اتفاق میافتد ، انتقال بین دمای تولیدکننده مرد و دمای تولیدکننده زن در طیف وسیعی از درجه حرارت به حداقل ۱ تا ۲ درجه سانتی گراد اتفاق میافتد.[11] الگوی IB همچنین دارای یک منطقه انتقال منفرد است، اما مادهها در زیر آن تولید میشوند و نرها در بالای آن هستند. الگو IB در توراتارا رخ میدهد.
الگو II دارای دو منطقه گذار است که نرها در درجه حرارت متوسط و مادهها دربالا و پایین این دما تولید میشوند.[12] الگوی II در بعضی از لاک پشتها، مارمولکها و تمساحها اتفاق میافتد.[13] در درجه حرارتهای حد واسط تعیین جنسیت، نسبتهای جنسی مختلط و (به ندرت) افراد بینابینی تولید میشوند.[11]
پیشنهاد شدهاست که اساساً تمام حالتهای TSD در واقع الگوی دوم هستند و مواردی که از الگوی مذکر و مؤنث انتظار میرود منحرف میشوند گونههایی هستند که لانهها به سادگی هرگز در معرض دامنه دمای شدید در یک انتهای دامنه یا دیگری مشاهده نمیشوند
تمایز بین سیستمهای تعیین جنسیت کروموزومی و TSD اغلب مبهم است زیرا جنس برخی از گونهها – مانند پوست سه لایه Bassiana duperreyi و ریش مرکزی اژدها Pogona vitticeps – توسط کروموزومهای جنسی مشخص میشود، اما این موارد بسیار همراه با تأثیرات درجه حرارت قابل تحمل اما شدید نیز میباشد. همچنین، آزمایشهای انجام شده در دمای محوری، که دما در تأثیر آن دو برابر است، نشانگر یک زمینه مستعد ژنتیکی بودن یک جنس یا جنس دیگر است.
مثالها
تعیین جنسیت وابسته به دما برای اولین بار در آگاما آگاما در سال ۱۹۶۶ توسط Madeleine Charnier[14]
یک مطالعه ۲۰۱۵ نشان داد که دمای گرم بیان کروموزومهای جنسی در مارمولک اژدهای ریش استرالیا را تغییر دادهاست. با وجود داشتن کروموزوم ZZ که معمولاً با مارمولکهای نر همراه بود، مارمولکها از نظر ظاهری زن بودند و قادر به تولد فرزندان بودند.[15]
در سال ۲۰۱۸، تیمی از محققان چینی و آمریکایی نشان دادند که هیستون H3 لیزین 27 (H3K27) دمتیلاز KDM6B (JMJD3)، اصلاح کننده اپی ژنتیک، «به پروموتر ژن غالب مردانه [DMRT1] وصل میشود تا رشد نر را فعال کند» لاک پشتهای کشویی. ضرب و شتم بیان این اصلاحگر در دمای ۲۶ درجه سانتیگراد «باعث واژگونی جنسی مرد و زن» در بیشتر جنینهای باقی مانده میشود.
هورمونها در سیستمهای TSD
هم افزایی بین دما و هورمونها نیز در این سیستمها مشخص شدهاست. تجویز استرادیول در دماهای تولیدکننده مرد، زنانی را تولید میکند که از نظر فیزیولوژیکی با زنان تولید دما یکسان هستند.[16] آزمایش معکوس، نرهایی که در دماهای ماده تولید میشوند، تنها هنگامی انجام میشود که یک تستوسترون غیرقابل جابجایی یا یک مهار کننده آروماتاز اجرا شود، نشان میدهد که آنزیم مسئول تبدیل تستوسترون به استرادیول، آروماتاز، در رشد زنان نقش دارد.[17] با این حال، مکانیزم برای TSD هنوز نسبتاً ناشناخته است، اما در برخی از راه، TSD شبیه ژنتیکی تعیین جنسیت (GSD)، به ویژه در رابطه با اثرهای آروماتاز در هر فرایند.[18] در برخی از گونههای ماهی، آروماتاز در هر دو تخمدان ارگانیسمهای زنانی که تحت TSD قرار گرفتهاند و افرادی که تحت GSD قرار گرفتهاند، است که حداقل ۸۵٪ از توالیهای کدگذاری هر آروماتاز یکسان نیستند،[19] که نشان میدهد آروماتاز نیست. منحصر به فرد برای TSD است و نشان میدهد علاوه بر آن باید عامل دیگری نیز داشته باشد که بر TSD نیز تأثیر دارد.
هورمونها و دما علائم عمل در همان مسیر را نشان میدهند، به این دلیل که هورمون کمتری برای ایجاد تغییر جنسی لازم است زیرا شرایط جوجه کشی در نزدیکی دمای محوری است. این پیشنهاد شدهاست[20] که درجه حرارت در ژن کد کننده چنین اعمال آنزیم استروئیدساز، و آزمایش همولوگ GSD مسیر یک نقطه شروع genic فراهم کردهاست.[21] با این وجود، مسیر تعیین جنسیت ژنتیکی در لاک پشتهای TSD به خوبی درک نشدهاست و مکانیسم کنترل تعهد زن یا مرد مشخص نشدهاست.[22]
در حالی که مشاهده شدهاست که هورمونهای جنسی تحت تأثیر دما قرار میگیرند، بنابراین به طور بالقوه فنوتیپهای جنسی را تغییر میدهند، ژنهای خاص در مسیر تمایز غدد جنسی درجه حرارت را تحت تأثیر قرار میدهند.[23] در بعضی از گونهها، چنین ژنهای تعیین کننده جنسی مانند DMRT1[24] و کسانی که در مسیر Wnt سیگنالینگ درگیر هستند به طور بالقوه میتوانند به عنوان ژنهایی که مکانیسم (بازکردن در برای نیروهای انتخابی) برای تکاملی دخیل دارند، دخیل باشند. توسعه TSD. در حالی که آروماتاز در فرایندهای بیشتری بیش از TSD دخیل است، نشان داده شدهاست که در تکامل تومورهای خاص نیز نقش دارد.[25]
اهمیت تطبیقی TSD در حال حاضر به خوبی درک نشدهاست. یک توضیح احتمالی مبنی بر اینکه TSD در آمنیوتها متداول است، عدم تحرک فیلوژنتیک است - TSD شرایط اجدادی در این کلاد است و به سادگی در دودمانهای موجود حفظ میشود زیرا در حال حاضر تطبیقی بیطرف یا تقریباً همین است.[26] در واقع، تجزیه و تحلیل مقایسه ای فیلوژنتیک اخیر حاکی از منشأ واحدی برای TSD در اکثر آمنیوتها در حدود ۳۰۰ میلیون سال است، با تکامل دوباره TSD در جوخهها[27] و لاک پشتها[28] پس از آنکه GSD را به طور مستقل توسعه داده بودند. در نتیجه، اهمیت تطبیقی TSD در کلیه اما تازهترین منبع TSD ممکن است در اثر گذشت زمان عمیق پنهان باشد، به طور بالقوه TSD ممکن است در بسیاری از کلادهای آمنیوتیک صرفاً به دلیل این که «به اندازه کافی خوب» کار میکند، حفظ شود. هزینه در امتداد توضیحات اینرسی فیلوژنتیک).
سایر مراکز کاری روی یک مدل نظری سال ۱۹۷۷ (مدل چارنوف - بول) پیشبینی کردند که انتخاب باید TSD را نسبت به سیستمهای مبتنی بر کروموزوم ترجیح دهد، هنگامی که «محیط رشد متفاوت از مردان در مقابل تناسب اندام زن تأثیر میگذارد». این مدل نظری سی سال بعد از نظر تجربی مورد تأیید قرار گرفت، اما کلی بودن این فرضیه در خزندگان زیر سؤال میرود. این فرضیه با تداوم TSD در جمعیتهای خاصی از پوست پوسته خال خال (Niveoscincus ocellatus)، یک مارمولک کوچک در تاسمانی، که در آنجا فایده دارد ابتدای زن در اوایل فصل پشتیبانی میشود، پشتیبانی میشود. گرما در اوایل فصل، مادران متولد زن را تضمین میکند که در این صورت زمان بیشتری برای رشد و رسیدن به بلوغ و احتمالاً تولید مثل قبل از تجربه اولین زمستان خود دارند و بدین ترتیب تناسب اندام فرد افزایش مییابد.
در حمایت از فرضیه چارنوف و بول، وارنر و شاین (۲۰۰۸) با اطمینان نشان دادند که دمای جوجه کشی بر موفقیت تولید مثلی مردان متفاوت از زنان در مارمولکهای جکی اژدها (Amphibolurus muricatus) با درمان تخم مرغها با مواد شیمیایی که در بیوسنتز هورمون استروئید دخالت دارند تأثیر میگذارد. این مواد شیمیایی تبدیل تستوسترون به استرادیول را در حین توسعه مسدود میکنند، بنابراین هر فرزندی جنسی در تمام دماها تولید میشود. آنها دریافتند که دمیدن دمای هوا که به طور طبیعی هر جنسیت را ایجاد میکند، حداکثر تناسب هر جنس را فراهم میکند، که شواهد تجربی قابل توجهی را در حمایت از مدل چارنوف و گاو خزندگان فراهم میکند.[2]
اسپنسر و یانزن (۲۰۱۴) با جوجه کشی لاک پشتهای رنگی (تصویر Chrysemys) در دماهای مختلف و اندازهگیری ویژگیهای مختلفی که نشان دهنده تناسب اندام است، از مدل Charnov-Bull پشتیبانی بیشتری پیدا کردند. لاک پشتها در دماهایی که جنس مذکر و جنس و فقط ماده تولید میکنند، جوجه کشی شدند. اسپنسر و یانزن (۲۰۱۴) دریافتند که جوجه کشی از لانههای جنس مختلط، از نظر انرژی کمتری بوده و نسبت به همتایان همجنس خود که در دمای تولید جنس انکوبه شدهاند، رشد کمتری دارند. جوجههای گوشتی از دمای تولید جنس نیز زنده ماندن سال اول بالاتری نسبت به جوجههای گوشتی از دمایی که هر دو جنس تولید میکند، داشتند. TSD ممکن است مفید باشد و برای لاک پشتها انتخاب شود، زیرا راندمان انرژی جنین و اندازه جوجه کشی برای هر جنس در دمای جوجه کشی تک جنسیت بهینه شده و نشان دهنده بقا در سال اول است.[29] این نشان میدهد که انتخاب طبیعی به نفع TSD است، زیرا TSD ممکن است تناسب فرزندان را افزایش دهد.
یک فرضیه جایگزین از اهمیت انطباقی توسط بولمر و بول در سال ۱۹۸۲ ارائه شدهاست[30] و توسط کار قلم و همکاران پشتیبانی شد. (۲۰۱۰) آنها حدس میزنند که انتخاب مختل کننده ناشی از تغییر در محیط میتواند به انتقال تکاملی از ESD به GSD منجر شود (Bull, Vogt, and Bulmer، ۱۹۸۲). قلم و همکاران (۲۰۱۰) به واگرایی تکاملی در SDM از طریق انتخاب طبیعی در نسبتهای جنسی پرداختهاست. با مطالعه پوستی لکه دار، آنها مشاهده کردند که جمعیت کوهستانی تحت تأثیر دما قرار نگرفتهاست، با این حال، یک رابطه منفی بین دمای سالانه و نسبت جنس کوهورت در دشت وجود دارد. ارتفاعات سردتر با بزرگی بیشتر از نوسانهای سالانه دما و یک دوره فعالیت کوتاهتر هستند و بلوغ را به تأخیر میاندازند، بنابراین GSD طرفداری میشود بنابراین نسبتهای جنسی کم رنگ نیست. با این حال، در مناطق دشت، درجه حرارت ثابت تر است و یک فصل فعالیت طولانیتر شرایط TSD را فراهم میکند. آنها نتیجه گرفتند که این تمایز در آب و هوا باعث انتخاب متفاوت در عناصر نظارتی در شبکه تعیین جنسیت میشود که باعث ظهور کروموزومهای جنسی در ارتفاعات میشود.[31]
"تعیین رابطه جنسی دما میتواند به مادر اجازه دهد جنسیت فرزندان خود را با تغییر دمای لانه ای که تخمهایش در آن جوجه کشی میشود تعیین کند.[32]
تأثیر تغییرات آب و هوا
گرم شدن زیستگاه گونههایی که TSD را نشان میدهند، در آغاز بر رفتار آنها تأثیر میگذارد و به زودی ممکن است روی فیزیولوژی آنها تأثیر بگذارد. بسیاری از گونهها (با الگوی IA و II) در اوایل سال و اوایل سال شروع به لانه سازی برای حفظ نسبت جنسی میکنند. سه صفت دمای محوری (دمایی که در آن رابطه جنسی ۵۰٪ است) ، انتخاب محل لانه مادر و فنولوژی لانه سازی به عنوان ویژگی اصلی اصلی TSD شناخته شدهاست که میتواند تغییر کند و از این میان فقط دمای محوری است. به طور قابل توجهی ارثی است، و متأسفانه، این نیاز به افزایش ۲۷ انحراف استاندارد برای جبران افزایش دمای ۴ درجه سانتیگراد دارد. این احتمال وجود دارد که تغییرات آب و هوا (گرم شدن کره زمین) از توانایی بسیاری از حیوانها در سازگاری فراتر رود و بسیاری نیز احتمالاً منقرض میشوند. با این حال، شواهدی وجود دارد که نشان میدهد در طی افراطهای اقلیمی، تغییرات در مکانیسم تعیین جنسیت (به GSD) مخصوصاً در لاک پشتهای بسیار قابل تغییر انتخاب می ش
منابع
- Ido Pen; Tobias Uller; Barbara Feldmeyer; Anna Harts; Geoffrey M. While & Erik Wapstra (2010). "Climate-driven population divergence in sex-determining systems". Nature. 468 (7322): 436–439. doi:10.1038/nature09512. PMID 20981009.
- Warner DA, Shine R (2008). "The adaptive significance of temperature-dependent sex determination in a reptile". Nature. 451 (7178): 566–568. doi:10.1038/nature06519. PMID 18204437.
- Bachtrog, Doris; Mank, Judith E.; Peichel, Catherine L.; Kirkpatrick, Mark; Otto, Sarah P.; Ashman, Tia-Lynn; Hahn, Matthew W.; Kitano, Jun; Mayrose, Itay (2014-07-01). "Sex determination: why so many ways of doing it?". PLOS Biology. 12 (7): e1001899. doi:10.1371/journal.pbio.1001899. ISSN 1545-7885. PMC 4077654. PMID 24983465.
- Tree of Sex Consortium (2014-01-01). "Tree of Sex: a database of sexual systems". Scientific Data. 1: 140015. doi:10.1038/sdata.2014.15. PMC 4322564. PMID 25977773.
- Ospina-Alvarez, Natalia; Piferrer, Francesc (2008-07-30). "Temperature-dependent sex determination in fish revisited: prevalence, a single sex ratio response pattern, and possible effects of climate change". PLoS One. 3 (7): e2837. doi:10.1371/journal.pone.0002837. ISSN 1932-6203. PMC 2481392. PMID 18665231.
- Shen, Zhi-Gang; Wang, Han-Ping (2014-04-15). "Molecular players involved in temperature-dependent sex determination and sex differentiation in Teleost fish". Genetics Selection Evolution. 46: 26. doi:10.1186/1297-9686-46-26. ISSN 1297-9686. PMC 4108122. PMID 24735220.
- Grossen, Christine; Neuenschwander, Samuel; Perrin, Nicolas (2011-01-01). "Temperature-dependent turnovers in sex-determination mechanisms: a quantitative model". Evolution; International Journal of Organic Evolution. 65 (1): 64–78. doi:10.1111/j.1558-5646.2010.01098.x. ISSN 1558-5646. PMID 20722730.
- Piferrer, Francesc (2013-04-01). "Epigenetics of sex determination and gonadogenesis". Developmental Dynamics. 242 (4): 360–370. doi:10.1002/dvdy.23924. ISSN 1097-0177. PMID 23335256.
- Lance, V. A. (2009). "Is regulation of aromatase expression in reptiles the key to understanding temperature-dependent sex determination?". Journal of Experimental Zoology Part A: Ecological Genetics and Physiology. 311A (5): 314–322. doi:10.1002/jez.465. PMID 18668631.
- Shoemaker, C. M.; Crews, D (2009). "Analyzing the coordinated gene network underlying temperature-dependent sex determination in reptiles". Seminars in Cell & Developmental Biology. 20 (3): 293–303. doi:10.1016/j.semcdb.2008.10.010. PMC 2729108. PMID 19022389.
- Bull, J. J. (1980). "Sex determination in reptiles". Quart. Review of Biology. 55 (1): 3–21. doi:10.1086/411613. JSTOR 2826077.
- "Temperature dependent sex determination". Turtles of the World. Archived from the original on 2009-10-08. Retrieved April 16, 2008.
- González, E. J.; Martínez-López, M.; Morales-Garduza, M. A.; García-Morales, R.; Charruau, P.; Gallardo-Cruz, J. A. "The sex determination pattern in crocodilians: a systematic review of three decades of research". Journal of Animal Ecology. 88: 1417–1427. doi:10.1111/1365-2656.13037.
- "Temperature-Dependent Sex Determination in Reptiles | the Embryo Project Encyclopedia".
- NBC (1 July 2015). "Hotter Temperatures Trigger Sex Change in Australian Lizards".
- Wibbels, T.; Bull, J.J.; Crews, D. (1991). "Synergism between temperature and estradiol: A common pathway in turtle sex determination". The Journal of Experimental Zoology. 260 (1): 130–134. doi:10.1002/jez.1402600117. PMID 1791420.
- Crews, D (1996). "Temperature-dependent sex determination: the interplay of steroid hormones and temperature". Zoological Science. 13 (1): 1–13. doi:10.2108/zsj.13.1. PMID 8688803.
- Kohno, S.; Katsu, Y.; Urushitani, H.; Ohta, Y.; Iguchi, T.; Guillette, J. (2010). "Potential contributions of heat shock proteins to temperature-dependent sex determination in the American alligator". Sexual Development. 4 (1–2): 73–87. doi:10.1159/000260374. PMC 2855287. PMID 19940440.
- Duffy, T. A.; Picha, M. E.; Won, E. T.; Borski, R. J.; McElroy, A. E.; Conover, D. O. (2010). "Ontogenesis of gonadal aromatase gene expression in Atlantic silverside (Menidia menidia) populations with genetic and temperature-dependent sex determination". Journal of Experimental Zoology Part A: Ecological Genetics and Physiology. 313A (7): 421–431. doi:10.1002/jez.612. PMID 20623799.
- Crews, D. (2003). "Sex determination: where environment and genetics meet". Evolution and Development. 5 (1): 50–55. doi:10.1046/j.1525-142X.2003.03008.x. PMID 12492409.
- Miller, D.; Summers, J.; Silber, S. (2004). "Environmental versus genetic sex determination: a possible factor in dinosaur extinction?". Fertility and Sterility. 81 (4): 954–964. doi:10.1016/j.fertnstert.2003.09.051. PMID 15066448.
- Georges, A.; Ezaz, T.; Quinn, A. E.; Sarre, S. D. (2010). "Are reptiles predisposed to temperature-dependent sex determination?". Sexual Development. 4 (1–2): 7–15. doi:10.1159/000279441. PMID 20110654.
- Valenzuela, N. (2008). "Evolution of the gene network underlying gonadogenesis in turtles with temperature-dependent and genotypic sex determination". Integrative and Comparative Biology. 48 (4): 476–485. doi:10.1093/icb/icn031. PMID 21669808.
- Graves, J.A.M. (2009). "Weird animal genomes and the evolution of human sex chromosomes". Hormone Research. 72: 15.
- Akinci, H.; Kapucu, A.; Dar, K. A.; Celik, O.; Tutunculer, B.; Sirin, G.; Oz, B.; Gazioglu, N.; Ince, H. (2012). "Aromatase cytochrome P450 enzyme expression in prolactinomas and its relationship to tumor behavior". Pituitary. 16 (3): 386–392. doi:10.1007/s11102-012-0436-2. PMID 22983691.
- Janzen, F. J.; Phillips, P. C. (2006). "Exploring the evolution of environmental sex determination, especially in reptiles". Journal of Evolutionary Biology. 19 (6): 1775–1784. doi:10.1111/j.1420-9101.2006.01138.x. PMID 17040374.
- Janzen & Krenz, 2004
- Valenzuela, Nicole & Dean C. Adams (2011). "Chromosome number and sex determination coevolve in turtles". Evolution. 65 (6): 1808–1813. doi:10.1111/j.1558-5646.2011.01258.x. PMID 21644965.
- Spencer, R. J.; Janzen, F. J. (2014). "A novel hypothesis for the adaptive maintenance of environmental sex determination in a turtle". Proceedings of the Royal Society B. 281 (1789): 20140831. doi:10.1098/rspb.2014.0831. PMC 4100507. PMID 25009063.
- Bull, J.J.; Vogt, R.C.; Bulmer, M.G. (1982). "Heritability of Sex Ratio in Turtles with Environmental Sex Determination". Evolution. 36 (2): 333–341. doi:10.2307/2408052. JSTOR 2408052. PMID 28563174.
- Pen, Ido; Uller, Tobias; Feldmeyer, Barbara; Harts, Anna; While, Geoffrey M.; Wapstra, Erik (Nov 18, 2010). "Climate-driven population divergence in sex-determining systems". Nature. 468 (7322): 436–U262. doi:10.1038/nature09512. PMID 20981009.
- Nelson, Randy. An Introduction to Behavioral Endocrinology. Sinauer Associates: Massachusetts. 2005. pg 136