سزیم کرومات
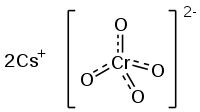
سزیم کرومات یا کرومات سزیم یک ترکیب شیمیایی با فرمول (2 CS) CRO 4 است. این ماده جامد بلوری زرد رنگ است که نمک سزیم کرومیک اسید است و در دستگاه بلوری راستلوزی (ارتورومبیک) متبلور میشود.
| سزیم کرومات | |
|---|---|
 | |
 | |
Dicaesium dioxido(dioxo)chromium | |
دیگر نامها Dicaesium chromate | |
| شناساگرها | |
| شماره ثبت سیایاس | ۱۳۴۵۴-۷۸-۹ |
| پابکم | ۶۱۶۱۳ |
| کماسپایدر | ۵۵۵۲۱ |
| شمارهٔ ئیسی | 236-640-4 |
| جیمول-تصاویر سه بعدی | Image 1 |
SMILES
| |
| |
| خصوصیات | |
| فرمول مولکولی | Cs2CrO4 |
| شکل ظاهری | Yellow crystalline solid |
| چگالی | 4.237 g/cm3 |
| دمای ذوب | ۹۵۴ تا ۹۶۱ درجه سلسیوس (۱٬۷۴۹ تا ۱٬۷۶۲ درجه فارنهایت؛ ۱٬۲۲۷ تا ۱٬۲۳۴ کلوین) |
| انحلالپذیری در آب | 45.50 g/100 g (25 °C) |
| ساختار | |
| ساختار بلوری | orthorhombic |
| گروه فضایی | Pnma (№ 62) |
| ثابت شبکه | a = 8.368 Å, b = 6.226 Å, c = 11.135 Å |
| خطرات | |
| GHS pictograms |     |
| خطرات اصلی | highly toxic, carcinogenic, oxidiser, environmental hazard |
| نقطه اشتعال | |
| ترکیبات مرتبط | |
| دیگر آنیونها | سزیم سولفات |
| دیگر کاتیونها | سدیم کرومات پتاسیم کرومات آمونیوم کرومات |
| به استثنای جایی که اشاره شدهاست در غیر این صورت، دادهها برای مواد به وضعیت استانداردشان داده شدهاند (در 25 °C (۷۷ °F)، ۱۰۰ kPa) | |
| Infobox references | |
|
| |
بیشترین کاربرد آن در گذشته تولید بخار سزیم در هنگام ساخت لامپ خلأ بود.[1] در حال حاضر از این ماده تنها به عنوان پیشماده ترکیبات بهطور دلخواه بهره برده میشود.[2][3]
تولید
سزیم کرومات بیشتر از واکنش کروم تریاکسید با کربنات سزیم به دست میآید و فرآورده دیگر آن دیاکسید کربن است:[2]
- CrO 3 (aq) + Cs 2 CO 3 (aq) s Cs 2 CrO 4 (aq) + CO 2 (g)
این ماده همچنین از راهی درگیر نیز به دست میآید. در آغاز واکنش جانشینی دوگانه میان پتاسیم کرومات و سزیم کلرید روی میدهد:[3]
- K 2 CrO 4 (aq) + 2 CsCl (aq) → Cs 2 CrO 4 (aq) + 2 KCl (aq)
سرانجام سزیم دیکرومات (که خود از راه متاتز نمک از آمونیوم دیکرومات به دست میآید) به دنبال قلیایی سازی با سزیم هیدروکسید سزیم کرومات را تولید میکند:[1]
- Cs 2 Cr 2 O 7 (aq) + 2 CsOH (aq) → 2 Cs 2 CrO 4 (aq) + H 2 O ()
کاربرد
پیشتر از سزیم کرومات در مراحل آخر ایجاد لولههای خلأ استفاده میشد. در آن بخار سزیم با واکنش سزیم کرومات با سیلیسیم، بور یا تیتانیم به عنوان عوامل احیاکننده تولید شد. سپس بخار به لوله افزوده شد تا با گازهای باقیمانده از جمله نیتروژن و اکسیژن واکنش داده و از بین برود.[4]
منابع
- Liebhafsky, H. A.; Winslow, A. F. (1947), "Cesium Chromate Photo‐Tube Pellets", Journal of Applied Physics, Journal of Applied Physics, Vol. 18, No. 12, 18 (12): 1128, Bibcode:1947JAP....18.1128L, doi:10.1063/1.1697594
- Pejov, Ljupčo; Petruševski, Vladimir M (2003-08-01). "Latent symmetry versus accidental degeneracy effects in the vibrational spectra of dopant chromate anions in M2CrxS1−xO4 solid solutions (M∈{K, Rb, Cs})". Journal of Physics and Chemistry of Solids. 64 (8): 1353–1363. doi:10.1016/S0022-3697(03)00160-4. ISSN 0022-3697.
- Bender, Johannes; Wohlfarth, Andreas; Hoch, Constantin (2010-12-01). "Crystal Structures of New Alkali Metal-rich Oxometallates: Rubidium Aluminate Tetrahydroxide, Rb9(AlO4)(OH)4, Rubidium Orthogallate, Rb5GaO4, Cesiumbis-Chromate(IV) Oxide, Cs10(CrO4)2O, and Cesium Diindate, Cs8In2O7". Zeitschrift für Naturforschung B. 65 (12): 1416–1426. doi:10.1515/znb-2010-1202. ISSN 1865-7117.
- Emsley, John (2001), Nature's Building Blocks: An A-Z Guide to the Elements, Oxford University Press, p. 81, ISBN 0-19-850340-7.