تیتانیوم
تیتانیم یک عنصر شیمیایی با نماد Ti و عدد اتمی ۲۲ است. تیتانیم یک فلز واسطه براق نقرهای رنگ است، و چگالی کم و مقاومت بالایی دارد. این فلز به شدت در برابر خوردگی در آب دریا، تیزآب سلطانی و کلر مقاوم است.
 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| تیتانیم | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| تلفظ | /tɪˈteɪniəm, taɪ-/[1] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ظاهر | نقرهy grey-white metallic | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| جرم اتمی استاندارد (Ar، استاندارد) | ۴۷٫۸۶۷(۱)[2] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| تیتانیم در جدول تناوبی | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| عدد اتمی (Z) | 22 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| گروه | گروه ۱۲ | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| دوره | دوره 4 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| بلوک | بلوک-d | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| دسته | Transition metal | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| آرایش الکترونی | [Ar] 3d2 4s2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2, 8, 10, 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ویژگیهای فیزیکی | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| فاز در STP | جامد | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نقطه ذوب | 1941 K (1668 °C, 3034 °F) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نقطه جوش | 3560 K (3287 °C, 5949 °F) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| چگالی (near r.t.) | 4.506 g/cm3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| در حالت مایع (at m.p.) | 4.11 g/cm3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| حرارت همجوشی | 14.15 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| آنتالپی تبخیر | 425 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ظرفیت حرارتی مولی | 25.060 J/(mol·K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
فشار بخار
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ویژگیهای اتمی | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| عدد اکسایش | −2, −1, 0,[3] +1, +2, +3, +4[4] (an amphoteric اکسید) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الکترونگاتیوی | مقیاس پائولینگ: 1.54 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| انرژی یونش |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| شعاع اتمی | empirical: 147 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| شعاع کووالانسی | pm 160±8 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Color lines in a spectral range | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| دیگر ویژگی ها | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ساختار بلوری | دستگاه بلوری ششگوشه | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| سرعت صوت thin rod | 5,090 m/s (at r.t.) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| انبساط حرارتی | 8.6 µm/(m·K) (at 25 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| رسانندگی گرمایی | 21.9 W/(m·K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| رسانش الکتریکی | 420 n Ω·m (at 20 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| رسانش مغناطیسی | پارامغناطیس | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| مدول یانگ | 116 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| مدول برشی | 44 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| مدول حجمی | 110 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نسبت پواسون | 0.32 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| سختی موس | 6.0 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| سختی ویکرز | 970 MPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| سختی برینل | 716 MPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| شماره ثبت سیایاس | 7440-32-6 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ایزوتوپهای تیتانیم | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
تیتانیم نخستین بار در کورنوال بریتانیا از سوی ویلیام گرگور در سال ۱۷۹۱ شناسایی شد؛[5] نام این عنصر از سوی مارتین هاینریش کلاپروت از روی تیتان از اساطیر یونان انتخاب شد. این عنصر در بسیاری کانیها به ویژه روتیل و ایلمنیت وجود دارد. این کانیها در پوستهٔ زمین و سنگ کره پراکندهاند؛ علاوه بر این تیتانیم تقریباً در همهٔ موجودات زنده، سنگها، آب بدن و خاکها حضور دارد.[6] با کمک هر دو فرایند کرال[7] و فرایند هانتر میتوان تیتانیم را از سنگ معدنش بدست آورد. فراوانترین ترکیب تیتانیم، دیاکسید تیتانیم است که یک فوتوکاتالیست معروف است و از آن در تولید رنگدانههای سفید استفاده میشود.[8] از دیگر ترکیبات تیانیم میتوان به تتراکلرید تیتانیم یا (TiCl۴ ) اشاره کرد که از آن در تولید مواد دودزا و فروکافت بهره برده میشود. همچنین کلرید تیتانیم (III) یا (TiCl۳) هم به عنوان فروکافت در تولید پلیپروپیلن مورد استفاده قرار میگیرد.[6]
میتوان تیتانیم را با آهن، آلومینیم، وانادیم و مولیبدن، آلیاژ کرد تا مادهای سختتر و سبکتر بدست آورد که در ساخت سامانههای هوایی مانند موتور جت، موشک و فضاپیما، کاربردهای نظامی و فرایندهای صنعتی (شیمیایی و شیمیایی-نفتی، کارخانههای نمکزدایی، کاغذ و …) خودروسازی، کشاورزی و ساخت اندامهای مصنوعی، درونکاشتهای استخوانی، ابزارهای دندان پزشکی و ریشه درمانی، برسازی درونکاشت دندانی، کالاهای ورزشی، گوهرسازی، گوشی همراه و … بکار برده شود.[6]
مهمترین ویژگیهای این فلز عبارتند از: مقاومت در برابر خوردگی و داشتن بالاترین نسبت مقاومت به چگالی در برابر دیگر عناصر فلزی.[9] تیتانیم در هنگامی که هنوز با فلز دیگری آلیاژ نشده، مقاومتی برابر با فولاد و چگالی کمتر از آن دارد.[10] دو دگرشکلی[11] و پنج ایزوتوپ طبیعی از ۴۶Ti تا ۵۰Ti برای این عنصر وجود دارد که ۴۸Ti با فراوانی طبیعی ۷۳٫۸٪ از سایرین فراوانتر است.[12] با اینکه تیتانیم و زیرکونیم تعداد الکترونهای ظرفیت برابر دارند و در یک گروه جدول تناوبی قرار دارند با این حال در بسیاری ویژگیهای شیمیایی و فیزیکی متفاوتاند.
کاربرد
_oxide.jpg.webp)
عمده مصرف تیتانیوم در صنایع به دو صورت فلزی و دیاکسید تیتانیوم میباشد. مصرف فلز آن به دلیل مشکلات تهیه و خالصسازی آن مصرف چندانی ندارد، اما در عوض مصرف اکسید آن به صورت TiO2 در صنعت کاربرد بسیار گستردهای دارد؛ بهطوریکه ۹۰ درصد از صنایع اولیه، مصرفکننده اکسید تیتانیوم میباشند.
امروزه فلز تیتانیوم به عنوان یک فلز استراتژیک در موتور و ساختمان داخلی هواپیما، تجهیزات حمل و نقل، صنایع شیمیایی، واحدهای مولد برق، صنایع آلیاژی، ساخت زیر دریاییها، کارخانههای ساخت مواد شیمیایی، دستگاههای خنککننده نیروگاههای اتمی و حرارتی و دهها مورد دیگر کاربرد دارد.
مصرف عمده دیاکسید تیتانیوم در صنایع رنگسازی به عنوان رنگدانه میباشد و همچنین این ماده در صنایع سرامیک، پلاستیک، کاغذ و الکترونیک کاربرد دارد. مصرف این ماده در کشورهای پیشرفته تقریباً ۱۰ برابر کشورهای در حال توسعه میباشد.
فلز تیتانیوم در محیطهای فرسایشی بسیار مقاوم میباشد. تیتانیوم خالص یا آلیاژهای آن با ناخالصی کم در کارخانههای سولفور زدایی مشتقات نفتی، در تجهیزات مربوط به چاههای نفت و در اتصالات مورد نیاز و همچنین در موارد پزشکی مورد استفاده قرار میگیرد. از طرفی ورقهای فولادی با پوشش تیتانیوم هماکنون در جهان تولید شده که بعلت خاصیت ضد فرسایشی کاربرد وسیعی در صنعت نفت و در مراحل سولفور زدایی مشتقات نفتی در پالایشگاهها پیدا کردهاند. دیگر مصرف عمده این فلز در صنعت هواپیماسازی است.
سایر مصارف عمده تیتانیوم را میتوان به صورت زیر خلاصه نمود:
_mit_sichtbarer_Kristallstruktur.jpg.webp)
ساخت کاربید تیتانیم، سرامیک، فرایند شیمیایی و الکتروشیمیایی، ساخت ورقههای فلزی و بازیافت آنها، صنعت نفت، سولفور زدایی گاز مایع، نمک زدایی آب (تصفیه آب)، ساخت پمپهای مخصوص مکش آب از دریا، ساختمان سازی، پزشکی (قطعات تعویضی در بدن، دندانها)، صنایع اتومبیل سازی، ساخت انبارههای مخصوص، جهت نگهداری از موادی نظیر ضایعات اتمی و غیره، الیاف تقویتکننده جهت استفاده در ترکیبات فلزی، رباتهای صنعتی، جواهر سازی، ساخت انواع آلیاژها، ذخیرهسازی انرژی، بالا بردن قابلیت هدایت حرارتی آلیاژها، پرکننده، سنگهای جواهرات مصنوعی و نرمافزار.
ایلمنیت و اکسیدهای تیتانیم برای تهیه تیتانیم در آلیاژهای مهم و راهبردی استفاده میگردد. آلیاژهای تیتانیم در بدنه هواپیماهای جنگی، سفینههای فضایی، موشکها، موتور هواپیماها، ادوات رزمی، توربینهای گازی، دوچرخه و لپ تاپ مورد استفاده قرار میگیرند. تیتانیوم اغلب با آلومینیوم، آهن، منگنز، مولیبدن و فلزات دیگر تشکیل آلیاژ میدهد.
ایلمنیت همچنین در تهیه اکسید تیتانیم که در صنایع رنگ سازی، کاغذسازی و پلاستیک به عنوان ماده رنگی، براق کردن سطح فلزات، لعاب، لاستیک سازی، شیشه، فایبرگلاس، سرامیک، الکتروسرامیک و . . . مصرف میشود، کاربرد دارد.
تنها در حدود ۵٪ تولید سالانه جهانی تیتانیوم صرف تولید فلز تیتانیوم شده و ۹۵٪ باقیمانده در تولید ماده رنگ دیاکسید تیتانیوم مورد استفاده قرار میگیرد. این ماده دارای دو شکل آلوتروپی روتیل و آناتاز است که به واسطه رنگ سفید، ضریب شکست بالا (۴۹/۲–۹۰/۲)، درخشندگی عالی، بیاثر (خنثی بودن) و مقاومت سایشی و حرارتی بالای آن، درجه دیرگدازی بالا و توان زیاد در توزیع و انتشار یکنواخت در ترکیبات دیگر به عنوان عمدهترین ماده اولیه رنگ سفید در صنایع رنگ سازی، کاغذسازی، پلاستیک، لاستیک و … شناخته میشود.
مصارف دارویی

پودر تیتانیم دیاکسید (روتیل) که از آن پراکسید تیتان، تیتانیم سالسیلات و تیتانیم تانات تهیه میکنند، عملی همانند اکسید روی بر روی پوست بدن ایجاد میکند.
تیتانیم دیاکسید برای التیام سوزشهای پوستی مورد استفاده قرار میگیرد و منعکسکننده اشعه ماوراء بنفش خورشید است و بدین جهت در ساختن کرمها و لوسیونهای ضدآفتاب (ضد سوختگی) استفاده میشود.
از پودر تیتانیم دیاکسید در ساخت قاب کپسولهای دارویی و پوشش قرصها نیز استفاده میشود.
مصارف آرایشی
تیتانیم دیاکسید در ساخت وسایل آرایشی به کار میرود.
مصرف سالیانه عنصر تیتانیوم و ترکیبات آن، ۱۰۵ تا ۱۰۶ تن میباشد. تقریباً ۹۵٪ تیتانیم به فرم اکسید تیتانیم TiO4 مصرف میشود و یک رنگدانه دایمی و به شدت سفید رنگ با قدرت پوششی خوب در رنگها، کاغذ و پلاستیک است.
رنگها با وجود اکسید تیتانیوم یک بازتابنده بسیار عالی اشعه مادون قرمز را میسازد و بنابراین بهطور گستردهای توسط اختر شناسان مورد استفاده قرار میگیرد. از آنجایی که این فلز مقاومت بالا، وزن سبک، مقاومت غیرعادی در برابر خوردگی و توانایی ایستادگی در برابر دماهای بسیار بالا میباشد.
بخاطر مقاومت بالا در آب دریا، این فلز برای ساخت شفتها (محور)، ملخ هواپیما و پروانه کشتی استفاده میشود.
تیتانیم دیاکسید
تیتانیم دیاکسید در تهیه الیاف مصنوعی نیز استفاده میشود. پودر تیتانیم دیاکسید خالص به عنوان رنگدانه در فراوردههای غذایی کاربرد دارد.
دیاکسید تیتانیوم در کرمهای (لوسیونها) ضدآفتاب استفاده میشود که ناشی از توانایی آن در حفاظت پوست میباشد.
دیاکسید تیتانیوم یک رنگدانه برتر سفید رنگ با ضریب شکست ۵۵/۲–۸/۲ است، مقاومت، درخشندگی، پایداری شیمیایی و مقاومت در برابر اشعهٔ ماورای بنفش، غیرسمی بودن و پایداری در یک محدودهای دمایی وسیع و قیمت مناسب آن سبب شده تا از آن در کاغذ، رنگ، پلاستیک، لاستیک، سرامیک، پارچه و مواد آرایشی استفاده شود. دو نوع رنگدانه روتیل وجود دارد روتیل و آناتاز. روتیل از شبکهٔ بلوری متراکمتری نسبت به آناتاز تشکیل شده و چگالتر است و ضریب شکست بالاتری دارد.
رنگدانه میبایست قابل استفاده در مسیر سولفاته باشد (روتیل یا روتیل مصنوعی قابل استفاده نیستند) و دارای نسبت FeO/Fe2O3 بالاتری بوده (در اسید سولفوریک واکنشپذیر) و آهن، کروم، وانادیوم، نیوبیوم، کلسیم، فسفات، اورانیوم، توریم و رنیم کم داشته باشد. خواص فیزیکی تقریباً مهم نیستند.
تتراکلرین تیتانیوم
تتراکلرین تیتانیوم (TiCl4) یک مایع بیرنگ است که برای ساخت شیشه استفاده میشود و از آن جایی که آن در هوای مرطوب به شدت بخار میکند، به منظور پوشش در برابر بخار استفاده میشود.
ایلمنیت، روتیل، آناتاز، روتیل مصنوعی و سربارهٔ تیتانیوم به عنوان پیشماده تولید رنگدانه دیاکسید تیتانیوم از دو مسیر سولفاته و کلریدی امکانپذیر بوده که هریک نیاز به پیشماده مخصوص به خود دارند.
انواعی که در مسیر کلریدی به عنوان پیشماده استفاده میشوند باید آلکالی کم، کمتر از 2% CaO و کمتر از 1% MgO، داشته باشد. به علاوه آهن کم، کمتر از 5/0% Cr2O3، V2O3، قلع و آرسنیک، کمتر از ۲٪ سیلیس و حداقل اورانیوم، توریم و رادیم و … داشته باشد (هر یک از موارد فوق به دلایلی از قبیل سمی بودن، رنگزایی، خواص مزاحم در حین فرآوری و … میبایست در رنگدانه وجود نداشته باشند). شرایط مورد نیاز دیگر شامل چگالی، مقاومت ذرات و … است. با توجه به شرایط فوق، روتیل طبیعی با ۹۵٪ TiO۲، لازم است که به دلیل کمبود چنین ذخایری ایجاد طرحهای پرعیار کردن پیشماده صورت میگیرد.
کنسانتره ایلمنیت برای فرآوری سرباره میبایست حداقل 35% TiO2، داشته باشد، انواع سنگ سختهای ایلمنیت به سربارههای سولفاته محدود میشوند، فرایندهای شستشوی زیرزمینی CaO, MgO و دیگر ناخالصیها را کاهش داده و سربارههایی با قابلیت قرارگیری در مسیر کلریدی ایجاد کند که معمولاً از پلاسرهای ایلمنیت به دست میآیند (TiO2 57-63%)...[13]
تیتانات باریم
مادهٔ فروالکتریک با ثابت دیالکتریک نسبتاً بالا در نیمههادیها و پیزوالکتریکها به کار برده میشود.
نیترید تیتانیوم
دمای ذوب ۲۹۵۰ درجه سانتیگراد دارد و از آن به عنوان بوته ذوب آلیاژهای لانتانیوم، رنگ زرد طلایی در جواهرات و … به کار میرود.
آلکالیهای تیتانیوم
تیتانات استرانسیم
جواهر مصنوعی، ابزار نوری
اکستروژن تیتانیوم
فرایند شکلدهی تیتانیوم در اواسط دهه ۵۰ میلادی برای هواپیماها آغاز شد. تولید اشکال مشخص با قالب تخت و در مقیاس کوچک برای تیتانیوم به استفاده از اکستروژن داغ منجر شد.
تیتانیم خالص و آلیاژهای آن از مقاومت به خوردگی و استحکام بالایی برخوردار است و به همین دلیل در اعضای ساختاری هواپیما و کاربردهایی که ضریب اطمینان بالا لازم است به کار میرود. این گونه قطعات بعضاً در شکلهای پیچیده مورد استفاده قرار میگیرند که منجر به استفاده از فرایند شکلدهی اکستروژن (داغ) میشود. این فرایند به سادگی میتواند اجزای ساختاری را با مقاطع مختلف شکلدهی کند.[14]
برای فرایند شکلدهی اکستروژن تیتانیوم میتوان به انتخاب نوع فرایند اکستروژن (نوع قالب و دمای فرایند) و نوع و فاز تیتانیوم توجه داشت.
در بیشتر فرایندهای اکستروژن (آلیاژهای) تیتانیوم دستگاه پرس از نیروی هیدرولیک آب بهره میگیرد که نسبتاً نرخ کرنش بالایی دارد. با توجه به تجارب این کار، برای اکستروژن تیتانیوم در فاز بتا از قالب تخت استفاده میشود به دلایلی از قبیل: ارزانتر بودن، بهرهگیری از اشکال پیچیده و کنترل اندازه بهتر. از دیگر ویژگیهای فرایند اکستروژن تیتانیوم-بتا قالب تخت میتوان به اصطکاک بالای آن اشاره کرد و اینکه نرخ کرنش بالا سبب افزایش تنش در جریان ماده میشود.
یکی از کاربردیترین آلیاژهای تیتانیوم برای استفاده شدن در فرایند اکستروژن، Ti-6Al-4V (گرید ۵ آلیاژ تیتانیوم) است. برای فرایند اکستروژن این آلیاژ آلفا-بتا، اکستروژن داغ قالب مخروطی استفاده شدهاست.[15]
شرح فرایند
ابتدا به لقمه تیتانیومیِ آماده شده (میتواند خروجیِ فرایند فورج باشد) حرارت داده میشود. در حین عملیات حرارتدهی و جابهجایی برای فرایند اکستروژن لایهای اکسیدی در فاز آلفا بر روی سطح لقمه تشکیل میشود که برای فرایند اصلاً مطلوب نیست؛ لذا با غوطهور کردن لقمه درست قبل از فرایند اکستروژن در موادی حاوی شیشه، لایهٔ نامطلوب زدوده شده و لایهای از جنس شیشه به آن اضافه میشود.[16]
این کار به دلیل آن است که قابلیت شکلپذیری و ماشینکاری بر روی تیتانیوم افزایش یابد و نیز برای اینکه شیشه در طول فرایند نقش روانکننده را بازی کند.
دمای فرایند بین ۸۰۰ و ۱۱۵۰ درجه سلسیوس است. چنانچه دمای فرایند بیش از ۱۰۰۰ درجه سلسیوس باشد پوشش شیشهای لازم میشود چنانکه برای اکستروژن تیتانیوم Ti-6Al-4V، فرایند در دمایی حدود ۱۱۵۰ درجه سلسیوس (۲۱۰۰ درجه فارنهایت) با پوشش شیشه انجام میگیرد. اگر دما بیش از حد نیاز باشد بروز عیوب و ترک در سطح لقمه پیش میآید و چنانچه دما کمتر از حد لازم باشد امکان عدم عبور یا عبور صحیح از دهانه قالب وجود دارد.
برای هرچه بهتر انجام شدن فرایند، از اکستروژن تک قالبه و تک لقمه استفاده میشود. در این صورت هم کیفیت سطح ارتقا مییابد و هم تغییر شکلِ قطعه به قطعه کاهش مییابد.[17][18]
غالباً این فرایند با سرعت بالا بین ۱٫۵ و ۵ ثانیه صورت میپذیرد. فشار لازم برای فرایند نیز تا حدود ۲۰۰۰ تن است. برای زدودن لایه شیشهای پس از فرایند در صورت نیاز از عملیات سابپاشی استفاده میشود که البته کیفیت سطح را نیز بهبود میبخشد.[19]
مزایا
با توجه به کاربردهای وسیع در صنایع هوافضا، یکی از مزیتهای آن کاهش وزن هواپیماها در حدود ۱٫۸ تن (۴۰۰۰ پوند) بودهاست.
مزیت عمده این فرایند برای تیتانیوم با توجه به کاربردها، کاهش زمان تولید قطعه در حدود ۱ ساعت است. بدون فرایند اکستروژن تیتانیوم تمام عملیات شکلدهی بر عهده فرایند ماشینکاری است در حالی که با استفاده از فرایند اکستروژن زمان تولید قطعه بهینهتر میشود.
کاربرد
با توجه به مقاومت به خوردگی بالای تیتانیوم و نوع فرایند اکستروژن، خروجی این فرایند برای صندلی هواپیما (ریل جابهجایی)
و با توجه به استحکام قابل قبول آن، برای نگهدارنده موتور هواپیما (تیر اتصالدهنده بین موتور و بال هواپیما) مورد استفاده قرار میگیرد.
ماشینکاری آلیاژهای تیتانیوم
ماشینکاری آلیاژهای تیتانیوم به دلیل استحکام در دمای بالای آن، هدایت حرارتی بسیار پایین، مدول الاستیسیته نسبتاً کم و واکنشپذیری شیمیایی بالا بسیار دشوار است. مشکلات اصلی در ماشین کاری این آلیاژها که ناشی از خواص ذاتی ماده است، عبارتند از:
- دمای برش بالا: بخش بزرگی (حدود ۸۰ درصد) از حرارت تولید شده هنگام ماشینکاری آلیاژ Ti6Al4V (متداولترین آلیاژ تیتانیوم) به ابزار انتقال مییابد. هدایت حرارتی کم آلیاژهای تیتانیوم (۱/۶ فولاد) سبب آن میشود که حرارت نتواند توسط جریان سریع براده و قطعه کار دفع نشود.[20] بررسی توزیع درجه حرارت در ماشین کاری آلیاژهای تیتانیوم نشان دادهاست که منطقه متأثر از حرارت در این آلیاژ به خاطر تشکیل برادههای نازکتر (و در نتیجه سطح تماس کمتر ابزار و براده) بسیار کوچکتر است، طوریکه دمای نوک ابزار به ۱۱۰۰ درجه سانتیگراد میرسد.[21]
- فشارهای برش بالا: اگرچه نیروهای برشی و توان مصرفی در حین ماشینکاری آلیاژهای تیتانیوم با فولادها یکسان یا حتی کمتر است، به دلیل سطح تماس کمتر براده و ابزار (۱/۳ فولاد) و تا حدودی مقاومت آلیاژ تیتانیوم در برابر تغییر شکل (تا ۸۰۰ درجه سانتیگراد)[22] تنشهای مکانیکی در مجاورت لبه ابزار بسیار بالاتر است.

- چتر: پدیده چتر به عنوان یکی دیگر از مشکلات اصلی ماشینکاری آلیاژهای تیتانیوم به خصوص در حالت پرداخت مطرح است. مدول الاستیسیته پایین آلیاژهای تیتانیوم علت اصلی چتر در حین ماشینکاری میباشد. هنگامی که آلیاژ در معرض فشار برش قرار میگیرد تا دو برابر فولاد کربنی تغییر شکل مییابد و یک حالت برگشت فنری قوی پشت لبه برشی به وجود میآید که به سایش زودرس ابزار، ارتعاش و دمای برش بالاتر میانجامد.[23] این ارتعاش ایجاد شده به صورت حرکت منقطع یا پرشی ابزار در ورود به منطقه برش ظاهر میشود که به نوعی تعریف پدیده چتر است.[24]
- جنس ماده ابزار: تیتانیوم و آلیاژهایش تقریباً با مواد تشکیل دهنده تمام ابزارهای متداول در دمای بالای ۵۰۰ درجه سانتیگراد واکنش شیمیایی میدهد. علاوه براین، تمایل برادهها به جوش خوردگی در اثر فشار به ابزار و ایجاد سایش اصطلاحاً چسبنده (که در اثر نفوذ ماده براده به سطح ابزار حاصل میشود)، ضرورت انتخاب ابزار مناسب برای ماشینکاری آلیاژهای تیتانیوم را دوچندان کردهاست.
معیارهای انتخاب ابزار
ماده ابزار در ماشینکاری آلیاژهای تیتانیوم باید ویژگیهای زیر را داشته باشد:
- سختی در دمای بالا
- هدایت حرارتی بالا
- عدم واکنشپذیری شیمیایی با تیتانیوم
- چقرمگی و استحکام خستگی بالا
- استحکام کششی، فشاری و برشی بالا
ابزارهای تنگستن کارباید و PCD به عنوان بهترین گزینهها مطرح هستند.[25]

یکپارچگی سطح
سطح آلیاژهای تیتانیوم به شدت در روشهای ماشینکاری سنتی آسیبپذیر است. آسیبها به شکل میکروترک، لبه انباشته (BUE)، تغییر شکل پلاستیک، مناطق متأثر از حرارت (HAZ) و تنشهای پسماند کششی ظاهر میشوند. حد دوام تیتانیوم برای فرایند سنگ زنی نرم ۳۷۲ مگاپاسکال است، در حالی که در یک فرایند تراشکاری یا فرزکاری به کمتر از یک چهارم یعنی ۸۳ مگاپاسکال میرسد. برتری فرایند سنگ زنی در این زمینه احتمالاً به دلیل ایجاد تنشهای پسماند فشاری (بهبود استحکام خستگی) میباشد. در فرایندهای سنگزنی نرم تغییرات محسوسی در سطح ایجاد نمیشود.[26]
روشهای غیرسنتی ماشینکاری آلیاژهای تیتانیوم
- ECM یا ماشینکاری الکتروشیمیایی: براده برداری مواد رسانای الکتریکی از طریق انحلال آندی در یک الکترولیت با جریان سریع تعریف کوتاهی از این فرایند است. ECM قابلیت ایجاد کانتورهای پیچیده و بدون اعوجاج و همینطور سطوح با کیفیت را داراست. سدیم کلرید به عنوان الکترولیت متداول برای آلیاژهای تیتانیوم استفاده میشود.
- LBT یا ماشینکاری به کمک پرتو لیزر : در این فرایند با تمرکز پرتو لیزر و جریان گاز روی قطعه کار، براده برداری صورت میگیرد. انرژی لیزر سبب ذوب موضعی شده و جریان گاز اکسیژن با ایجاد یک واکنش گرمازا، ماده ذوب شده را از قطعه کار جدا میکند. آلیاژهای تیتانیوم در این روش با نرخ بالایی برادهبرداری میشوند. لیزر مورد استفاده از نوع CO2 است.
- CHM یا فرزکاری شیمیایی: انحلال کنترل شده ماده قطعه کار در اثر تماس با یک ماده شیمیایی قوی را CHM گویند. در این روش جاهایی از قطعه کار که قرار نیست ماشینکاری شوند، با یک ماسک مقاوم شیمیایی حفاظت میشوند.[27]
مایعات برشی
- مایعات برشی پایه آبی (مثلاً محلول رقیق آب و روغن) بهترین گزینه برای سرعتهای برشی بالا میباشند.
- در سرعتهای کم و عملیات پیچیده به منظور به حداقل رساندن اصطکاک و کاهش تمایل به چسبندگی تیتانیوم از روغنهای سولفوریزه و کلریناته استفاده میشود.
- در استفاده از روغنهای کلریناته باید به این نکته توجه کنیم که امکان ایجاد ترک در اثر تنشهای ناشی از خوردگی وجود دارد.[28]
نگارخانه
 بدنه یک دوچرخه که از تیتانیم ساخته شدهاست
بدنه یک دوچرخه که از تیتانیم ساخته شدهاست فریمهای دیواره شیشه ای موزه گوگنهایم بیلبائو که از تیتانیم ساخته شدهاست.
فریمهای دیواره شیشه ای موزه گوگنهایم بیلبائو که از تیتانیم ساخته شدهاست. یک قاشق تیتانیمی که از فولاد سبک تر و از پلاستیک مقاوم تر است و برای کوهنوردان مناسب است.
یک قاشق تیتانیمی که از فولاد سبک تر و از پلاستیک مقاوم تر است و برای کوهنوردان مناسب است.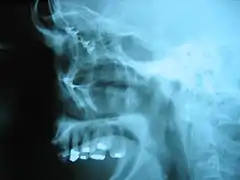 تصاویر اشعه ایکس از جمجمه یک انسان. شکستگی ایجاد شده دور حلقه چشم توسط سوکتها و صفحات تیتانیمی ترمیم شدهاست.
تصاویر اشعه ایکس از جمجمه یک انسان. شکستگی ایجاد شده دور حلقه چشم توسط سوکتها و صفحات تیتانیمی ترمیم شدهاست.
منابع
- "titanium - definition of titanium in English | Oxford Dictionaries". Oxford University Press. 2017. Retrieved 2017-03-28.
- Meija, J.; et al. (2016). "Atomic weights of the elements 2013 (IUPAC Technical Report)". شیمی محض و کاربردی(نشریه). 88 (3): 265–91. doi:10.1515/pac-2015-0305.
- Jilek, Robert E.; Tripepi, Giovanna; Urnezius, Eugenijus; Brennessel, William W.; Young, Victor G. , Jr.; Ellis, John E. (2007). "Zerovalent titanium–sulfur complexes. Novel dithiocarbamato derivatives of Ti(CO)6: [Ti(CO)4(S2CNR2)]−". Chem. Commun. (25): 2639–2641. doi:10.1039/B700808B. PMID 17579764.
- Andersson, N.; et al. (2003). "Emission spectra of TiH and TiD near 938 nm" (PDF). J. Chem. Phys. 118 (8): 10543. Bibcode:2003JChPh.118.3543A. doi:10.1063/1.1539848.
- "William Gregor". Wikipedia. 2020-02-05.
- Lide, D. R., ed. (2005). CRC Handbook of Chemistry and Physics (86th ed.). Boca Raton (FL): CRC Press. ISBN 0-8493-0486-5.
- Krebs, Robert E. (2006). The History and Use of Our Earth's Chemical Elements: A Reference Guide (2nd ed.). Westport, CT: Greenwood Press. ISBN 0-313-33438-2.
- Donachie, Matthew J. , Jr. (1988). TITANIUM: A Technical Guide. Metals Park, OH: ASM International. p. 11. ISBN 0-87170-309-2.
- Barksdale 1968, p. 738
- "Titanium". Columbia Encyclopedia (6th ed.). New York: Columbia University Press. 2000–2006. ISBN 0-7876-5015-3.
- Barbalace, Kenneth L. (2006). "Periodic Table of Elements: Ti – Titanium". Retrieved 26 December 2006.
- J. Krýsa, M. Keppert, and et al, Mat. Chem. and Phys. 86 , (2004) 333. D. H. Marsh, D. J. Riley, and et al, Particuology 7 (2009) 121.
- بایگانیشده در ۲۱ نوامبر ۲۰۱۶ توسط Wayback Machine George Legate, Alpha Beta Extrusion of Titanium Alloys, Nu-Tech Precision Metals
- Kin'ichi Kimura, et al. Analysis of Deformation, Temperature, and Microstructure of Titanium Alloys During Hot Extrusion, 1994
- بایگانیشده در ۲۰ نوامبر ۲۰۱۶ توسط Wayback Machine RTI International Metals, Inc
- TitaniumExposed.com
- Rickard Specialty Metals and Engineering | 2043 Elm Court, Ontario, California 91761
- VertMarkets, Inc
- .W. Konig, Proc. 47th Meeting of AGARD Structural and Materials Panel, Florence, Sept. 1978, AGARD, CP256, London, 1979, pp. 1.1-1.10
- .P.A. Dearnley, A.N. Grearson, Mater. Sci. Technol. 2 (1986) 47-58
- .D.C. Kirk, Tools and dies for industry, Proc. Conf. 7677. Met. Soc. , London, ~ 976- 7, pp. 77- 98
- .B.B. Johnson, Tips on Milling Titanium--and Tools to Do the Job
- .B.F. yon Turkovich, D.R. Durham, Advanced Processing Methods for Titanium 18 (1982) 257-274
- .P.D. Hartung, B.M. Kramer, Ann. CIRP 31 (11 (1982) 75-80
- http://www.supraalloys.com/technical-surface.php
- http://www.supraalloys.com/technical-nontrad.php
- H.E. Chandler, Metals Handbook, 1978, pp. 845-852.
| در ویکیانبار پروندههایی دربارهٔ تیتانیوم موجود است. |