دیاکسید زیرکونیوم
دیاکسید زیرکونیوم (به انگلیسی: Zirconium dioxide) که با نام زیرکونیا نیز شناخته میشود، یک اکسید سفید کریستالی از زیرکونیم است. بادلیت (Baddeleyite) با ساختار کریستالی مونوکلینیک، متداولترین شکل آن در طبیعت است که بسیار نادر است. نوعی زیرکونیای آلایش شده با ساختاری مکعبی با نام زیرکونیای مکعبی (Cubic zirconia) در رنگهای مختلف به صورت مصنوعی تولید میشود که در زیورآلات به عنوان گوهر یا الماس بدلی استفاده میشود.[1]
| Zirconium dioxide | |
|---|---|
 | |
Zirconium dioxide | |
دیگر نامها Zirconia | |
| شناساگرها | |
| شماره ثبت سیایاس | ۱۳۱۴-۲۳-۴ |
| خصوصیات | |
| فرمول مولکولی | ZrO 2 |
| جرم مولی | 123.218 g/mol |
| شکل ظاهری | white powder |
| چگالی | 5.68 g/cm3 |
| دمای ذوب | ۲۷۱۵ °C |
| دمای جوش | ۴۳۰۰ °C |
| انحلالپذیری در آب | negligible |
| انحلالپذیری | soluble in هیدروفلوئوریک اسید، and hot سولفوریک اسید، نیتریک اسید، هیدروکلریک اسید |
| ضریب شکست (nD) | 2.13 |
| ترموشیمی | |
آنتروپی مولار استاندارد S |
50.3 J K-1 mol-1 |
آنتالپی استاندارد تشکیل ΔfH |
–1080 kJ/mol |
| خطرات | |
| MSDS | MSDS |
| شاخص ئییو | Not listed |
| نقطه اشتعال | |
| LD50 | > 8.8 g/kg (oral, rat) |
| ترکیبات مرتبط | |
| دیگر آنیونها | سولفید زیرکونیم(IV) |
| دیگر کاتیونها | تیتانیوم دیاکسید اکسید هافنیم(IV) |
| به استثنای جایی که اشاره شدهاست در غیر این صورت، دادهها برای مواد به وضعیت استانداردشان داده شدهاند (در 25 °C (۷۷ °F)، ۱۰۰ kPa) | |
| | |
| Infobox references | |
|
| |
منابع زیرکونیا
عنصر زیرکونیوم از نظر خواص شیمیایی بسیار مشابه عنصر هافنیوم است. طبیعت زیرکونیوم و شعاع یونی اش وظرفیتهایش نشان میدهد که همیشه به عنوان یک ترکیب یافت میشود. یک ترکیب مشابه با زیرکونیوم حدود ۲٪ از کل وزن را تشکیل میدهد.
همانطور که دو فلز بسیار شبیه بهم هستند یافتن اختلاف بین آنها نیز مشکل است اما برای همه کاربردها بعلاوه در راکتورهای هسته ای هافنیوم قابل قبول است. پیش از این، بغیر از زمانی که بهطور خاص اعلام شد، تمام ترکیبات زیرکونیوم شامل حدود ۲درصد وزنی ترکیب متفاوتی از هافنیوم است بنابراین زیرکونیا شامل حدود ۲٪ هافنیوم ذکر شدهاست به عنوان مثال ۹۸٪ زیرکونیا دقیقاً شامل ۹۶٪ زیرکونیا بعلاوه ۲٪ هافنیوم است. زیرکونیا در طبیعت به عنوان مینرال بادلیت یافت میشود. ازسال ۱۹۷۰ تاکنون از مجتمع معدن Phalaborwa در آفریقای جنوبی استخراج شدهاست. در مقادیر کم گاهی اوقات از ایالات سائوپائولو (Sao Paolo)و میناس گرایسی (Mina Graisi)در برزیل بدست آمدهاست. تولید تجاری همچنان از مواد معدنی کلدازیت که حاوی حدود ۳۰٪ بادلیت و ۷۰٪ زیرکن در نظر گرفته میشود که مقادیر قابل توجهی در Pocos de Caldas وجود دارد. تولید زیرکونیا از شبه جزیره کولا در اتحاد جماهیر شوروی سابق به عنوان یک محصول جانبی استخراج آهن از معدن کربناتیت مشابه Phalaborwa است این معدن در سال ۱۹۳۳ کشف شد ولی در سالهای اخیر توسعه یافتهاست. به نظر میرسد که ذخائر قادر به حفظ عملیات برای زمان قابل توجهی هستند اما بازیابی سنگ آهن برای اقتصاد معدن بسیار مهم است، در حال حاضر کمکهای خارج از کشور خصوصاً از نروژ سبب بهبود میزان بازیابی است و انتظار میرود که خروجی چند هزار تن در سال را بتوان حفظ کرد و افزایش داد. از دیگر منابع، معدن جیتینسیت (gittinsite) است که در دریاچه Strange در کانادا و بادلیت همچنین در آفریقای شرقی، سریلانکا و شبه جزیره کولا در جماهیر شوروی سابق یافت میشود ولی این منابع بهطور تجاری توسعه نیافتهاند. در طول دوره ۱۹۸۰ تا ۱۹۸۴ میانگین تولید بادلیت ۱۲۰۰۰ تن بوده که همه آنها از آفریقای جنوبی تولید شده بعلاوه ظرفیت اضافی برای برآوردن تقاضای خروجی حدود ۲۰۰۰۰ تن در سال ۱۹۸۷ پیشبینی شده بود. در اینصورت تنها ۱۳۰۰۰ تن در آن سال تولید شد درصورتیکه هماکنون خروجی حدود ۲۰۰۰۰ تن است و احتمالاً برای مدتی باقی میماند. بادلیت به عنوان یک محصول از غلظت مواد معدنی مس و فسفات بدست میآید. اگرچه منبع به صورت محدود و با شیب افزایشی کندی در نظر گرفته شدهاست، با این حال پس از ۲۰۰۰ سال به احتمال زیاد تولید کاهش خواهد یافت. در حال حاضر نسبت افزایش زیرکونیا حدود یک سوم از زیرکن و زیرکونیوم سیلیکات تولید میشود. ذخایر جهانی توسط ایالات متحده تخمین زده میشود. بهطور عمده دفتر معادن در حدود ۴۵ میلیون تن به صورت جدول زیر واقع شده:
| استرالیا | ۱۷ میلیون تن |
| آفریقای جنوبی | ۷ میلیون تن |
| ایالات متحده آمریکا | ۸ میلیون تن |
| جماهیر شوروی سابق | ۶ میلیون تن |
| هند | ۳ میلیون تن |
و با ذخائر اضافی در چین، سیری لئون، سریلانکا، مالزی، تایلند، کانادا و ماداگاسکار.
در ااواخر سال ۱۹۸۰ سرعت بالای استفاده از ماسهٔ ریختهگری دیرگدازی و ابزارهای ساینده منجر به کمبود کلی زیرکن شد و این با ملاحظات زیستمحیطی در سواحل شرقی استرالیا برای کاوش کمتر همراه بود. این وضعیت با بازسازی برنامه در سواحل شرقی استرالیا بهبود یافت و همچنین کمبود زیرکن در اواسط ۱۹۹۰ با کشف ذخائر جدید در برزیل، ماداگاسکار سیرا لئون و موزامبیک ریشه کن شد. در طول دهه ۱۹۷۰ محصولات جهانی از حدود ۰٫۵ میلیون تن به ۰٫۷ میلیون افزایش یافت و از ۱۹۸۲ میانگین ۰٫۷۶ میلیون تن بود. زیرکن یک محصول از عملیات معدن برای ایلیمینت، روتایل و مونازیت است. ذخایر شناسایی شده برای پاسخگویی به تقاضا برای ۶۰ سال کافی است و منابع اضافی نشان داده شده، ذخایر حاشیه ای اقتصادی برای پاسخگویی به تقاضا برای ۱۳۰ سال دیگر کافی است و ممکن است منابع بیشتری شناسایی شود؛ بنابراین بعید است که در دسترس بودن منابع معدنی در آینده قابل پیشبینی باشد… با این حال با یک نسبت افزایشی زیرکن بیشتر از بادلیت بدست میآید مگر اینکه منابع دیگر نیز باشد، از آنهایی که اکنون در آفریقای جنوبی استخراج میشوند.[2]
ساختارهای زیرکونیا
زیرکونیا یا دیاکسید زیرکونیوم (ZrO2) مهمترین و پایدارترین اکسید زیرکونیوم است. زیرکونیای خالص، یک پودر سفید رنگ با نقطهٔ ذوب °C2710±۳۵، در سه پلیمورف مونوکلینیک، تتراگونال، مکعبی تعریف شدهاست، که در سه محدودهٔ دمایی متفاوت پایدار هستند. سیستم کریستالی مونوکلینیک در دمای پایینتر ۹۵۰ °C پایدار است. در محدودهٔ دمایی ۱۲۰۰ °C - 2370 °C، زیرکونیا از سیستم مونوکلینیک به تتراگونال تبدیل میشود. تبدیل تتراگونال به مونوکلینیک با افزایش حجم در حدود %۴ همراه است. در نهایت با افزایش دما، در دمای بالاتر از ۲۳۷۰ °C به سیستم کیوبیک و ساختار فلوریت تبدیل میشود. هنگام سرد کردن ساختار تتراگونال در دمای ۹۷۰ °C به ساختار مونوکلینیک تبدیل میشود و بالعکس با گرم کردن، ساختار مونوکلینیک در دمای ۱۱۵۰ °C به ساختار تتراگونال تبدیل خواهدشد. این تغییر حجم باعث یک تنش درونی در طی فرایند سردکردن، ایجاد ترک، غیریکنواختی در ماده و در نهایت شکست خواهد شد. برای جلوگیری از این موضوع از افزودنیهایی نظیر ایتریا (Y203) یا سایر اکسیدها استفاده میشود. عملکرد این اکسیدها به گونهای است که با پر کردن جاهای خالی، باعث پایدارشدن فاز تتراگونال یا حتی فاز دما بالای مکعبی میشود.[3][4]
برای زیرکونیای خالص پلی مورفها میتوانند با استفاده از تفرق اشعه X متمایز شوند و یک تجزیه و تحلیل مفصل برای تعیین مقادیر کمی فاز مونوکلینیک صورت میگیرد. به علت روی هم افتادن پیکهای مربوطه، به هنگام تشخیص سیستمهای تتراگونال و کوبیک مشکلاتی بروز میکنند. در این مورد لازم است که رد اشعه X را در زوایای بالایی آزمایش کرد که در آن شدت کم بازتابش ها آنالیز کمی را بینهایت مشکل میکنند و تنها آنالیز کیفی ممکن است. برای تعیین مقدار فازها در سیستم های آلیاژی زیرکونیا، اضافه کردن یک آنیون متفاوت به واحد شبکه تأثیراتی را به وجود می آورد. اولا پارامترهای شبکه با توجه به اندازه آنیون در محلول جامد تغییر میکنند، که یک تغییر محل پیک ایجاد میکند. یک تأثیر مهمتر تغییر شکل، واحد شبکه است که تأثیر بسیار زیادی بر روی عامل ساختمان دارد. شدت یک پیک خاص میتواند به نحو قابل ملاحظه ای تغییر کند. این موضوع مشکل زیادی در انجام تجزیه کمی به وجود می آورد، زیرا شدتهای پیکها برای نمونههای ظاهراً یکسان (برحسب ترکیب شیمیایی) به عنوان نتیجه ای از سابقه حرارتی، میتواند تغییر کند. برای آلیاژهای زیرکونیا یک درجهبندی اصولی برای تجزیههای کمی دقیق ارائه شدهاست. معادلات چندی هم بدست آمدهاست اما باید توجه داشت که هر یک باید در مورد یک سیستم خاص با سابقه ساخت خاص بکار برده شده، اعمال شوند.[5]
عنصر زیرکونیوم از نظر خواص شیمیایی بسیار شبیه به هافنیوم است که ظرفیت و شعاع یونی آن را نشان میدهد، ودر طبیعت زیرکونیوم همیشه همراه با ۲٪ زیرکونیوم از وزن کل ترکیب وجود دارد. همانطور که دو فلز مشابه هستند، جداسازی آنها دشوار است، اما برای همه کاربردها غیر از برای استفاده در راکتورهای هسته، محتوای هافنیوم قابل قبول است.[2]
داده های کریستالوگرافی در جدول زیر داده شدهاست:
| ساختمان کریستالی | مونوکلینیک | تتراگونال | مکعبی |
|---|---|---|---|
| گروه فضایی P21/c | گروه فضایی P42/nmct | گروه فضایی Fm3m | |
| a=۵٫۱۵۶ ᐤA | at=۵٫۰۹۴ ᐤA | ac=۵٫۱۲۴ ᐤA | |
| b=۵٫۱۹۱ ᐤA | |||
| c=۵٫۳۰۴ ᐤA | ct=۵٫۱۷۷ ᐤA | ||
| β=۹۸٫۹ ᐤ | |||
| دانسیته | 5830Kg/m3 | 6100Kg/m3 | 6090Kg/m3 |
مونوکلینیک
ساختار کریستالی مونوکلینیک از نظر ترمودینامیکی از دمای اتاق تا حدود ۹۵۰ درجهٔ سانتیگراد، پایدار است و اغلب تحت عنوان مینرال بادلیت شناخته میشود. شکل طبیعی زیرکونیا، بادلیت، محتوی تقریباً ۲٪ است، اما این اکسید از نظر ساختمانی و خواص شیمیایی چنان شبیه به زیرکونیاست که اثر کمی دارد. یاردلی در سال ۱۹۲۶ اولین کسی بود که آن را به صورت گروه فضایی P2_1 C نشان داد و وجود چهار مولکول اکسید زیرکونیم را در در سلول واحد پیشبینی کرد. او همچنین اشاره کرد که ساختار مونوکلینیک یک ساختار بهم ریخته از سلول واحد فلوریت است و همچنین بعدها نشان داد که ساختار تتراگونال دما بالا نیز یکی از ساختار به هم ریخته دیگر از سلول واحد فلوریت است. در سال ۱۹۵۹ تروبلود و مکلوف، نخستین توضیح قابل قبول در مورد ساختار این بلور را ارائه دادند، اگر چه آنالیز آنها اطلاعات سه بعدی کاملی را ارائه نداده و مقدار تفاوت بین ساختار کریستالی تجربی و محاسباتی (R) نیز قابل توجه بود. در ادامه اسمیت و نیوکریک در سال ۱۹۶۳ کار بر روی ساختارها را ادامه دادند و اطلاعات کوردیناسیونی کامل اتمی را نیز ارائه نمودند اما مقدار R هنوز قابل توجه بود. آدام و روگرس در سال ۱۹۵۹ نخستین کسانی بودند که در مورد پارامتر شبکه فاز مونوکلینیک تحقیق کردند.[6]
تتراگونال
یون در فرم تتراگونال خود به کئوردیناسیون هشتتایی متمایل است، در آن حالت نیز یک تغیر شکل وجود دارد که ناشی از این است که چهار یون اکسیژن در فاصله ᐤA 2/065 در یک تتراهدر طویل شده که حدود ۹۰ چرخیدهاست قرار دارند.[7]
پلی مورف تتراگونال زیرکونیا نخستین بار توسط روف و ابرت در سال ۱۹۲۹ در اثر تبدیل از فاز مونوکلینیک در رنج دمایی بالای ۱۱۰۰ تا ۱۲۰۰ مشاهده کرد. گروه فضایی آن به صورت P4_2/nmc نمایش داده میشود. محدوده دمایی که برای آغاز و پایان تبدیلات گزارش شده توسط روشهای تجربی مانند XRD، دیلاتومتری، میکروسکوپ الکترونی و DTA به دست آمدهاند. خلوص بر روی استوکیومتری (عیب استوکیومتری ناشی از نبود یون اکسیژن برای مثال وقتی در خلاء و در دمای بالا زینتر صورت میگیرد) و فازهای ناخالصی مزر دانه ای، تأثیر میگذارد. اندازه دانه نیز باعث اختلافاتی در نتایج میشود. محدوده دمایی ۹۵۰ تا ۱۱۵۰ درجهٔ سانتیگراد برای T_s، دمای آغاز انتقال در طول سیکل حرارتی، گزارش شدهاست. پسماند دمایی استحاله برای مثال اختلاف دمای بین دماهای T_s/ T_f در حین گرمایش و سرمایش بر اساس بعضی گزارشها بالای ۳۲۰ درجهٔ سانتیگراد، اعلام شدهاست.[6]
مکعبی
فاز مکعبی دمای بالا، ساختمانی معادل ساختمان با وجوه پر دارد که در آن هر یک از یونهای با یونهای اکسیژن که در دو تتراهدر یکسان مرتب شده اند، یک تقارن هشتایی دارند.[6]
گروه فضایی ساختار کریستالی مکعبی، Fm3m است و پارامتر شبکه آن که تابع اندازهگیری در دمای بالا یا دمای اتاق میباشد، در حدود ۰٫۵۰۸ نانومتر است. تشخیص تفاوت بین زیرکونیا مکعبی و تتراگونال زمانی که هر دو فاز موجود باشند توسط XRD یا آزمایش پراش الکترونی بسیار مشکل است. تبدیل زیرکونیای تتراگونال به مکعبی نخستین بار توسط اسمیت وکولون در سال ۱۹۶۲ با استفاده از XRD دما بالا تشخیص داده شد. این تبدیل در دمای ۲۲۸۵ درجهٔ سانتیگراد با یک پسماند دمایی نسبتاً کوچک با ماکزیمم حدود ۳۰ درجه، رخ میدهد. در این حالت با انتقال کوچک اتمهای اکسیژن در طول محور C که همراه با کاهش طول در محور C است منجر به تبدیل پلی مورفی تتراگونال به مکعبی میشود. البته در این حالت هیچ تغییری در پیوندها رخ نمیدهد.[6]
ویژگیها
ویژگیهای خاص زیرکونیا که موجب استفاده از آن درکاربردهای متنوعی میشود عبارتند از:
- استحکام بالا
- تافنس شکست بالا
- مقاومت سایشی استثنائی
- سختی بالا
- مقاومت شیمیایی استثنایی
- تافنس بالا
- دیرگدازی بالا
- رسانایی یونی (یون اکسیژن) خوب
مدول الاستیک زیرکونیا بسته به ترکیب شیمیایی، دانسیته و ریزساختار آن از ۱۵۰–۲۵۰ گیگا پاسکال، استحکام شکست از ۴۵۰ تا ۹۰۰ مگا پاسکال، چقرمگی از ۵ تا 13 MPam1/2 و سختی آن ۷ تا ۸ موس تغییر مینماید. زیرکونیا به دلیل فشار بخار پایین آن نسبت به سرامیکهای هم خانواده خود چون آلومینا معمولاً از مقاومت به خوردگی بالاتری برخوردار است. اما مقاومت به شوک حرارتی آن به خصوص در دماهای بالاتر از ۱۰۰۰ درجه سانتی گراد به دلیل استحاله فازی پایین میباشد. زیرکونیا در برابر اسیدها (HCL و HNO3) ضعیف بوده و واکنش پذیری آن با اسیدها نسبت به قلیاییها سریع تر است. در تماس با کربن، نیتروژن و هیدروژن در دمای ۲۲۰۰ تجزیه شده و تشکیل کاربید، نیترید یا هیدرید میدهد. وجود فشار بخار آب یا اتمسفر مرطوب موجب میشود تا تحول فازی تتراگونال به منوکلینیک از دمای ۱۰۰ درجه سانتی گراد بهطور خود به خود صورت گیرد. زیرکونیا به دلیل استحاله فازی میتواند به واسطه مکانیزمهای مختلفی چون انحراف مسیر ترک، ایجاد تنشهای فشاری بر لبهای ترک و ایجاد ریز ترکها انرژی گسترش ترک را افزایش داده و باعث کند شدن رشد ترک بشود. به این ترتیب حضور زیرکونیا به عنوان فاز ثانویه در سرامیکهای مختلف باعث افزایش چقرمگی میشود.[8]
کامپوزیتها و کاربردهای زیرکونیا
سرامیکهای زیرکونیایی یکی از انواع سرامیکهای چقرمهاند که بر خلاف بیشتر سرامیکها در برابر ضربه مقاوم هستند. چکشهای سرامیکی یکی از انواع محصولات زیرکونیایی هستند. از دیگر کاربردهای این سرامیک، پوششهای سد حرارتی میباشد. این سرامیک به علت انتقال حرارت کم و مقاومت به شوک حرارتی گزینه خوبی برای پوشش دهی سد حرارتی میباشد. از جمله کاربردهای آن درپوشش دهی پرههای توربینهای گازی میباشد.
از جمله کامپوزیتهای زیرکونیایی، کامپوزیت زیرکونیا- مولایت، زیرکونیا- آلومینا میباشد.
کامپوزیت زیرکونیا- مولایت
از ویژگیهای این کامپوزیت، خواص مکانیکی عالی است که با تفتجوشی واکنشی (REACTION SINTERING) بهدست آمدهاست. دیاکسیدتیتانیوم و دیاکسید تیتانیوم با ایتریا (Y203) از جمله افزودنیهایی هستند که در این روش برای کاهش فاز آمورف در مرزدانهها استفاده شدهاست. میکروساختار مشاهده در این کامپوزیت شامل یک زمینه (matrix) متراکم با دانههای ریز که در تمام جهات بهطور یکسان هستند و ذرات زیرمیکرونی (Submicron) زیرکونیا که بهطور یکنواخت در مرز دانهها قرار گرفتهاند، همراه با میزان کمی فاز شیشه با ویسکوزیته کم میباشد. نمونهای از خواص مکانیکی که از این کامپوزیت بهدست آمدهاست در جدول زیر نشان داده شدهاست. استحکام خمشی در حدود 300MPa و فاکتور ضریب شدت تنش بحرانی MPam1/2 3-4 است، که در بالای ۸۰۰ °C این خواص کاهش پیدا میکند.[9]
کامپوزیت زیرکونیا- آلومینا
کامپوزیت آلومینا- زیرکونیا، ترکیبی از سختی بالای آلومینا و مقاومت به شکست عالی زیرکونیا است؛ که بهطور گسترده به عنوان جایگزینی مناسب برای زیرکونیا با سیستم مونوکلینیک و آلومینا شدهاست. یکی از مشکلات اصلی زیرکونیا، هنگام پیرسازی (aging) و قرارگیری در شرایط هیدروترمال است که زیرکونیا از سیستم تتراگونال به مونوکلینیک تبدیل میشود. مطالعات نشاندهندهٔ شکست آلومینا بهدلیل مقاومت به گسترش ترک پایین میباشد. باکامپوزیت آلومینا- زیرکونیا این اثر از بین رفتهاست.[4]
زیرکونیا به عنوان رنگ سرامیکی و اپک کننده
مصرف اصلی زیرکونیا در این بخش برای رنگ کاشی، ظروف سفره و چینی بهداشتی است. زیرکونیا و سیلیکا در کنار عناصر دیگر باعث ایجاد رنگهای متفاوتی میشوند که برای تهیه، مخلوط باید در دمای ۸۵۰ تا ۱۵۰۰ درجه سانتی گراد کلسینه شود که رنگهای متفاوت حاصل از ترکیب زیرکن با عناصر دیگر در شکل زیر آمدهاست:[2]
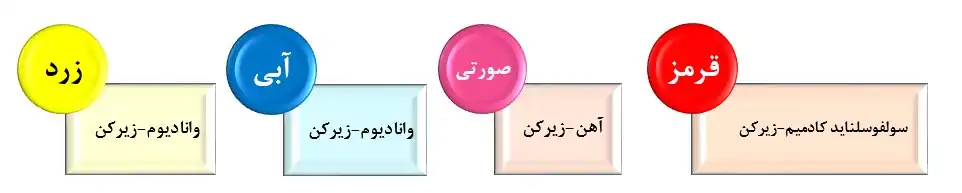
علت استفاده از زیرکونیا به عنوان اپککننده در مینا و لعاب سفید، بهرهمندی از وضوح و ماندگاری بالاست.[2]
زیرکونیا به عنوان ساینده
دو ویژگی مهم مواد ساینده سختی و چقرمگی است. ترکیب این دو ویژگی مناسب بودن ساینده برای کاربرد خاص را تعیین میکند. در این موارد سختی با استفاده از روش نوپ اندازهگیری میشود که سختی بعضی مواد سرامیکی در جدول زیر برای مقایسه آورده شدهاست.[2]
| میانگین سختی نوپ | ماده |
|---|---|
| ۷۸۲ | مگنزیا |
| ۷۹۶ | زیرکونیا |
| ۹۵۸ | کوارتز |
| ۲۶۰۰ | کاربید سیلیسیوم سیاه |
| ۳۰۰۰ | کاربید بور |
| ۴۷۰۰ | نیترید بور مکعبی |
| ۸۳۵۰ | الماس |
زیرکن از زیرکونیا سختتر بوده و به روش سل ژل برای تهیهٔ ساینده با کیفیت بالا مصرف میشود.[2]
زیرکونیا به عنوان دیرگداز
بادلیت و زیرکونیا برای تهیهٔ دیرگداز ذوبی یا ریختهگری گداخته شده (fused cast) آلومینا-زیرکونیا-سیلیکا (ASZ) و آلومینا-زیرکونیا-کرومیا-سیلیکا (ASCZ) استفاده میشوند، در حالیکه قطعه دیرگداز بهطور مستقیم از زیرکن حاصل میشود.[2]
دیرگدازهای پوشش و لاینینگ کورهها و فیبرهای سرامیکی عموماً از سیلیکا، آلومینا یا آلومینا-سیلیکا بوده که گسترهٔ وسیعی از بازهٔ دمایی را پوشش میدهد. فیبرهای زیرکونیایی برای دماهای ۱۷۰۰ تا ۲۲۰۰ درجه سانتی گراد کاربرد دارند.[2]
زیرکونیا جایگزین قالب و ابزار فلزی
مواد معمول برای قالبهای اکستروژن شامل فولاد ابزار، کاربید تنگستن و سوپر آلیاژها میشوند ولی به دلیل دفرمه شدن، سطح محصول نهایی نامناسب و کاهش عمر قالب به دلیل دمای انتقالی از قالبهای فلزی، ایدهآل نیستند. در مقابل، از میان سرامیکها کامپوزیت آلومینا-زیرکونیا و PSZ به دلیل مقاومت به شوک حرارتی بالا، هدایت حرارتی پایین، قابلیت پولیش بالا، مقاومت به خزش و سطح مناسب قطعه نهایی، راضیکننده بودند.[2]
زیرکونیا به عنوان ماده الکترونیکی
در اواسط دهه ۱۹۵۰ میلادی محلول جامد سرب-زیرکونیا-تیتانات (PZT) بهطور گسترده برای خواص پیزوالکتریک معرفی و استفاده شد که از ۹۹/۷٪ زیرکونیا، تیتانیا و سرب مونوکسید شکل گرفته بود. خواص پیزوالکتریک با اعمال کردن میدان الکتریکی بزرگ در دمای ۱۰۰ تا ۲۰۰ درجه سانتی گراد و سرد کردن تا دمای اتاق هنگامی که همچنان میدان اعمال میشود اندازهگیری میشود.[2]
زیرکونیا در دندان پزشکی
از زیرکونیا به دلیل خواص مکانیکی خوب نظیر استحکام و تافنس شکست بالا، خواص ظاهری عالی، زیست سازگاری و دوام شیمیایی بالا بهطور گسترده در دندانپزشکی به عنوان روکش، اباتمنتهای (Abutment) زیرکونیایی، درونکاشت دندانی (Dental implant) پایه زیرکونیایی و غیره استفاده شدهاست. از جمله ترکیبات مورد نظر برای بهبود خواص زیرکونیا در دندان پزشکی، استفاده از آلومینا، ترکیبات شیشه بر پایه SiO2 - B2O3 - La2O3 - Al2O3 - Y2O3 - ZrO2 - CaO - BaO - TiO2 میباشند[10][11][12]
زیرکونیای پایدار شده
در ابتدای این مقاله ساختار متفاوت زیرکونیا معرفی شدند اما نکته حائز اهمیت انقباض و انبساط شبکه در حین استحاله فازی است. فاز مونوکلینیک که در دمای محیط پایدار است با رسیدن به دمای تقریبی ۱۱۷۰ درجه سانتیگراد دچار استحاله فازی شده و به فاز تتراگونال میرود که در اثر این تغییر ساختار در شبکه انقباض اتفاق میافتد. با ادامه گرمایش در دمای تقریبی ۲۲۷۰ درجه سانتیگراد فاز تتراگونال به فاز مکعبی تبدیل میشود که موجب انبساط شبکه میشود. بدیهی است که در حین سرمایش عکس این رفتار اتفاق خواهد افتاد. ثوابت شبکه برای هر ساختار پیش از این آورده شد. این انقباض و انبساطها در حین گرمایش و سرمایش منجر به بروز ترک در ساختار میشود که مطلوب نیست. از طرفی ساختار مکعبی و تتراگونال خواص خوبی برای کاربردهای مختلف از خود نشان دادهاند؛ بنابراین دوپنتهای گوناگونی (همچون MgO, Y2O3، CeO2، Sc2O3 و غیره) برای پایدار سازی فاز مکعبی در دمای اتاق مورد استفاده قرار گرفتهاند.[13]
روشهای سنتز
کی از روشهای نسبتاً مستقیم تولید زیرکونیا از سنگ معدنی بادلیت است. در اولین قدم و با جداسازی مکانیکی به زیرکونیا با خلوص ۹۶٪ میرسیم؛ جداسازی مغناطیسی خلوص ۹۹٪ را حاصل میکند و در ادامه کار با یک سری عملیاتهای شیمیایی ماده ای با خلوص بالاتر نیز قابل دست یابی است.
روش دیگر، تولید زیرکونیا از زیرکون (زیرکونیوم سیلیکات) است که فرایند نسبتاً پیچیدهای دارد. در این روش با روشهای متفاوت باید تجزیه صورت گیرد و هرکدام از این روشهای متغیر هستند بنابراین بسیار دور از انتظار است که دو شرکت تولیدکننده یک مسیر یکسان را دنبال کنند.
بهطور کلی سه روش برای این فرایند وجود دارد:
۱) رایجترین روش تجزیه با استفاده از سدیم هیدروکسید در دمای ۶۰۰ درجه سانتیگراد یا با سدیم کربنات در ۱۰۰۰ درجه سانتیگراد و تشکیل سدیم زیرکونات، سدیم زیرکونات سیلیکات و سدیم سیلیکات میباشد که سدیم سیلیکات در آب حل میشود. در ادامه با کلسیناسیون، اکسیدی با خلوص پایین حاصل میشود که میتوان آن را خالص سازی کرد.
۲) تجزیه با کلسیا در دمای ۱۶۰۰ درجه سانتیگراد، زیرکونیا و کلسیم سیلیکات حاصل میکند. کلسیم سیلیکات با هیدروکلریک اسید رسوب میکند و جدا میشود. تجزیه با کلسیا میتواند در کوره قوس الکتریکی در دمای ۲۷۵۰ درجه سانتیگراد نیز انجام شود و تولید زیرکونیای ذوبی کند.
۳) گرمایش زیرکن همراه با کربن در کوره قوس الکتریکی منجر به تشکیل زیرکونیا میشود.
از روشهای دیگر تولید زیرکونیا تجزیه پلاسمایی است بدین صورت که دانههای زیرکن درون یک قوس پلاسما با دمای ۱۴۰۰۰ درجه سانتیگراد تزریق شده، ذوب میشوند و به صورت شیمیایی تفکیک میشوند. دانههای در حال سقوط به سرعت خنک شده و از آنجایی که نقطه ذوب زیرکونیا بسیار بالاست، اولین فازی است که به شکل دندریتهای ریز منجمد میشود. سیلیکا در فاز شیشه ای آمورف منجمد میشود که در سدیم هیدروکسید حل شده و تولید سدیم متاسیلیکات میکند که آن نیز محصولی کارآمد است.
یک راه دیگر برای سنتز به صورت بالک استفاده از زیرکن و سنگ آهک است که در آن یک فرایند تجزیه ای دو مرحله ای اتفاق میافتد و زیرکونیا و کلسیم سیلیکات تشکیل میشوند و بعد از آن با روشهای فیزیکی یا شیمیایی جداسازی میشوند.
یک کار رایج در سنتز زیرکونیا تشکیل یک محلول آبی از زیرکونیوم اکسی کلرید است. دما، pH و شرایط نگهداری بر ریزساختار محصول نهایی مؤثر هستند. با نگهداشتن شرایط مطلوب یک پودر ریزدانه حاصل میشود. همچنین با تغییر پارامترهای مختلف میتوان به محصولی با خاصیت متفاوت رسید.
مرحله نهایی بعد از سنتز، کلسیناسیون است که در اینجا نیز تغییر پارامترها محصول متفاوتی رو حاصل میکند بنابراین محصولات بی شماری قابل دست یابی هستند.[14]
جستارهای وابسته
منابع
- Wang, S. F.; Zhang, J.; Luo, D. W.; Gu, F.; Tang, D. Y.; Dong, Z. L.; Tan, G. E. B.; Que, W. X.; Zhang, T. S.; Li, S.; Kong, L. B. (2013-05-01). "Transparent ceramics: Processing, materials and applications". Progress in Solid State Chemistry. 41 (1): 20–54. doi:10.1016/j.progsolidstchem.2012.12.002. ISSN 0079-6786.
- Zirconia (ویراست ۳rd ed). Oxford, UK: Elsevier Advanced Technology. 1993, ©1992. OCLC 28549690. شابک ۱۸۵۶۱۷۱۸۱۷. تاریخ وارد شده در
|تاریخ=را بررسی کنید (کمک) - Brog, Jean-Pierre; Chanez, Claire-Lise; Crochet, Aurelien; Fromm, Katharina M. (2013). "Polymorphism, what it is and how to identify it: a systematic review". RSC Advances. 3 (38): 16905. doi:10.1039/c3ra41559g. ISSN 2046-2069.
- Hannink, Richard H. J.; Kelly, Patrick M.; Muddle, Barry C. (2004-12-21). "Transformation Toughening in Zirconia-Containing Ceramics". Journal of the American Ceramic Society. 83 (3): 461–487. doi:10.1111/j.1151-2916.2000.tb01221.x. ISSN 0002-7820.
- حبیبی، مهرداد (۱۳۸۲). آشنایی با زیرکونیا. تهران: فنی حسینیان. صص. ۲۶. شابک ۹۶۴۶۶۰۷۳۲۲.
- «زیرکونیا». ۲۷ اسفند ۱۳۹۶.
- حبیبی، مهرداد (۱۳۸۲). آشنایی با زیرکونیا. تهران: فنی حسینیان. صص. ۲۸. شابک ۹۶۴۶۶۰۷۳۲۲.
- «zirconia» (PDF).
- Meriani, S.; Palmonari, C., eds. (1989). "Zirconia'88". doi:10.1007/978-94-009-1139-0.
- Triwatana, Premwara; Srinuan, Phakphum; Suputtamongkol, Kallaya (2013). "Comparison of two fracture toughness testing methods using a glass-infiltrated and a zirconia dental ceramic". The Journal of Advanced Prosthodontics (به English). 5 (1): 36. doi:10.4047/jap.2013.5.1.36. ISSN 2005-7806. PMC 3597924. PMID 23507882.
- Saati, K; Heshmat, H; valaei, N; Lessan, T (2016-12-01). "The Evaluation of the Effect of Different Thicknesses on Polymerization of Bulk Fill Flowable Composites". journal of research in dental sciences. 13 (4): 167–173. doi:10.18869/acadpub.jrds.13.4.167. ISSN 2008-4676.
- Kim, Dae Joon; Han, Jung Suk; Lee, Sun Hyung; Yang, Jae Ho; Lee, Deuk Yong (2003-12). "Zirconia/Alumina Composite Dental Implant Abutments". Key Engineering Materials. 254-256: 699–702. doi:10.4028/www.scientific.net/kem.254-256.699. ISSN 1662-9795. Check date values in:
|date=(help) - Advance Techniques for the Synthesis of Nanostructured Zirconia-Based Ceramics for Thermal Barrier Application. Springer. ۲۰۱۷. شابک ۹۷۸-۳-۳۱۹-۴۹۵۱۲-۵ - ۹۷۸-۳-۳۱۹-۴۹۵۱۰-۱ مقدار
|شابک=را بررسی کنید: length (کمک). پارامتر|first1=بدون|last1=در Authors list وارد شدهاست (کمک) - Zirconia: MMR. Elsevier. ۲۰۱۶. شابک ۱۴۸۳۱۹۴۰۱۹ - ۹۷۸۱۴۸۳۱۹۴۰۱۱ مقدار
|شابک=را بررسی کنید: length (کمک).
- «IUPAC GOLD BOOK». دریافتشده در ۱۸ مارس ۲۰۱۲.