سولفوریک اسید
اسید سولفوریک که در گذشته جوهر گوگرد خوانده میشد، نوعی اسید معدنی است که از عناصر گوگرد، اکسیژن و هیدروژن تشکیل میشود و فرمول شیمیایی آن H2SO4 است. این ماده یک مایع بیرنگ، بیبو، و با گرانروی بالا است که در آب انحلال پذیر بوده و واکنش ترکیب شدن آن با آب بسیار گرمازا است.[1]

| سولفوریک اسید | |||
|---|---|---|---|
| |||
اسید سولفوریک | |||
دیگر نامها سولفات هیدروژن | |||
| شناساگرها | |||
| شماره ثبت سیایاس | ۷۶۶۴-۹۳-۹ | ||
| شمارهٔ آرتیئیسیاس | WS5600000 | ||
| خصوصیات | |||
| فرمول مولکولی | H2SO4 | ||
| جرم مولی | 98/078 g/mol | ||
| شکل ظاهری | مایع شفاف، بیرنگ و بیبو | ||
| چگالی | 1.84 g cm-3 liquid | ||
| دمای ذوب | ۱۰°C | ||
| دمای جوش | ۲۹۰°C | ||
| انحلالپذیری در آب | حلپذیری کامل (گرماده) انتالپی منفی | ||
| گرانروی | 26.7 cP at 20 °C | ||
| خطرات | |||
| طبقهبندی ئییو | |||
| کدهای ایمنی | R۳۵ | ||
| شمارههای نگهداری | (S1/2), S26, S۳۰, S45 | ||
| لوزی آتش | |||
| نقطه اشتعال | |||
| ترکیبات مرتبط | |||
| مرتبط با اسیدهای قوی | نیتریک اسید هیدروکلریک اسید هیدروبرمیک اسید پرکلریک اسید | ||
| ترکیبات مرتبط | سولفید هیدروژن اسید سولفورو پروکسیمونوسولفوریک اسید تریاکسید سولفور Oleum | ||
| به استثنای جایی که اشاره شدهاست در غیر این صورت، دادهها برای مواد به وضعیت استانداردشان داده شدهاند (در 25 °C (۷۷ °F)، ۱۰۰ kPa) | |||
| Infobox references | |||
|
| |||
حجم تولید این ماده در جهان به قدری بالاست که معمولاً از آن به عنوان «سلطان مواد شیمیایی» یاد میشود.[2] در حقیقت این اسید به قدری با اهمیت است که سرانه مصرف آن به ازای هر فرد، یکی از شاخصهای تعیین پیشرفت فنی کشورهاست.[2]
اسید سولفوریک با فرایندهای مختلفی تولید میشود، از جمله: فرایند تماسی، فرایند اسیدسولفوریک مرطوب، فرایند محفظه سربی.[3]
اسید سولفوریک یکی از مواد اصلی در صنایع شیمیایی است. در صنعت ساخت کودهای شیمیایی بهطور گستردهای از آن استفاده میشود.[4] همچنین کاربرد گستردهای در فراوری سنگها و مواد معدنی، پالایشگاه نفت، تصفیه فاضلاب و سنتز شیمیایی دارد.
تاریخچه
اسید سولفوریک برای نخستین بار توسط جابر بن حیان کشف شد.[5][6][7][8] او با تقطیر کانیهای سولفات آهن (معروف به زاج سبز) (آهن سولفات هفت آبه به فرمول FeSO4.7H2O) و مس(II) سولفات، این اسید را به دست آورد.
خواص فیزیکی
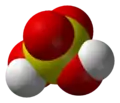
این ماده دارای مولکولهای دارای گشتاور قطبی است که میتوانند با یکدیگر پیوند هیدروژنی برقرار کنند. پس سولفوریک اسید مایعی است با نقطه جوش بالا و هم چنین یک مایع ویسکوز (دارای گران روی زیاد) محسوب میشود. همین شرایط مولکولی باعث میشوند که سولفوریک اسید به خوبی در آب حل شود و محلولهای اسیدی مختلف تولید کند.
ساختار مولکولی و خصلت اسیدی
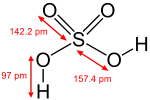
این ماده از مولکولهایی شامل یک اتم گوگرد، چهار اتم اکسیژن و دو اتم هیدروژن ساخته شدهاست. از آنجا که هیدروژنها به اتم اکسیژن متصل هستند، حامل بار مثبت جزئی میباشند و قادرند به عنوان هیدروژن اسیدی عمل کنند. با از دست دادن اولین هیدروژن، آنیون هیدروژنسولفات تولید میشود که با توجه به ساختارهای رزونانسی، بسیار پایدار است؛ بنابراین اولین تفکیک سولفوریک اسید، به شکل کامل انجام میشود:
۱) H2SO4 + H2O → HSO4- + H3O+
برای دومین مرحله، باید هیدروژن به شکل کاتیون، آنیون هیدروژنسولفات را ترک کند که چندان راحت نیست؛ بنابراین تفکیک دومین هیدروژن اسیدی در سولفوریک اسید، کامل نیست و یک واکنش تعادلی است:[9]
۲) HSO4- + H2O ⇔ H3O+ + SO42-
تولید سولفوریک اسید
فرایند مجاورت[10]
سولفوریک اسید، یکی از مهمترین مواد شیمیایی صنعتی است که با استفاده از فرایند مجاورت تولید میشود. در مرحله نخست گوگرد در مجاورت اکسیژن، اکسید شده و گوگرد دیاکسید به دست میآید:
S(s) + O2(g) → SO2(g) (1
در مرحله بعد گوگرد دیاکسید در مجاورت یک کاتالیزگر و در واکنش با اکسیژن اضافی به SO
۳ اکسیده میشود:
SO2(g) + O2(g) → SO3(g) (2
این واکنش گرماده است و انتروپی (بی نظمی) آن کاهش مییابد چون عامل انتروپی نامساعد است (پدیدههای جهان به سمت بی نظمی بیشتر میروند) یک عامل نامساعد ترمودینامیکی دارد پس برگشتپذیر است.
واکنش بالا در دمای معمولی بسیار کند است؛ لذا در روش صنعتی، از دماهای بالاتر (۴۰۰C تا۷۰۰C) و از یک کاتالیزور (مانند پنتا اکسید وانادیم V
۲O
۵ یا اسفنج پلاتین، که البته امروزه کمتر به کار میرود) استفاده میشود.
از واکنش گوگرد تریاکسید با آب، محلول سولفوریک اسید تشکیل میشود:
SO3(g) + H2O(l) → H2SO4(aq) (3
با تکرار مراحل بالا و دمیدن گوگرد تریاکسید درون محلول سولفوریک اسید، پیروسولفوریک اسید (H2S2O7) تشکیل میشود:
H2SO4(l) + SO3(g) → H2S2O7(l) (4سپس با افزودن کمی آب به این به پیروسولفوریک اسید، محلول سولفوریک اسید را تهیه میکنند:
H2S2O7(l) + H2O(l) → 2H2SO4(l) (۵
کنترل این روش که در آن، پیروسولفوریک اسید تشکیل میشود، آسانتر از واکنش مستقیم گوگرد تریاکسید با آب است؛ بنابراین از این واکنش برای تولید سولفوریک اسید با درصد معین و غلظت دلخواه استفاده میشود.
دیگر روشها
سولفوریک اسید را میتوان در آزمایشگاه از واکنش گاز گوگرد دیاکسید با هیدروژن پراکسید (آب اکسیژنه) به دست آورد.
- (g) + H
2O2 (l) → H
2SO
4 (l)SO
2
روش دیگر تولید سولفوریک اسید در آزمایشگاه با استفاده از الکترولیز محلول مس (ll)سولفات میباشد که کاتد باید از فلزی باشد که رسانایی خوبی دارد، مانند مس و آند نیز باید از جنس پلاتین یا زغال باشد تا با محلول واکنش ندهد.
کاربردها
اسید سولفوریک یک ماده شیمیایی اولیه بسیار مهم است و در واقع، تولید اسید سولفوریک یک کشور، شاخص خوبی برای قدرت صنعتی آن است.[11] تولید جهانی در سال ۲۰۰۴ حدود ۱۸۰ میلیون تن بود، با توزیع جغرافیایی زیر: آسیا ۳۵٪، آمریکای شمالی (از جمله مکزیک) ۲۴٪، آفریقا ۱۱٪، اروپای غربی ۱۰٪، اروپای شرقی و روسیه ۱۰٪، استرالیا و اقیانوسیه ۷٪، آمریکای جنوبی 7%.[12] بیشتر این مقدار (یعنی حدود ۶۰٪) برای تولید کودها، به ویژه سوپرفسفاتها، فسفات آمونیوم و سولفاتهای آمونیوم مصرف میشود. حدود ۲۰٪ از اسیدسولفوریک تولید شده در جهان در صنایع شیمیایی برای تولید مواد شوینده، رزینهای مصنوعی، مواد رنگی، دارویی، کاتالیزورهای نفتی، حشره کشها و ضدیخ و همچنین در فرایندهای مختلفی مانند اسیدی سازی چاههای نفت، کاهش آلومینیوم، ساخت کاغذ روغنی، و تصفیه آب استفاده میشود. حدود ۶٪ از موارد استفاده مربوط به رنگدانهها است و شامل رنگ، مینا، جوهر چاپ، پارچه و کاغذ روکش شدهاست و بقیه در بسیاری از کاربردها مانند تولید مواد منفجره، سلفون، منسوجات استات و ویسکوز، روانکنندهها، فلزات غیر-آهنی، و باتریها.[13] اندازه بازار جهانی اسید سولفوریک در سال ۲۰۱۶ برابر ۱۰٫۱۰ میلیارد دلار ارزیابی شدهاست.[14]
منابع
- "Sulfuric acid safety data sheet" (PDF). arkema-inc.com. Archived from the original (PDF) on 17 June 2012.
Clear to turbid oily odorless liquid, colorless to slightly yellow.
- "sulfuric acid | Structure, Formula, Uses, & Facts". Encyclopedia Britannica. Retrieved 2019-03-13.
- Hermann Müller "Sulfuric Acid and Sulfur Trioxide" in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim. 2000 doi:10.1002/14356007.a25_635
- "Sulfuric acid".
- Khairallah, Amin A. Outline of Arabic Contributions to Medicine, chapter 10. Beirut, 1946.
- Douglas K. Louie. Handbook of Sulphuric Acid Manufacturing. صص. ۱–۳. شابک ۰-۹۷۳۸۹۹۲-۰-۴.
- «Jabir Ibn Hayyan is the Father of Modern Chemistry – And Here's What He Taught the World». Mvslim (به انگلیسی). ۲۰۱۹-۰۷-۲۹. دریافتشده در ۲۰۲۰-۰۶-۰۲.
- «Sulfuric acid». www.cs.mcgill.ca. دریافتشده در ۲۰۲۰-۰۶-۰۲.
- مبانی شیمی تجزیه؛ ویرایش6؛ اسکوگ، وست، هالر؛ مرکز نشر دانشگاهی
- مورتیمر، چارلز. شیمی عمومی۲. تهران:نشر علوم دانشگاهی، ۱۳۸۳
- Chenier, Philip J. (1987). Survey of Industrial Chemistry. New York: John Wiley & Sons. pp. 45–57. ISBN 978-0-471-01077-7.
- Davenport, William George; King, Matthew J. (2006). Sulfuric acid manufacture: analysis, control and optimization. Elsevier. pp. 8, 13. ISBN 978-0-08-044428-4. Retrieved 23 December 2011.
- Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Oxford: Butterworth-Heinemann. p. 653. ISBN 0080379419.
- "Sulfuric Acid Market Size, Outlook | Industry Overview Report 2018-2025". www.grandviewresearch.com. Retrieved 2021-01-08.