فسفوئنولپیرووات کربوکسیکیناز
فسفوئنولپیرووات کربوکسیکیناز (PEPCK) آنزیمی از خانواده ترانسفراز است که در مسیر متابولیکی گلوکونئوژنز نقش دارد و اگزالواستات را به فسفوئنول پیرووات و دیاکسید کربن تبدیل میکند و به دو شکل سیتوزولی و میتوکندریایی وجود دارد.
ساختار
در انسان دو ایزوفرم PEPCK وجود دارد: ایزوفرم سیتوزولی (SwissProt P35558) و ایزوفرم میتوکندریایی (SwissProt Q16822) که ۶۳٫۴٪ توالی مشابه دارندو فرم سیتوزولی در گلوکونئوژنز حائز اهمیت است. نوعی از مکانیسم انتقال وجود دارد که با پروتئینهای انتقالی غشا PEP را از میتوکندری به سیتوزول جابجا میکند.
مکانیزم
فسفوئنول پیرووات کربوکسی کیناز اگزالواستات را به فسفوئنول پیرووات و دیاکسید کربن تبدیل میکند.
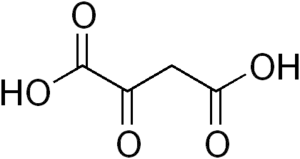 اگزالواستات
اگزالواستات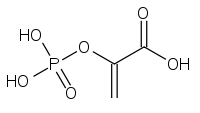 فسفوئنول پیرووات
فسفوئنول پیرووات
فسفوئنول پیرووات کربوکسی کیناز در حد فاصل بین گلیکولیز و چرخه کربس عمل میکند و با کربوکسیلزدایی یک مولکول C4 یک مولکول C3 میسازد. در اولین مرحله فسفوئنول پیرووات کربوکسی کیناز در حضور GTP اگزالواستات OAA را کربوکسیلزدایی و فسفرگیری میکند تا به فسفو ئنول پیرووات PEP تبدیل شود. انجام این واکنش سبب انتقال یک فسفات و به وجود آمدن یک مولکول GDP میشود. وقتی پیرووات کیناز، آنزیمی که این واکنش را به سمت تبدیل PEP به پیرووات به پیش میبرد، در گونه جهش یافته Bacillus subtilis خاموش میشود فسفوئنول پیرووات کربوکسی کیناز در واکنش آناپلروتیک جایگزین شرکت میکند که در جهت خلاف نرمال عملکرد معمول انجام شده و PEP را به اگزالواستات تبدیل میکند. با توجه به امکانپذیر بودن این واکنش به دلیل غیرمطلوب بودن سطح انرژی در آن گونههای جهش یافته رشد بسیار کندی دارند.
گلوکونئوژنز
گلوکونئوژنز
PEPCK-C یک مرحله برگشتناپذیر را در گلوکونئوژنز کاتالیز میکند که طی آن گلوکز تولید میشود؛ بنابراین یتوان گفت که این آنزیم در سوخت وساز گلوکز نقش حیاتی دارد و نتایج در موشهای آزمایشگاهی نیز موئد وقوع دیابت نوع دو در نتیجه افزایش بیان PEPCK-C بودهاند.[1]
نقشی که PEPCK-C در گلوکونئوژنز ممکن است به واسطه چرخه اسید سیتریک میانجی شود که فعالیت آن مستقیماً به فراوانی PEPCK-C مربوط است.[2]
با توجه به نتایج تحقیقات گذشته، سطوح PEPCK-C به تنهایی نمیتواند به میزان زیادی با گلوکونئوژنز در کبد موش مربوط باشد. کبد موش بهطور مشخص PEPCK-C تولید میکند در حالیکه انسان به مقدار مساوی تولید ایزوآنزیم میتوکندریایی آن را نشان میدهد (PEPCK-M) که نقشی بالقوه در گلوکونئوژنز دارد؛ بنابراین، نقش PEPCK-C و PEPCK-M ممکن است پیچیدهتر از آن چیزی باشد که در گذشته پنداشته میشد.
حیوانات
در حیوانات این است که یک مرحله کنترل سرعت در گلوکونئوژنز است که توسط سلولهای سازنده گلوکز از پیش سازهای متابولیک پردازش میشود. تداوم تعادلی دقیق سطح گلوکز خون تا حدودی توسط تنظیم دقیق بیان ژن PEPCK کنترل میشود. برای تأکید بر اهمیت این آنزیم در سوخت و ساز گلوکز لازم است توجه کنیم که افزایش بیان آن در موشها سبب بروز نشنانههای دیابت ملیتوس نوع دو میشود که شایعترین نوع دیابت در انسان بهشمار میرود. به دلیل اهمیت سوخت وساز گلوکز و تعدیل سطح تولید گلوکز، تعدادی از هورمونها مسول تنظیم گروهی از ژنها (شامل PEPCK) در کبد هستند.
PEPCK-C توسط دو مکانیسم هورمونی مختلف کنترل میشود. فعالیت PEPCK-C در نتیجه ترشح کورتیزول از قشر آدرنال و گلوکاگون از سلولهای آلفا پانکراس افزایش مییابد. گلوکاگون به شکل مستقیم بیان PEPCK-C را با افزایش سطح cAMP (فعال کردن آدنلیل سیکلاز) در کبد و متعاقباً فسفریلاسیون S133 صفحات بتا در پروتئین CREB زیاد میکند. سپس CREB به بالادست ژن PEPCK-C در CRE (عامل پاسخ cAMP) متصل شده و رونویسی PEPCK-C را تحریک میکند. از سمت دیگر، کورتیزول با آزاد شدن از قشر آدرنال و گذر از غشای لیپیدی سلولهای کبد (به دلیل طبیعت آب گریز میتواند مستقیماً از بین سلولهای غشاء عبور کند) میتواند به گیرندههای گلوکوکوتیکوئید (GR) متصل شود. این گیرنده دایمریزه شده و مجموعه کورتیزول/GR وارد هسته شده تا به ناحیه عامل پاسخ گلوکوکورتیکوئید (GRE) به شکل مشابه CREB متصل شود و نتایج مشابهی را به وجود آورد (تولید PEPCK-C بیشتر).
کورتیزول و گلوکاگون میتوانند سبب هم افزایی نتایج هم و فعال کردن ژن PEPCK-C به سطوحی شوند که کورتیزول و گلوکاگون هیکدان به تنهایی نمیتوانند به آنجا برسند. PEPCK-C بیشتر در کبد، کلیه و بافت چربی وجود دارد.
یک مطالعه مشترک بین در آژانس حفاظت از محیط زیست ایالات متحده (EPA) و دانشگاه نیوهمپشایر در بررسی اثر DE-71، یک مخلوط تجاری PBDE، روی سطح انرژی آنزیم PEPCK نشان داد که تیمار in vivo مواد آلودهکننده محیطی احتمالاً توسط فعال کردن گیرنده زنوبیوتیک پرگنان (PXR) در سازش با متابولیسم گلوکز و چربی در کبد است و ممکن است که حساسیت به انسولین را در کل بدن تحت تأثیر قرار دهد.
محققان در دانشگاه وسترن رزرو کشف کردهاند که افزایش بیان سیتوسولی PEPCK در عضله اسکلتی موش باعث میشود آنها فعالتر تهاجمی تر شده و زندگی طولانیتر از موشهای عادی داشته باشند؛ متابولیک سوپرمایس را ببینید.
گیاهان
PEPCK (عدد گروه آنزیم ۴٫۱٫۱٫۴۹) یکی از سه آنزیم دکربوکسیلاسیون در مکانیسمهای فشرده سازی کربن غیر آلی در گیاهان C4 و CAM است. سایر انواع شامل آنزیم مالیک_NADP و آنزیم مالیک-NAD میشود. در تثبیت کربن C4، دی اکسید کربن در ابتدا با الحاق به فسفو انول پیروات در مزوفیل به اگزالواستات تثبیت میشود. در گیاهان C4 نوع PEPCK، اگزالواستات سپس به آسپارتات تبدیل شده که از طریق غلاف گرهی جابجا میشود. در سلولهای غلاف گره ای، آسپارتات مجدد به اگزالواستات تبدیل میشود. PEPCK، اگزالواستات را در غلاف گرهی دکربوکسیله کرده و دی اکسید کربن آزاد میکند که در مرحله بعد توسط آنزیم روبیسکو تثبیت خواهد شد. برای هر مولکول دی اکسید کربن که توسط PEPCK تولید میشود یک مولکول َ،\ مصرف خواهد شد.
PEPCK در گیاهانی که تحت تثبیت C4 قرار میگیرند در سیتوسل یافت میشود، برخلاف پستانداران که مشخص شده PEPCK در میتوکندری وجود دارد. در گیاهان این آنزیم در سایر قسمتها هم ممکن است وجود داشته باشد ولی فقط در نوع خاصی از سلولها شامل مناطق بافت آبکشی تخصص یافتهاست. علاوه بر این مشخص شده در خیار (Cucumis sativus L.)، سطوح PEPCK تحت تأثیر عواملی چند که سبب کاهش pH سلولی میشوند افزایش میابد (اگرچه این اثر محدود به بخشی از گیاه است).
وقتی که گیاه با آمونیوم کلراید pH پایین (و نه pH بالا) و یا بوتیریک اسید آبیاری شود سطوح PEPCK در ساقه و ریشه افزایش می یابد. اگرچه میزان PEPCK تحت این شرایط در برگها افزایشی را نشان نداد. در برگها وجود 5 درصد CO2 در اتمسفر سبب تراکم PEPCK میشود.
باکتریها
در تلاش برای کشف نقش PEPCK محققان باعث افزایش بیان PEPCK در ای. کولی از طریق DNA نوترکیب شدند.[3]
PEPCK مایکوباکتریوم توبرکلوزیس نشان داده شدهاست که سبب تحریک سیستم ایمنی موش با افزایش فعالیت سایتوکین است.[4]
به عنوان یک نتیجه میتوان اظهار داشت که PEPCK ممکن است یک ماده مناسب در توسعه زیرواحد مؤثر برای واکسن سل باشد.
اهمیت بالینی
فعالیت در سرطان
تا کنون PEPCK در تحقیقات سرطان مد نظر قرار نگرفتهاست. نمونههای تومور انسانی و دامنههای سلولی سرطانی (سلولهای سرطان پستان، کولون و شش) PEPCK-M (و نه PEPCK-C) به میزان کافی برای ایفای نقش متابولیکی مربوط بیان میشوند؛ بنابراین PEPCK-M میتواند نقشی را در سلولهای سرطانی تحت محدودیتهای تغذیه ای یا سایر انواع استرس داشته باشد.
تنظیمات
در انسان
PEPCK-C در سطوح تولید و فعالیت توسط عوامل چندی افزایش پیدا میکند. رونویسی ژن PEPCK-C، وقتی توسط انسولین مهار شدهاست، توسط گلوکاگون، گلوکوکورتیکوئیدها، رتینوئیک اسید و آدنوزین ۳',۵' مونوفسفاتاز (cAMP) تحریک میشود. از بین این عوامل، انسولین، هورمونی که در دیابت نوع ۱ نقص دارد، به دلیل مهار رونویسی بسیاری از عوامل تحریککننده برتری دارد. فعالیت PEPCK همچنین توسط هیدرازین سولفات مهار میشود که در نتیجه آن سرعت گلوکونئوژنز کاهش مییابد.[5]
در اسیدوزهای طولانی مدت PEPCK-C در در نزدیک سلولهای حاشیه ای شانه ای توبول فوقانی کلیه دچار تنظیم افزایشی شده تا NH3 بیشتری ترشح شده و در نتیجه HCO3− تولید شود.[6]
فعالیت مخصوص GTP در PEPCK در حضور Mn2+ و Mg2+ در بالاترین حد است. علاوه بر این واکنش بیش از اندازه سیستئین (C307) در اتصال Mn2+ به محل فعال نقش دارد.
در گیاهان
فراوانی PEPCK در گیاهان با آبیاری کلرید آمونیوم با pH پایین افزایش مییابد در حالیکه pH بالا چنین اثری ندارد.
طبقهبندی
تحت طبقهبندی EC شماره ۴٫۱٫۱. سه نوع اصلی وجود دارد که توسط منبع انرژی تشخیص داده شده و واکنش را به پیش میبرند:
منابع
- Vanderbilt Medical Center. "Granner Lab, PEPCK Research." 2001. Online. Internet. Accessed 10:46PM, 4/13/07. www.mc.vanderbilt.edu/root/vumc.php?site=granner&doc=119
- Burgess SC, He T, Yan Z, Lindner J, Sherry AD, Malloy CR, Browning JD, Magnuson MA (April 2007). "Cytosolic phosphoenolpyruvate carboxykinase does not solely control the rate of hepatic gluconeogenesis in the intact mouse liver". Cell Metabolism. 5 (4): 313–20. doi:10.1016/j.cmet.2007.03.004. PMC 2680089. PMID 17403375.
- Aich S, Imabayashi F, Delbaere LT (October 2003). "Expression, purification, and characterization of a bacterial GTP-dependent PEP carboxykinase". Protein expression and purification. 31 (2): 298–304. doi:10.1016/S1046-5928(03)00189-X. PMID 14550651.
- Liu K, Ba X, Yu J, Li J, Wei Q, Han G, Li G, Cui Y (August 2006). "The phosphoenolpyruvate carboxykinase of Mycobacterium tuberculosis induces strong cell-mediated immune responses in mice". Molecular and Cellular Biochemistry. 288 (1–2): 65–71. doi:10.1007/s11010-006-9119-5. PMID 16691317.
- Mazzio E, Soliman KF (January 2003). "The role of glycolysis and gluconeogenesis in the cytoprotection of neuroblastoma cells against 1-methyl 4-phenylpyridinium ion toxicity". Neurotoxicology. 24 (1): 137–47. doi:10.1016/S0161-813X(02)00110-9. PMID 12564389.
- Walter F. Boron (2005). Medical Physiology: A Cellular And Molecular Approach. Elsevier/Saunders. ISBN 1-4160-2328-3.