میگلوستات
میگلوستات (انگلیسی: Miglustat) دارویی است که برای درمان نوع ۱ بیماری گوشه بکار میرود.
 | |
|---|---|
| سامانهشناسی نام (آیوپاک) | |
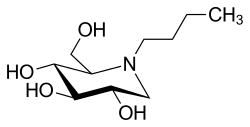
| (2R,3R,4R,5S)-1-butyl-2-(hydroxymethyl)piperidine-3,4,5-triol | |
| دادههای بالینی | |
| نام تجاری | Zavesca |
| AHFS/دانشنامه دراگز | monograph |
| مدلاین پلاس | a604015 |
| Licence data | EMA:Link, US FDA:link |
| رده بارداری | X(US) |
| تجویز | خوراکی |
| دادههای فارماکوکینتیکی | |
| فراهمی زیستی | ۹۷٪ |
| پیوند پروتئینی | ندارد |
| متابولیسم | ندارد |
| نیمهعمر | ۶ تا ۷ ساعت |
| دفع | کلیوی، بدون تغییر |
| شناسه | |
| شماره سیایاس | 72599-27-0 |
| کد ATC | A16AX06 |
| پابکم | CID 51634 |
| IUPHAR ligand | ۴۸۴۱ |
| بانکدارو | DB00419 |
| کماسپایدر | 46764 |
| UNII | ADN3S497AZ |
| ChEBI | CHEBI:۵۰۳۸۱ |
| ChEMBL | CHEMBL1029 |
| مترادفها | 1,5-(butylimino)-1,5-dideoxy-D-glucitol, N-butyl-deoxynojirimycin |
| دادههای شیمی | |
| فرمول | C10H21NO۴ |
| وزن مولکولی | 219.28 g/mol |
| SMILES | eMolecules & PubChem |
| |
| | |
موارد استفاده
این دارو برای درمان موارد خفیف تا متوسطِ «بیماری گوشه نوع ۱» در بالغینی بکار میرود که جایگزینی آنزیم در آنها مقدور نیست یا آنزیمدرمانی برایشان مناسب نیست.[1] میگلوستات در سال ۲۰۰۲ در اروپا[2] و در سال ۲۰۰۳ در ایالات متحده آمریکا از سوی سازمان غذا و دارو[3] مورد تأیید و پذیرش واقع شد.
این دارو همچنین نخستین دارویی است که برای درمان عوارض نورولوژیک پیشرونده در بیماری نیمن پیک، نوع سی (NPC) بکار گرفته شده و در اروپا (۲۰۰۹)، کانادا (۲۰۱۰) و ژاپن (۲۰۱۲) بدین منظور تأیید شدهاست. البته چنین استفادهای هنوز در ایالات متحده آمریکا مورد پذیرش واقع نشده و سازمان غذا و دارو بهدنبال شواهد بیشتری است.[4][5][6][7]
موارد منع مصرف
افرادی که دچار بیماریهای مغز و اعصاب یا مشکلات کلیوی هستند، زنان باردار و همچنین مردان یا زنانی که قصد دارند بچهدار شوند، نباید میگلوستات مصرف کنند.[8]
عوارض جانبی
عوارض جانبی جدی در این دارو شاملِ درد، سوزش، بیحسی و سوزنسوزن شدنِ دستها، بازوها و پاها، لرزش غیرقابلکنترل دستها، تغییرات بینایی و احتمال خونریزی است.
عوارض شایع عبارتند از عوارض گوارشی (اسهال، دلآشوب، نفخ و گاز شکم، بیاشتهایی، یبوست)، خشکی دهان، مشکلات عضلانی (ضعف، کرامپ و گرفتگی ماهیچه بخصوص در پاها، احساس سنگینی در دستها و پاها، عدم استواری بدن هنگام راه رفتن)، پشتدرد، گیجی، عصبیشدن، سردرد، اختلالات حافظه و قاعدگی نامنظم یا دشوار.[8]
نحوهٔ کارکرد
میگلوستات از تشکیل مادهٔ گلوکوسربروزید (که در اثر ناتوانی آنزیم گلوکوسربروزیداز رخ میدهد) جلوگیری میکند که به اینگونه درمان، «درمان از طریق کاهش سوبسترا» میگویند. [9]
جستارهای وابسته
منابع
- Cox, TM; et al. (2003). ": Advisory Council to the European Working Group on Gaucher Disease. The role of the iminosugar N-butyldeoxynojirimycin (miglustat) in the management of type I (non-neuronopathic) Gaucher disease: a position statement". J Inherit Metab Dis. 26 (6): 513–26. PMID 14605497.
- European Medicines Agency. Human Medicines Database. Zavesca (miglustat) Page Accessed 1 September 2014.
- Actelion Press Release August 2003. Zavesca approved -- first oral treatment option for type 1 Gaucher disease
- UK Medicines Information. New Drugs Online Report for miglustat بایگانیشده در ۴ مارس ۲۰۱۶ توسط Wayback Machine
- Staff, The Pharma Letter. 4 April 2012. Actelion drops setipiprant, gets miglustat approval in Japan
- Kevin Grogan for PharmaTimes. 10 March 2010. FDA rejects Actelion's Zavesca for rare NP-C disease بایگانیشده در ۲۰۱۴-۰۹-۰۳ توسط Wayback Machine
- Actelion Press Release. 23 March 2010 Zavesca® (Miglustat) First Treatment Available in Canada for Rare Progressive Niemann-Pick Type C Disease
- American Society of Health-System Pharmacists, Inc. for the Public Library of Medicine. Miglustat on MedlinePlus Accessed 1 September 2014
- Actelion. FDA Advisory Briefing Book for Miglustat (Ogt 918, Zavesca®) in Niemann-Pick Type C Disease NDA 021-348/S-007 Prepared for the Endocrinologic and Metabolic Drugs Advisory Committee meeting, 1 December 2009
- مشارکتکنندگان ویکیپدیا. «Miglustat». در دانشنامهٔ ویکیپدیای انگلیسی، بازبینیشده در ۱۹ مارس ۲۰۱۸.