ریزدیپلام
ریزدیپلام (انگلیسی: Risdiplam) با نام تجاری اِوْریزدی (Evrysdi) نام دارویی است که جهت درمان آتروفی عضلانی نخاعی بهکار میرود[2][3] و نخستین داروی خوراکی تاییدشده برای این بیماری محسوب میشود.[2][3] این دارو تعدیلکنندهٔ پیرایش آرانای جهت SMN2 است.[2][1][4]
 | |
| نامگذاری آیوپاک | |
|---|---|
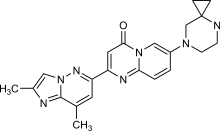
7-(4,7-diazaspiro[2.5]octan-7-yl)-2-(2,8-dimethylimidazo[1,2-b]pyridazin-6-yl)pyrido[1,2-a]pyrimidin-4-one | |
| اطلاعات درمانی | |
| نام تجاری | Evrysdi |
| AHFS/دراگز | monograph |
| اطلاعات مجوز | US Daily Med:پیوند |
| ردهٔ بارداری |
|
| وضعیت قانونی | |
| روش مصرف دارو | دهانی |
| شناسهها | |
| سیایاس | 1825352-65-5 |
| ایتیسی | None |
| پابکم | CID: 118513932 |
| دراگبنک | DB15305 |
| کماسپایدر | 67886354 |
| UNII | 76RS4S2ET1 |
| KEGG | D11406 |
| ChEMBL | CHEMBL4297528 |
| مترادفs | RG7916; RO7034067 |
| اطلاعات شیمیایی | |
| فرمول شیمیایی | C22H23N7O |
| وزن مولکولی | ۴۰۱٫۴۷ g·mol−1 |
| |
عوارض جانبی شایع دارو تب، اسهال، بثورات پوستی، زخم دهان، درد مفصلی و عفونت ادراری است.[2][1] سایر عوارض در نوزادان نیز شامل عفونت دستگاه تنفسی، سینهپهلو، یبوست و استفراغ است.[2][1]
این دارو را سازمان غذا و داروی آمریکا در اوت ۲۰۲۰ برای درمان آتروفی عضلانی نخاعی در کودکان بالای ۲ سال و بالغین تأیید کرد.[2][5] ریزدیپلام با همیاری «پیتیسی تراپوتیکس» و «بنیاد آتروفی عضلانی نخاعی» ساخته شده[3][5] و در ایالات متحده آمریکا توسط شرکت جننتک[2] (از زیرمجموعههای هوفمان-لا روش)[5] بازاریابی میشود.
موارد مصرف
در ایالات متحده آمریکا ریزدیپلام جهت درمان بیماری آتروفی عضلانی نخاعی در بالغین و کودکان بالای ۲ سال مورد پذیرش واقع شدهاست.[2][1]
عوارض جانبی
شایعترین عوارض جانبی این دارو شامل تب، اسهال، زخمهای دهانی آرترالژی و عفونت ادراری است.[2][1] سایر عوارض در شیرخواران عبارتند از: عفونت راههای تنفسی فوقانی، سینه پهلو، یبوست و استفراغ.[2][1]
ریزدیپلام را هرگز نباید بههمراه مشتقات MATE بهکار رود، چرا که سبب افزایش غلطت پلاسمایی این داروها میگردد.[2][1]
مکانیسم عمل
ریزدیپلام، علتِ اصلی بیماری را هدف قرار میدهد: کاهش سطح پروتئین SMN. این پروتئین توسط ژنهای SMN1 و SMN2 کُدگذاری میشود. آتروفی عضلانی نخاعی در اثر جهش ژن SMN1 ایجاد میشود که سبب تولید پروتئینهای SMN ناکارامد و معیوب میگردند. میزان فعالیت ژنهای SMN2 که در حالت عادی، مقدار کمتری از پروتئین SMN را میسازند، تعینکنندهٔ شدت بیماری خواهد بود.[3][6]
ریزدیپلام یک مشتق پیریدازین است که پیرایش آرانای ژن SMN2 را تغییر میدهد[7][4] و با اینکار تولید و غلطت درون سلولی پروتئین SMN را تا دو برابر افزایش میدهد.[8]
داروی نوسینِـرسن نیز که نخستین داروی تاییدشدهٔ درمان این بیماری بود، با روش مشابهی کار میکند.[9]
اثربخشی
بیخطری و اثربخشی ریزدیپلام در آتروفی عضلانی نخاعیِ زودرس و دیررس، طی دو کارآزمایی بالینی در حال بررسی و مطالعه است.[3][10][11]
در کارآزمایی بالینی اول که به روی ۴۱ بیمار مبتلا به نوع زودرس انجام شد، اثربخشی بیماری بر پایه توانایی نشستن بیمار به مدت ۵ ثانیه بدون کمک اطرافیان بررسی شد. پس از ۱۲ ماه درمان، ۲۹٪ بیماران قادر بودند بدون کمک به مدت بیش از ۵ ثانیه بنشینند. پس از ۲۳ ماه درمان یا بیشتر، ۸۱٪ بیمارت بدون تنفس مکانیکی دائمی زنده بودند. با اینکه این کارآزمایی بالینی، بیماران را با گروه دیگری که تحت درمان پلاسیبو باشند، مقایسه نکرد، اما این نتایج با توجه به سیر مورد انتظار از این بیماری در صورت عدم درمان، مطلوب بود.[10][2]
کارآزمایی بالینی دوم که بر روی نوعِ دیررس بیماری انجام شد، یک کارآزمایی تصادفی کنترلشده بود که بر روی ۱۸۰ بیمار در سنین ۲ تا ۲۵ سال که مبتلا به نوع خفیف بیماری بودند، صورت گرفت. بیمارانی که با ریزدیپلام به مدت ۱۲ ماه درمان شدند، بهبود نسبی در عملکرد حرکتی در مقایسه با بیمارانی پیدا کردند که تحت درمان پلاسیبو بودند.[11][2][3]
هماکنون دو کارآزمایی بالینی دیگر در حال انجام است (اوت ۲۰۲۰).[3][5]
جامعه و فرهنگ
وضعیت قانونی
سازمان غذا و داروی آمریکا (FDA) مجوز بازاریابی و فروش این دارو را در ۷ اوت ۲۰۲۰ به شرکت جننتک اعطا کرد. پیشتر، این سازمان درخواستهایی جهت «بررسی تسریع شده»، «داروی اولویتدار» و مجوز داروهای کمکاربرد در سال ۲۰۱۹ دریافت کرده بود.[2][3][5] جننتک یک مجوز «بازبینی داروهای اولویتدار بیماری های نادر اطفال» هم دریافت داشت.[2]
آژانس دارویی اروپا (EMA) یک مجوز «داروی اولویتدار» در سال ۲۰۱۸ میلادی[5][12][13] و یک مجوز داروهای کمکاربرد در سال ۲۰۱۹ به ریزدیپلام داد.[14][5]
از ماه ۲۰۲۰ شرکت هوفمان-لا روش درخواست مجوز بازاریابی و فروش را در کشورهای برزیل، شیلی، چین، اتحادیهٔ اروپا، اندونزی، روسیه، کره جنوبی و تایوان دادهاست.[5][15]
نامها
ریزدیپلام یک نام غیراختصاصی بینالمللی (INN) است.[16]
توزیع خیرخواهانه
از اواخر سال ۲۰۱۹ میلادی، شرکت هوفمان-لا روش این دارو را بهطور مجانی در سرتاسر جهان به افراد واجد شرایط و تحت یک برنامهٔ خیرخواهانه اهدا نموده است.[17]
منابع
- "Evrysdi- risdiplam powder, for solution". DailyMed. 18 August 2020. Retrieved 24 September 2020.
- "FDA Approves Oral Treatment for Spinal Muscular Atrophy". U.S. Food and Drug Administration (FDA) (Press release). 7 August 2020. Retrieved 7 August 2020.
 This article incorporates text from this source, which is in the مالکیت عمومی.
This article incorporates text from this source, which is in the مالکیت عمومی. - "Evrysdi (Risdiplam)". smanewstoday.com. 7 August 2020. Retrieved 8 August 2020.
- Zhao X, Feng Z, Ling KK, Mollin A, Sheedy J, Yeh S, et al. (May 2016). "Pharmacokinetics, pharmacodynamics, and efficacy of a small-molecule SMN2 splicing modifier in mouse models of spinal muscular atrophy". Human Molecular Genetics. 25 (10): 1885–99. doi:10.1093/hmg/ddw062. PMC 5062580. PMID 26931466.
- "FDA Approves Genentech's Evrysdi (risdiplam) for Treatment of Spinal Muscular Atrophy (SMA) in Adults and Children 2 Months and Older". Genentech (Press release). 7 August 2020. Retrieved 7 August 2020.
- Ramdas, Sithara; Servais, Laurent (24 January 2020). "New treatments in spinal muscular atrophy: an overview of currently available data". Expert Opinion on Pharmacotherapy. Informa UK Limited. 21 (3): 307–315. doi:10.1080/14656566.2019.1704732. ISSN 1465-6566. PMID 31973611. S2CID 210880199.
- Maria Joao Almeida (2016-09-08). "RG7916". BioNews Services. Retrieved 2017-10-08.
- Ratni, Hasane; Ebeling, Martin; Baird, John; Bendels, Stefanie; Bylund, Johan; Chen, Karen S.; Denk, Nora; Feng, Zhihua; Green, Luke; Guerard, Melanie; Jablonski, Philippe; Jacobsen, Bjoern; Khwaja, Omar; Kletzl, Heidemarie; Ko, Chien-Ping; Kustermann, Stefan; Marquet, Anne; Metzger, Friedrich; Mueller, Barbara; Naryshkin, Nikolai A.; Paushkin, Sergey V.; Pinard, Emmanuel; Poirier, Agnès; Reutlinger, Michael; Weetall, Marla; Zeller, Andreas; Zhao, Xin; Mueller, Lutz (25 July 2018). "Discovery of Risdiplam, a Selective Survival of Motor Neuron-2 (SMN2) Gene Splicing Modifier for the Treatment of Spinal Muscular Atrophy (SMA)". Journal of Medicinal Chemistry. American Chemical Society (ACS). 61 (15): 6501–6517. doi:10.1021/acs.jmedchem.8b00741. ISSN 0022-2623. PMID 30044619.
- Zanetta C, Nizzardo M, Simone C, Monguzzi E, Bresolin N, Comi GP, et al. (January 2014). "Molecular therapeutic strategies for spinal muscular atrophies: current and future clinical trials". Clinical Therapeutics. 36 (1): 128–40. doi:10.1016/j.clinthera.2013.11.006. PMID 24360800.
- Baranello, G.; Servais, L.; Day, J.; Deconinck, N.; Mercuri, E.; Klein, A.; et al. (October 2019). "P.353FIREFISH Part 1: 16-month safety and exploratory outcomes of risdiplam (RG7916) treatment in infants with type 1 spinal muscular atrophy". Neuromuscular Disorders. 29: S184. doi:10.1016/j.nmd.2019.06.515. ISSN 0960-8966.
- Mercuri, Eugenio; Baranello, Giovanni; Kirschner, Janbernd; Servais, Laurent; Goemans, Nathalie; Pera, Maria Carmela; et al. (April 2019). "Update from SUNFISH Part 1: Safety, Tolerability and PK/PD from the Dose-Finding Study, Including Exploratory Efficacy Data in Patients with Type 2 or 3 Spinal Muscular Atrophy (SMA) Treated with Risdiplam (RG7916) (S25.007)". Neurology. 92 (15 Supplement). ISSN 0028-3878.
- Inacio, Patricia (2018-12-21). "Risdiplam Granted EMA's PRIME Designation for Potential in Spinal Muscular Atrophy". SMA News Today. Retrieved 8 August 2020.
- "PRIME designation granted by European Medicines Agency for Roche's risdiplam for treatment of spinal muscular atrophy (SMA)". Roche (Press release). 17 December 2018. Retrieved 12 August 2020.
- "EU/3/19/2145". European Medicines Agency (EMA). 9 April 2019. Retrieved 12 August 2020.
- "PTC Announces the Acceptance of the European Marketing Authorization Application for Evrysdi (risdiplam) for the Treatment of Spinal Muscular Atrophy". PTC Therapeutics, Inc. Retrieved 2020-08-18.
- World Health Organization (2018). "International nonproprietary names for pharmaceutical substances (INN): recommended INN: list 80". WHO Drug Information. 32 (3): 482. hdl:10665/330907.
- "Roche announces global compassionate use programme for risdiplam". Spinal Muscular Atrophy UK. Retrieved 2020-04-08.
- مشارکتکنندگان ویکیپدیا. «Risdiplam». در دانشنامهٔ ویکیپدیای انگلیسی، بازبینیشده در ۲۹ اکتبر ۲۰۲۰.