آتروفی عضلانی نخاعی
آتروفی عضلانی نخاعی (انگلیسی: Spinal muscular atrophy) یا بهاختصار «SMA» که جهت تمایز آن با سایرِ آتروفیهای عضلانی نخاعی، با نامهای «آتروفی نخاعی عضلات پروگزیمال اتوزومال مغلوب» و «آتروفی عضلانی نخاعی 5q» هم شناخته میشود، یک بیماری عصبی-عضلانی نادر است که با از دست رفتنِ نورونهای حرکتی و تحلیلرفتن عضلات همراه است.[1][2][3] این بیماری در دوران نوازدی یا خردسالی تشخیص داده میشود و در صورت عدم درمان، شایعترین علت ژنتیکی مرگ شیرخواران است.[4] آتروفی عضلانی نخاعی ممکن است خود را در سالهای بعدی زندگی نشان دهد که در این صورت، سیر خفیفتری دارد. شایعترین نشانههای آن، ضعف پیشروندهٔ ماهیچههای ارادی است و عضلات دست، پا و تنفس زودتر از بقیه مبتلا میشوند.[5][6] سایر علائم شامل کنترلِ اندک روی حرکات سر، اشکال در بلع، کژپشتی و سفتشدنِ مفاصل بدن است.[7][6]
| آتروفی عضلانی نخاعی | |
|---|---|
| Synonyms | آتروفی نخاعی عضلات پروگزیمال اتوزومال مغلوب |
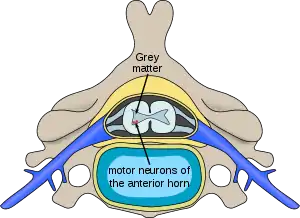 | |
| مکان سلولهای عصبی مبتلا به بیماری در اعصاب نخاعی | |
| طبقهبندی و منابع بیرونی | |
| تخصص | ژنشناسی پزشکی |
| آیسیدی-۱۰ | G12.0-G12.1 |
| آیسیدی-9-CM | 335.0-335.1 |
| اُمیم | ۲۵۳۳۰۰ 253550 253400 271150 |
| دادگان بیماریها | 14093 32911 |
| مدلاین پلاس | 000996 |
| ئیمدیسین | Spinal Muscular Atrophy Spinal Muscle Atrophy Kugelberg–Welander SMA |
| پیشنت پلاس | آتروفی عضلانی نخاعی |
| سمپ | D014897 |
| مرور ژن | |
سنِ آغازِ علائم و شدت آنها دو شاخصی است که با استفاده از آنها، بیماری را به چند نوع مختلف طبقهبندی میکنند.[2]
این بیماری، بهدلیلِ نقص (جهش) در ژن SMN1 ایجاد میشود[8][7] که مسئولِ ساختِ پروتئینی به نام SMN است که در تمامی سلولهای جانداران یوکاریوت وجود دارد و جهت زندهماندنِ نورونهای حرکتی ضروری است.[6] میزان اندکِ این پروتئین در سلولها، مانعِ رسیدن فرامین مغز به ماهیچهها شده[6] و موجب از دست رفتنِ عملکرد طبیعی در سلولهای عصبیِ شاخِ قدامیِ نخاع گشته و سرانجام آتروفی عضلات را در پی دارد. یک ژن دیگر بهنام SMN2، ژن تعدیلکننده شدت بیماری نامیده میشود، چرا که هر قدر میزان آن بیشتر باشد، علائم بیماری خفیفتر است. تشخیص بیماری بر پایهٔ علائم آن است و با انجام آزمایشهای ژنتیکی تأیید میشود.[9][10]
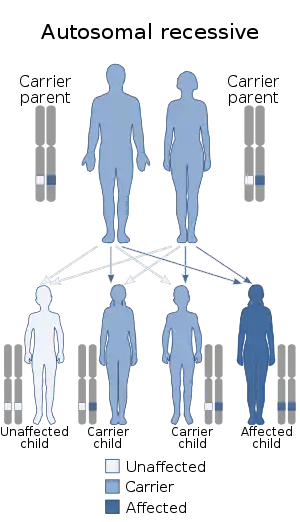
آتروفی عضلانی نخاعی یک بیماری ارثی از سوی هر دو والد است و به صورت اتوزومال مغلوب منتقل میشود. البته در ۲٪ موارد، بیماری در هفتههای نخست زندگی جنین ایجاد میشود و ارثی نیست (جهش جدید).[8][11] نرخ بروز آتروفی عضلانی نخاعی در جهان بین ۱ از ۴٬۰۰۰ تا حدود ۱ از ۱۶٬۰۰۰ تولدِ زنده متغیر است.[12] نرخ بروز در اروپا و ایالات متحده آمریکا بهترتیب ۱ از ۷٬۰۰۰ و ۱ از ۱۰٬۰۰۰ است.[13]
عواقب بیماری بر حسب شدت آن متغیر است: انواع بسیار شدید آن ظرف چند ماه به مرگ میانجامد، اما مبتلایان به انواع خفیف بیماری، امید به زندگی طبیعی دارند. با معرفی درمانهای معطوف به علتِ ریشهایِ بیماری در سال ۲۰۱۶ میلادی، امید به زندگی در این بیماران بهشدت بالا رفتهاست. این داروها عبارتند از نوسینـِرسن، ریزدیپلام و داروی ژندرمانی اوناسِـمنوژن. درمانهای حمایتی نیز شامل فیزیوتراپی، مراقبتهای تنفسی، مراقبتهای تغذیهای، مداخلات ارتوپدی و حمایتهای حرکتی است.[8]
طبقهبندی
این بیماری با شدتهای مختلفی بروز میکند و از نوزادان تا بالغین را درگیر میکند. انواع این بیماری را بر حسب سنِ شروع علائم یا بیشترین میزان دستیابی به تکامل حرکتی بر حسب نشانگرهای آن، به ۳ تا ۵ نوع تقسیم میکنند.
رایجترین طبقهبندی به شرح زیر است:
| نوع | نامبخش | سن رایج آغازِ بیماری | مشخصات | OMIM |
|---|---|---|---|---|
| SMA1 (نوزادی) |
بیماری وردنیگ-هوفمان | صفر تا ۶ ماهگی | فرمِ شدیدِ بیماری در ماهِ اول زندگی و معمولاً بهطور ناگهانی و غیرمنتظرهای، خود را نشان میدهد. (سندرم بچهٔ شُل). مرگِ سریع سلولهای عصبیِ حرکتی، باعث عدم کارایی کافی در اعضای حیاتی بدن - بهویژه در دستگاه تنفس - میشود و نارسایی تنفسی ناشی از سینهپهلو، شایعترین علتِ مرگ است. کودکان مبتلا به این نوع از بیماری، در صورتی که زیر دستگاه تنفس مصنوعی نروند، معمولاً بیشتر از ۲ سال عمر نمیکنند و فرمهای شدید بیماری، اغلب طرف چند هفتهٔ اول نوزاد را از پا درمیآورد. (به این نوعِ بسیار شدیدِ بیماری، «SMA نوع صفر» هم میگویند) اگر حمایتهای تنفسی مناسب انجام شود، آنهایی که فنوتیپهای خفیفتری از نوع ۱ را دارا هستند (که حدود ۱۰ درصدِ موارد SMA1 را شامل میشود) میتوانند تا دوران نوجوانی و بلوغ هم زنده بمانند. | 253300 |
| SMA2 (متوسط) |
بیماری دوبوویتس | ۶ تا ۱۸ ماهگی | نوعِ متوسط بیماری، کودکانی را شامل میشود که هرگز قادر به ایستادن و راهرفتن نخواهند بود، اما دستکم در برههای از زندگیشان، قادر به حفظ وضعیت نشستن هستند. ضعف ماهیچهای نخستین بار، مابین ۶ تا ۱۸ ماهگی بهچشم میآید. سیر پیشرفت بیماری بسیار متفاوت است. برخی از مبتلایان بهتدریج دچار ضعف میشوند و برخی دیگر با مراقبهای دقیق، هرگز پیشرفت نمیکنند. کژپشتی در این کودکان محتمل است و اصلاح آن با پشتبند، میتواند منجر به تنفس بهتر در آنان شود. عضلات بدن ضعیف میشوند و مهمترین نگرانی، دستگاه تنفس است. امید به زندگی تا حدودی کاهشیافتهاست اما بیشتر مبتلایان به نوع ۲ بیماری، تا سنین بلوغ زنده میمانند. | 253550 |
| SMA3 (نوجوانی) |
بیماری کوگلبرگ-وِلاندر | >۱۲ ماهگی | نوع نوجوانی این بیماری، معمولاً پس از ۱ سالگی خود را نشان میدهد. این بیماران در مقطعی از زندگی قادرند بدون کمک راه بروند، با این وجود، بسیاری از آنها این توانایی را بعدها از دست خواهند داد. درگیری دستگاه تنفس در اینها کمتر مشاهده میشود و امید به زندگی طبیعی یا نزدیک به طبیعی است. | 253400 |
| SMA4 (بالغین) |
پس از بلوغ | نوع بالغین بیماری (که گاهی به آن SMA3 دیرهنگام هم میگویند) خود را پس از دههٔ سوم زندگی (بعد از ۳۰ سالگی) بهصورتِ ضعفِ تدریجی عضلات نشان میدهد که بیشتر عضلات پروگزیمال اندام (بازوها و رانها) را درگیر میکند و منجر میشود که فرد برای تحرک، وابسته به صندلی چرخدار شود. عوارض دیگر نادر است و امید به زندگی تغییری نمیکند. | 271150 |
شدیدترین نوع این بیماری را گاهی «SMA نوع صفر» میگویند و در نوزادانی دیده میشود که علیرغم مراقبهای شدید تنفسی، تنها چند هفته زنده میمانند. این نوع از بیماری را نباید با «آتروفی عضلانی نخاعی دیستال نوع ۱» اشتباه کرد که نشانهها و سیرِ مشابهی با SMA دارد، اما علت ژنتیکیاش متفاوت است.
تکامل حرکتی مبتلایان به این بیماری، اغلب توسط معیارهای عملکردی معتبر نظیر «CHOP INTEND» (برای SMA1) و «مقیاس ارزیابی حرکتی» یا یکی از «مقیاسهای عملکرد حرکتی همرسمیت»[14][15][16][17] (برای انواع ۲ و ۳ بیماری) سنجیده و ارزیابی میشود.
عنوانِ «بیماری وردنیگ-هوفمان» نامش را از نخستین توصیفکنندگان این بیماری در کودکان میگیرد که دو عصبشناس آلمانی به نامهای «یوهان هوفمان» و «گیدو وردنیگ» بودند. عنوانِ «بیماری کوگلبرگ-ولاندر» نیز از «هندریک کوگلبرگ» و «لیزا ولاندر»، که نخستین بار این بیماری را از دیستروفی ماهیچهای تمایز دادند، گرفته شدهاست.[18] امروزه از نامِ «بیماری دوبوویتز» (نباید آن را با سندرم دوبوویتز اشتباه کرد) به ندرت استفاده میشود. این بیماری نامش را از عصبشناس انگلیسی ویکتور دوبوویتز میگیرد که چندین مطالعه بر روی نوعِ متوسطِ این بیماری انجام داد.
علائم و نشانهها
علام بیماری بر حسب نوع آن، مرحلهٔ درگیری و فاکتورهای شخصی بسیار متفاوت است و ممکن است شامل موارد زیر باشد:
- کاهش یا فقدان رفلکس، بهویژه در دست و پاها
- ضعف عضلانی، تونوس ماهیچهایِ ضعیف، سستی و شُلبودن
- عدم توانایی در رسیدن به معیارهای طبیعی رشد و تکامل، اشکال در نشستن/ایستادن/راهرفتن
- در کودکان خردسال: اتخاذ وضعیت قورباغهای هنگام نشستن (رانها به طرفین باز، و زانوها خم)
- از دست رفتنِ قدرت ماهیچههای تنفسی: سرفهٔ شُل، گریهٔ ضعیف (نوزادان)، تجمع ترشحات در گلو و ریه، دیسترس تنفسی (تنفس سخت و با زحمتِ فراوان انجام میشود)
- بالاتنهٔ ناقوسمانند (که علتش استفادهٔ انحصاری از عضلات شکم برای تنفس است) در انواعِ خفیفتر بیماری SMA
- لرزش خفیف و موزون در زبان
- اشکال در مکیدن و قورتدادن، دیسفاژی و تغذیهٔ ناکافی و کم
دلایل بروز بیماری
آتروفی عضلانی نخاعی بهدلیلِ جهش در ژن SMN1 بهوجود میآید.[19] بازوی بلندِ کروموزوم شمارهٔ ۵ انسان در جایگاهِ 5q13 خود دارای دو ژنِ تقریباً یکسان است: یک نسخهٔ تلومری به نامِ SMN1 و یک نسخهٔ سانترومری به نامِ SMN2. در افراد سالم، ژنِ SMN1، پروتئینی به نام «پروتئینِ بقایِ سلولِ عصبیِ حرکتی» را کُد میکند که همانطور که از نامش پیداست، نقش حیاتی در بقا و زندهماندنِ سلولهای حرکتی اعصاب دارد. از طرفی، ژنِ SMN2 بهسبب تفاوت در تنها یک نوکلئوتید (840.C→T)، در محلِ اتصالِ اینترون ۶ به اگزون ۸، دچار «پیرایش دگرسان» میشود و بدین ترتیب تنها ۱۰–۲۰٪ از نسخهٔ رونویسی شدهٔ آن، پروتئین کامل و کارآمدِ SMN را میسازد و ۸۰–۹۰٪ بقیه، تنها یک ترکیبِ پروتئینی ناکارآمد و ناقص را ایجاد میکند که «SMNΔ7» نام دارد و بهسرعت، در سلول از بین میرود.
در افراد مبتلا به بیماری، ژنِ SMN1 بهگونهای جهش مییابد که دیگر قادر نیست «پروتئینِ بقایِ سلولِ عصبیِ حرکتی» را بهدرستی بسازد. این جهش یا بهصورتِ حذف در اگزون ۷ است یا اینکه جهش نقطهای رخ میدهد و SMN1 را از لحاظ عملکردی به SMN2 مبدل میسازد. از طرفی تقریباً همهٔ انسانها، دستکم یک نسخهٔ سالم از SMN2 دارند (اغلب افراد ۲ تا ۴ نسخه دارند) که قادر است مقادیر ناچیزی از «پروتئینِ بقایِ سلولِ عصبیِ حرکتی» (حدود ۱۰ تا ۲۰٪ سطح طبیعی آنرا) را کُد کند و بدین ترتیب، برخی از سلولهای عصبی حرکتی زنده میمانند. در طولانیمدت، فقدانِ مقادیرِ کافی از این پروتئین حیاتی، سبب میشود که سلولهای عصبیِ حرکتی، تدریجاً در «شاخ قدامی طناب خاکستری نخاعی» و مغز بمیرند. ماهیچههایی که به این سلولها، از لحاظِ دریافتِ پیام عصبی وابستهاند، آرامآرام شاخههای عصبی خود را از دست میدهند و میزان سیگنالها و پیامهای عصبی که از دستگاه عصبی مرکزی دریافت میدارند، کاهش مییابد. این موضوع سبب میشود که فعالیت انقباضی این ماهیچهها اُفت کرده و بهتدریج دچار آتروفی شوند.
عضلات اندام تحتانی (پاها) زودتر از عضلات اندام فوقانی (دستها) درگیر میشوند. در موارد شدیدِ بیماری، ماهیچههای گردن، ستون فقرات، دستگاه تنفس و ماضغه (جویدن) هم مبتلا میشوند. عضلات پروگزیمال (نزدیک به مرکز) همچون رانها و بازوها، زودتر از عضلات دیستال (دور از مرکز) همچون ساعد، مچ دست و ساق پا گرفتار میشوند.
شدت بیماری بستگی به این دارد که آن ژنهای SMN2 باقیمانده، تا چه میزان قادر به جبرانِ فقدان عملکردیِ ژنهای SMN1 باشند. بخشی از این موضوع به تعدادِ نسخههای ژن SMN2 بر روی کروموزوم بستگی دارد. افراد سالم ۲ نسخه از SMN2 را دارا هستند، حال آنکه مبتلایان به آتروفی عضلانی نخاعی، بین ۱ تا ۴ نسخه (و حتی بیشتر) از SMN2 را دارند. هرچه تعداد نسخههای این ژن بیشتر باشد، بیماری خفیفتر است. نوزادانی که مبتلا به نوع ۱ بیماری هستند (SMA I) معمولاً یک یا دو نسخه از این ژن را دارند؛ در حالی که مبتلایان به نوع ۲ و ۳ بیماری، دستکم سه نسخه و مبتلایان به نوع ۴ بیماری، چهار نسخه از SMN2 را دارا هستند. باید توجه داشت که ارتباط مابین نشانههای بیماری و تعداد نسخههای این ژن مطلق نیست و بهنظر میرسد عوامل دیگری هم هستند که بر روی فنوتیپ (تظاهر) بیماری اثر دارند.[20]
آتروفی عضلانی نخاعی به صورت اتوزومال مغلوب به ارث میرسد و ناگفته پیداست که ژنِ معیوب بر روی اتوزوم واقع است. برای ابتلا به این بیماری، دو نسخهٔ معیوب از ژن SMN1 (یکی از پدر و یکی از مادر) لازم است. ممکن است پدر و مادر «حامل» ژن معیوب باشند و خودشان از آن مطلع نباشند. حدود ۲ تا ۴٪ از آتروفیهای عضلانی نخاعی، علت ارثی ندارد و در اثر جهشهای نوپدید (De novo mutation) در اسپرم، تخمک یا یاخته تخم ایجاد میشود.
آتروفی عضلانی نخاعی در تمامی نژادها و قومیتها دیده میشود؛ برخلافِ برخی از بیماریها نظیر کمخونی داسیشکل و فیبروز سیستیک که در برخی نژادها بسیار شایعتر از دیگران هستند. میزان کلی شیوع این بیماری ۱ در ۱۰٬۰۰۰ است؛ فراوانی آلل در حدود ۱:۱۰۰ است، در نتیجه از هر ۵۰ نفر، یک نفر «حامل» ژن معیوب است.[21][22] حامل بودن بهخودیخود، تأثیری بر سلامتی فرد ندارد و فرد زمانی از حاملبودن خودش مطلع میشود که فرزند مبتلا به بیماری بهدنیا بیاورد یا آنکه از طریق آزمایشهای غربالگری، به این موضوع پی ببرد.
خواهر و برادرهای مبتلا، معمولاً علائم بسیار مشابهی دارند، اما دیده شده که فرزندان یک خانواده، به انواع متفاوتی از SMA دچار شدهاست که گرچه پدیدهای نادر است، اما علتش حذفهای نوپدید در ژن SMN است و نه درگیری ژن NAIP یا تفاوت در تعدادِ نسخههای ژن SMN2.
تشخیص
علائم شدیدترین نوع این بیماری در اواخر دوران بارداری قابل تشخیص است؛ بدین ترتیب که مادر احساس میکند حرکات جنین کم شده یا دیگر وجود ندارد. برخی از علائمِ بیماری، وخیم و بحرانی هستند؛ همچون دیسترس تنفسی و اشکال در شیر خوردن که معمولاً ظرف چند هفته منجر به مرگ میشود. در مقایسه، برخی دیگر از انواعِ بیماری، خفیفتر هستند و ضعف عضلانی تنها پس از چند دهه، به سراغ فرد میآید و با آنکه عمر طبیعی دارند، اما مجبور به استفاده از صندلی چرخدار میشوند.[23]
علائم مهمی که پزشک را به فکر میاندازد و او را، وادار به انجام آزمایشهای ژنتیکی میکند، اینها هستند:
- ضعف عضلانی پیشروندهٔ دوطرفه (معمولاً بازوها و رانها بیشتر از ساعد، مچ دست و ساق پا) بدون هیچ پیشزمینه یا علامت قبلی[23]
- صافشدگی قفسهٔ سینه هنگام تنفس و برآمدگی شکم هنگام انجامِ عملِ «دَم»
- هیپوتونی همراه با فقدان رفلکس
اگر چه علائم فوق، شکِ به SMA را زیاد میکند، اما تشخیص قطعی، تنها با انجامِ آزمایش ژنتیکی (فقدان هر دو اَلل از اگزون ۷ از ژن SMN1) مقدور است. این آزمایش با گرفتن خون از بیمار و انجامِ روش «MLPA» (یکی از روشهای توالیشناسی ژن) صورت میپذیرد که در ضمن، امکان تخمین تعداد نسخههای ژن SMN2 را هم فراهم میآورد.
آزمایشهای پیش از لانهگزینی جنین
امکان انجام آزمایشهای تشخیصی بر روی رویان، پیش از لانهگزینی، در کسانی که از روش لقاح مصنوعی استفاده میکنند، وجود دارد.
در دوران بارداری
تشخیص پیش از تولد با استفاده از روشهای «نمونهگیری از پرزهای جفتی»، «دیانای جنینی غیرسلولی» (cffDNA) و روشهای دیگر انجام میشود.
تشخیص حاملها
افرادی که احتمال میرود حاملِ ژن معیوب باشند و در نتیجه فرزندان بیمار در آینده به دنیا بیاورند، میتوانند با انجام یک آزمایش خون، وضعیت خود را از لحاظ حامل بودن یا نبودن بررسی کنند. «انجمن متخصصان زنان و زایمان آمریکا» توصیه میکند همهٔ افرادی که تصمیم دارند در آینده بچهدار شوند، این آزمایش را انجام دهند.[24]
غربالگری عادی
انجامِ غربالگری روتین مورد بحث و جدل است که علت آن هزینهٔ آزمایشهای ژنتیکی و شدت بیماری است. برخی پژوهشگران میگویند که انجام غربالگری در جمعیت عادی، مقرون به صرفه نیست و این موضوع از صرفِ حدود ۵ میلیون دلار در ایالات متحده آمریکا در سال ۲۰۰۹ میلادی جلوگیری کرد.[25] برخی دیگر میگویند این بیماری، شرایط لازم برای انجام یک چنین غربالگریهایی را دارد و باید برای تمامی زوجها انجام شود.[26]
مراقبتها و مدیریت بیماری
مدیریت بالینی بیماری بر حسب نوع آن و شدت علائم متفاوت است. نوع شدید بیماری (انواع صفر و یک) بیشترین میزانِ ضعف عضلانی را دارا بوده و نیارمند مداخلات فوری درمانی هستند. نوع ۴ بیماری (نوع بالغین) از همه خفیفتر است و ممکن است تا چندین دهه، نیازمند اقدام بخصوصی نباشند.
داروها
داروی نوسینِرسن (با نام تجاریِ اسپینرازا) دارویی است که جهت درمان آتروفی عضلانی نخاعی بهکار میرود.[27] این دارو یک اولیگونوکلئوتید آنتیسنس تغییریافتهٔ فسفوروتیوئات ۲’-O-متوکسیاتیل است که ملکولِ خاموشگرِ پیرایشی N1 اینترونی را هدف قرار داده[23] و فرایند «پیرایش دگرسان» در ژن SMN2 را تعدیل میکند.[27] این دارو از طریق تزریق بداخل کانال نخاعی، مستقیماً به دستگاه عصبی مرکزی وارد میشود[27][28] و عملکرد رشتههای عصبی نوزادان را ارتقا داده و طول عمر آنها را بیشتر میکند.[29] [30] نوسینِرسن در دسامبر ۲۰۱۶ توسط سازمان غذا و دارو آمریکا مورد پذیرش واقع شد[31][32][33] و نخستین داروی تأیید شده برای درمان این بیماری محسوب میشود. کمیسیون اروپا هم آن را در ژوئن ۲۰۱۷ پذیرفت.[34]
اوناسِـمنوژن آبـِپاروُوِک (با نام تجاری زولجنسما) یک داروی ژندرمانی است که با استفاده از نوعی ویروس دستکاریشده با نام scAAV-9، ترانسژن SMN1 را به سلولهای عصبی حمل میکند.[35][36] این روش درمانی در سال ۲۰۱۹ در ایالات متحده آمریکا جهت استفاده در کودکان کمتر از دو سال و به صورت تزریق وریدی تأیید شد[37][38] و یکسال بعد در ژاپن و اتحادیهٔ اروپا هم مورد پذیرش واقع شد.[39][40]
ریزدیپلام داروی دیگری است که بهصورت شربت و از راه دهانی (خوراکی) مصرف میشود.[41][42] این دارو یک مشتق پیریدازین است که کارش افزایش سطح عملکرد پروتئینهای SMN است که توسط ژن SMN2 و از طریق تعدیل فرایند «پیرایش دگرسان» تولید میشوند.[43][44] ریزدیپلام در اوت ۲۰۲۰ میلادی در ایالات متحده آمریکا تأیید شد.[41]
مراقبت تنفسی
دستگاه تنفس شایعترین دستگاهی از بدن مبتلایان است که گرفتار شده و دچار عوارض میشود و در انواع صفر، ۱ و ۲ آن، ممکن است منجر به مرگ شود. نوع ۳ بیماری خیلی به ندرت ممکن است عوارض تنفسی داشته باشند.[45] علت بروز این عوارض، ضعف در ماهیچههای میاندندهای بهدلیل فقدان تحریکِ عصبیِ کافی است. دیافراگم کمتر از ماهیچههای میاندندهای درگیر میشود.[45] این عضلات در اثر ابتلا به بیماری، دیگر هرگز آن کارایی قبلی را در انجام وظایف تنفسی و سرفه نخواهند داشت. در نتیجه عملِ تنفس مشکل میشود و نه تنها خطر اکسیژنرسانی ناکافی وجود دارد، بلکه ترشحهای مجاری تنفسی نیز بهخوبی تخلیه نمیشوند. این مسائل در هنگام خواب که ماهیچهها در حالت استراحت هستند، تشدید میشود. ماهیچههای بلع در حلق هم ممکن است مبتلا شده و منجر به آسپیراسیون ریوی میشود که در کنار تضعیف سرفهها، احتمالِ ابتلا به عفونت و سینهپهلو را افزایش میدهد.[46] به حرکت درآوردنِ ترشحات ریوی و تخلیه آنها، مستلزم انجام فیزیوتراپی تنفسی بهصورت دستی و مکانیکی، تخلیهٔ وضعیتی و دستگاههای کمک به سرفه (دستی، مکانیکی) است. جهت کمک به تنفس بیماران، «تهویهٔ غیرتهاجمی تنفسی» (BiPAP) و در موارد شدید بیماری، «تراکستومی» انجام میشود[47] که هر دو روش، طولِ عمر بیمار را به میزان قابل توجهی، افزایش میدهند؛ اگرچه یک عارضهٔ «تراکستومی» آن است که از ظهور و نموِ «تکلم» جلوگیری میکند.[48]
تغذیه
انواع شدید بیماری، احتمال بیشتری دارد که دچار عوارض تغذیهای شوند. برخی از این عوارض عبارتند از: اشکال در غذاخوردن، بازکردن دهان، جویدن و بلع. نوزادان مبتلا به این عوارض، در معرضِ سوءتغذیه، توقف رشد طبیعی و آسپیراسیون ریوی هستند. سایر مشکلات تغذیهای، بهویژه در آنهایی که تحرک ندارند، شاملِ «عدم عبور بهموقع غذا از معده»، بازگشت اسید به مری، یبوست، استفراغ و نفخ است. به همین دلیل، در نوع ۱ بیماری و همچنین فرمهای شدیدِ نوع ۲، کارگذاری لولهتغذیهٔ معدهای و جراحی گاستروستومی[49][50][51] ضرورت مییابد. علاوه بر اینها، اختلالات متابولیک در این بیماری، بتا اکسیداسیونِ اسیدهای چرب در ماهیچهها را مختل کرده و ارگانیک اسیدوری را در پی دارد که در نهایت، به ماهیچهها آسیب میرساند، بهخصوص هنگامی که بیمار ناشتاست و غذایی نخوردهاست.[52][53] توصیه میشود که بیماران مبتلا به آتروفی عضلانی نخاعی و بهویژه انواع شدید آن، مصرف چربی را کاهش داده و از گرسنهماندنِ طولانیمدت بر حذر باشند. (و حتی نسبت به افراد سالم، چند وعده بیشتر غذا بخورند)[54] و غذاهای نرمتری نیز بخورند تا خطر آسپیراسیون ریوی کمتر شود.[46] در مواقع بیماری حاد، بهخصوص در خردسالان، مشکلات تغذیهای پیش از بقیه، آغاز شده یا ممکن است عوارض دیگر نظیر آسپیراسیون ریوی را تشدید کند.
ارتوپدی
مشکلات اسکلتی گوناگونی که در اثر ضعف ماهیچهای در این بیماران ایجاد میشوند عبارتند از: مفاصلِ سفت با کاهش دامنهٔ حرکتی، دررفتگی لگن خاصره، بدشکلی و انحراف ستون فقرات، پوکی استخوان، درد و افزایش احتمال شکستگی استخوانی.[45] ضعف در عضلاتی که در حالت عادی موجب ثبات مفاصلی همچون ستون مهرهها میشود، منجر به بروز گوژپشتی یا کژپشتی و انقباض موضعی مفاصل میشود.[2] عملِ جوش دادن مهرهها گاهی در انواع ۱ و ۲ بیماری و زمانی که کودکان به سن ۸ تا ۱۰ سالگی رسیدند، جهت تخفیف فشار بر روی ستون فقرات و کمک به عمل تنفس ضرورت مییابد. علاوهبرآن، در بیماران بیتحرک، استفاده از دستگاههای تغییردهندهٔ وضعیت بدن، نرمشهای حرکتی و تقویت استخوانها از موارد مهمی هستند که در کاهش عوارض جانبی بیماری مؤثرند.[55] فیزیوتراپی و کاردرمانی ممکن است در مبتلایان به این بیماری اثراتِ سودمندِ قابل توجهی داشته باشد.
حمایتهای حرکتی
اُرتزها در حمایتهای بدنی و کمک به راهرفتن مؤثرند. بهعنوان نمونه، از اُرتزهای مچ پا (AFO)، جهت تثبیت وضعیت پا و کمک به گامبرداشتن و از اُرتزهای سینهای-کمری-خاجی (TLSO) جهت ثبات وضعیتِ بالاتنه استفاده میشود. فناوریهای یاریرسان در مدیریت وضعیت تحرک بیماران و فعالیتهای روزمره آنها کمک شایانی میکند و کیفیت زندگیشان را بهبود میبخشند.
قلب
گرچه وضعیت قلبی بیماران چندان نگرانکننده نیست، اما برخی پژوهشها حاکی از ارتباط این بیماری، با برخی از عوارض قلبی است.[56][57][58][59]
سلامت ذهنی
کودکان مبتلا به آتروفی عضلانی نخاعی نهتنها تفاوتی از لحاظ رفتاری با افراد سالم ندارند، بلکه تکامل شناختیشان سریعتر رخ داده و در برخی از جنبههای هوش، بالاتر از میانگین جامعه هستند.[60][61][62] علیرغم ناتوانیهای بدنیشان، این بیماران میزان رضایت بیشتری از زندگی را ابراز کردهاند.[63]
مراقبتهای تسکینی در این بیماران، طی «بیانیهٔ مشترک جهت استاندارسازی مراقب در آتروفی عضلانی نخاعی» تبیین شده و تبعیت از آن در سرتاسر جهان توصیه میگردد.
پیشآگهی
بدون درمان دارویی، وضعیت بیماران به تدریج بدتر میشود، اما پیشآگهیِ بیماری بر حسب نوع آن متغیر است و سیر پیشرفت آن نیز، از فردی به فرد دیگر تفاوت دارد.
بیشتر کودکانی که نوع صفر یا ۱ بیماری را دارند، به سن چهار سالگی نمیرسند و اصلیترین علت مرگشان، مشکلات عودکنندهٔ تنفسی است.[64] با مراقبهای مناسب، فرمهای خفیفتر از نوع ۱، (حدود ۱۰ درصد از SMA1) تا دوران بلوغ زنده میمانند.[65] شواهد کافی از بقای طولانیمدت در SMA1 وجود ندارد؛ با این حال، بهنظر میرسد پیشرفتهای بعملآمده در زمینهٔ حمایتهای تنفسی، میزان مرگ و میر را پائین آوردهاست.[66]
در نوع ۲ بیماری، سیر بیماری ثابت است یا به کُندی پیش میرود و امید به زندگی در مقایسه با جمعیت نرمال، کاهش یافتهاست. مرگ پیش از ۲۰ سالگی، زیاد دیده میشود؛ اما بسیاری از مبتلایان به این نوع هستند که خودشان بعدها پدر/مادر یا پدربزرگ/مادربزرگ میشوند.
نوع ۳ بیماری، در صورت انجامِ همهٔ مراقبتهای استاندارد، امید به زندگی طبیعی یا نزدیک به طبیعی دارد.
نوع بالغین بیماری فقط نقشهای حرکتی را بهدنبال دارد و تأثیری بر روی طول عمر آنها ندارد.
مطالعات و پژوهشها
از هنگامی که دلایل ژنتیکی این بیماری در سال ۱۹۹۵ میلادی شناخته شد،[67] چندین روش درمانی برای آن پیشنهاد شدهاست که همگی در حال بررسی و مطالعه هستند. تمرکز همهٔ این روشها، بر افزایشِ میزان پروتئین SMN در سلولهای عصبیِ حرکتی است.[68]
جایگزینی ژن SMN1
هدف از ژندرمانی در مبتلایان به SMA، بازسازی عملکرد ژنِ معیوب از طریق الحاقِ یک توالی نوکلئوتیدی از پیش ساختهشده، (یک ترانسژن SMN1) به درونِ هستهٔ سلول است که از طریق حاملهای ویروسی انجام میشود. حاملهای ویروسی مهمی که هماکنون در دست پژوهش هستند «scAAV-9» و «scAAV-10» نام دارند. در سال ۲۰۱۹ میلادی، درمان مبتنی بر AAV9 مورد پذیرش واقعشد: اوناسِـمنوژن آبـِپاروُوِک[69]
تنها یکی از پژوهشها، به مرحلهٔ بالینی رسیدهاست. مطالعات برای انجام ژندرمانی در «انیستیتو میولوژی» پاریس[70] و دانشگاه آکسفورد هم در حالِ انجام است. در سال ۲۰۱۸ میلادی، بایوژن هم اعلام کرد که مشغول کار بر روی یک داروی ژندرمانی جهت درمانِ آتروفی عضلانی نخاعی است.[71]
تغییر در پیرایش دگرسان SMN2
هدف نهایی در این روش، تغییر دادن نحوهٔ «پیرایش دگرسان» (Alternate Splicing) در ژن SMN2 بهنحوی است که منجر به تولید مقادیر بیشتری از پروتئین SMN شود. گاهی به این روش، «تبدیل ژن» هم میگویند، چرا که تلاش میشود تا ژن SMN2 را از لحاظ عملکردی، به ژنِ SMN1 مبدل سازد.
تغییردهندههای پیرایش دگرسانیِ ذیل، به مرحلهٔ آزمایشهای بالینی رسیدهاست:
- «براناپلام» (LMI070 و یا NVS-SM1) یک مولکول کوچک صناعی و آزمایشی است که بهصورت خوراکی تجویز میشود و توسط شرکت دارویی نوارتیس ساخته شدهاست. تا اکتبر ۲۰۱۷ میلادی، این دارو در فاز ۲ کارآزمایی بالینی در نوزادان مبتلا به نوع ۱ بیماری بودهاست و کارآزماییهای دیگری هم برای سایر مراحل بیماری و بیماران، در حال طراحی است.[72]
- «RG7916» یک مولکول کوچک دارویی است که خوراکی تجویز میشود و با همکاری شرکت دارویی هوفمان-لا روش و «بنیاد SMA» ساخته شدهاست. تا اکتبر ۲۰۱۶ میلادی، این مولکول در فاز ۲ کارآزمایی بالینی، در تمامی گروههای سنی و تمامی انواع بیماری بودهاست.
از میان داروهایی که کارآزماییهایشان متوقف شد میتوان به مولکول دارویی RG8039 (یا کوینازولین ۴۹۵) اشاره کرد که مادهای مشتق از کوینازولین بوده و توسط شرکت دارویی «رپلیژن» تولید و در مارس ۲۰۱۴ میلادی تحت لیسانس فایزر قرار گرفت و ظرف مدت کوتاهی پس از انجام فاز ۱ کارآزمایی بالینی، تولیدش متوقف شد. مولکول دیگر PTK-SMA1 نام داشت که به خانوادهٔ تتراسایکلینها تعلق داشت و توسط شرکت دارویی «پاراتک» تولید شد و قبل از ورود به کارآزمایی بالینی در سال ۲۰۱۰، تولیدش متوقف گشت. داروی RG7800 ملکولی مشابه با RG7916 بود که توسط هوفمان-لا روش ساخته شد و در سال ۲۰۱۵ میلادی بر روی بیماران آزمایش شد، اما تولیدش به دلیل اثرات سمی بر روی مدلهای حیوانی، برای همیشه متوقف شد.
پژوهشهای پایه، ترکیبات دیگری را کشف کردهاند که پیرایش دگرسان SMN2 را بهطور درونکشتگاهی تغییر میدهند که سدیم ارتووانادات[73] و آکلاروبیسین[74] از این دستهاند. اولیگونوکلئوتیدهای آنتیسنس شبه مورفولینو، با همان اهداف سلولی مشابه با داروی نوسینرسن، تحت بررسیهای سخت و گستردهای از جمله در کالج دانشگاهی لندن[75] و دانشگاه آکسفورد[76] هستند.
فعالسازی ژن SMN2
هدف از این روش، افزایش بیانِ ژنی SMN2 و در نتیجه، بالابردن سطحِ تولیدِ پروتئین SMN در بدن است.
- سالبوتامول خوراکی که یکی از داروهای شناختهشدهٔ درمانِ آسم است، هم در مطالعات درونکشتگاهی[77] و هم در سه کارآزمایی کوچک و محدود بالینی، علاوه بر سودمندیهای بالینیاش بر روی دستگاه تنفس، اثرات بالقوهای در درمان آتروفی عضلانی نخاعی نوع ۲ و ۳ داشتهاست.[78][79][80]
چند ترکیب شیمیایی هم، با آنکه در آغاز، اثرات امیدبخشی از خود نشان دادند، اما در کارآزماییهای بالینیِ بعدی نتوانستند اثربخشی خود را نشان دهند:
- بوتیراتها (مثلاً بوتیرات سدیم و فنیبوتیرات سدیم) در مطالعات درونکشتگاهی اثرات مفیدی از خود نشان دادند،[81][82][83] اما در یک کارآزمایی بالینی بر روی بیماران علامتدار، کارآمدی خود را اثبات نکردند.[84] یک کارآزمایی بالینی دیگر در سال ۲۰۱۵ میلادی، در نوزادان مبتلا به نوع ۱ و ۲ بیماری انجام شده که نتایج آن هنوز منتشر نشدهاست.[85]
- والپروئیک اسید در مطالعات آغازین در دهههای ۱۹۹۰ و ۲۰۰۰ میلادی بهطور گستردهای در آزمایشهای تجربی برای درمان SMA بکار میرفت، چرا که بررسیهای درونکشتگاهی نشان داده بود که اثربخشی متوسطی بر روی آن دارد.[86][87] با این حال، در کارآزماییهای بالینی بزرگ بعدی، اثربخشی چندانی از خود نشان ندارد.[88][89][90] برخی دانشمندان میگفتند این دارو بر روی افراد خاصی، اثرگذار است اما تأثیراتش در مبتلایان دیگر، توسط آنزیم ترانسلوکاز اسید چرب متوقف میشود.[91] برخی دیگر از متخصصان بر این باورند که والپروئیک اسید نه تنها اثرات مفیدی ندارد، بلکه باعث تشدید علائم بیماری هم میشود.[92]
- هیدروکسی اوره (هیدروکسیکارباماید) در موشها مؤثر بودهاست[93] و بههمین دلیل شرکت دانمارکی نوو نوردیسک آن را برای مصارف انسانی تحت بررسی و مطالعه قرار داد، اما در نهایت اثرات سودمندی از آن در کارآزماییهای بالینی بر روی بیماران SMA بدست نیامد.[94]
برخی از ترکیبات شیمیایی و داروهایی که بهطور آزمایشگاهی فعالیت ژن SMA2 را زیاد کرده اما به مرحلهٔ کارآزمایی بالینی نرسیدند، عبارتند از: هورمون رشد، بازدارندههای هیستون دِ استیلاز،[95] بنزآمید M344،[96] اسیدهای هیدروکسامیک (همچون CBHA, SBHA، انتینوستات، پانوبینوستات،[97] تریکوستاتین A،[98][99] وُرینوستات[100])، پرولاکتین[101] و همچنین ترکیبات پلیفنل نظیر رسوراترول و کورکومین.[102][103] داروی سلکوکسیب که یک فعالکنندهٔ مسیر p38-MAPK است، گاهی بهصورت «خارج از دستور» (off-label) در درمان این بیماری بکار میرود که مبنای آن، تنها یک پژوهش، بر روی مدلهای حیوانی است،[104] اما چنین استفادهای از این دارو، پشتوانهٔ پژوهشی بالینی ندارد.
تثبیت پروتئین SMN
استحکام بخشیدن به پروتئین SMN، از طریق تثبیت پروتئین SMNΔ7 حاصل میشود که پروتئینی معیوب با نیمهعمر کوتاه در سلول است و توسط ژن SMA2 ساخته میشود تا بدین ترتیب، بخشی از بارِ عملکردیِ پروتئین SMN را بهدوش بکشد و بتواند سلولهای عصبی حرکتی را زنده نگه دارد.[105]
هنوز هیچ دارویی در این زمینه به مرحلهٔ آزمایشهای بالینی نرسیدهاست. توانایی آمینوگلیکوزیدها در بالا بردن سطح پروتئین SMN، در دو مطالعه به اثبات رسیدهاست.[106][107] داروی ایندوپروفن هم در آزمایشهای درونکشتگاهی، امیدبخش بودهاست.[108]
محافظت از عصب
هدف از بهکارگیری «داروهای محافظتکننده از سلولهای عصبی» آن است که حتی علیرغم سطوح پائینِ پروتئین SMN، بتوان سلولهای عصبی حرکتی را زنده نگه داشت.
- داروی اولهسوکسیم یکی از ترکیبات محافظتکنندهٔ نورونی است که توسط شرکت فرانسوی «تروفوس» ساخته شده و در یک کارآزمایی فاز ۲ بالینی بر روی مبتلایان به نوع ۲ و ۳ بیماری، اثرات پایدارکننده خود را بر روی سلولهای عصبی نشان داد. شرکت دارویی هوفمان-لا روش پس از بهمالکیت درآوردن «تروفوس» در سال ۲۰۱۵ میلادی، مشغول توسعه و تولید این داروست.
برخی داروهایی که در مطالعات بالینی، اثربخشی چندانی از این لحاظ، از خود نشان ندادند، عبارتند از: هورمون آزادکننده تیروتروپین که ابتدا در مطالعات بالینی کور نشده (باخبر)، امیدبخش بود[109][110][111] ولی در مطالعات دوسوکور کنترلشده با پلاسبو، هیچگونه اثربخشی از خود نشان نداد.[112] داروی ریلوزول که اثرات بالینی اندکی در درمان بیماری اسکلروز جانبی آمیوتروفیک (ALS) دارد، برای درمان آتروفی عضلانی نخاعی هم پیشنهاد شد،[113][114] ولی یک کارآزمایی بالینی انجامشده بر روی بیماران مبتلا به نوع ۲ و ۳ در سالهای ۲۰۰۸ تا ۲۰۱۰ میلادی،[115] بهدلیل فقدان نتایج رضایتبخش، بهصورت زودهنگام متوقف شد.[116]
برخی از ترکیبات شیمیایی که در مدلهای آزمایشگاهی مؤثر بودند، اما هرگز به مرحله آزمایش بر روی بدن موجود زنده نرسیدند، عبارتند از: آنتیبیوتیکهای بتا-لاکتام (همچون سفتریاکسون)[117][118] و فولیستاتین.[119]
ترمیم عضلانی
هدف از این روش، ترمیم بافت عضلانی در این بیماران و تمرکز بر روی آن، به جای سلولهای عصبی است.
- مولکول CK-2125107 (و یا همان CK-107) یک فعالکنندهٔ تروپونین است که با همکاری شرکت «سایتوکینتیکس» و استلاس ساخته شدهاست. این دارو موجب افزایش واکنشپذیری ماهیچهای، علیرغم سطوح پائین پیامدهیهای عصبی میشود.[120] تا اکتبر ۲۰۱۶ میلادی، این دارو در فاز ۲ کارآزمایی بالینی در نوجوانان و بالغینِ مبتلا به آتروفی عضلانی نخاعی نوع ۲، ۳ و ۴ بود.
سلولهای بنیادی
تا سال ۲۰۱۶ میلادی، هنوز پیشرفت چشمگیری در زمینهٔ استفاده از سلولهای بنیادی در درمان بیماری آتروفی عضلانی نخاعی بدست نیامده است. یک برنامهٔ آزمایشی تجربی بههمین منظور با حمایتهای مالی «جامعهٔ بیماری نخاعی عصبی» توسط یک شرکت آمریکایی بهنام «کالیفرنیا اِستم سِـل» از سال ۲۰۰۵ میلادی آغاز شده بود که در سال ۲۰۱۰ میلادی، بدون آنکه موفق به ورود به مرحلهٔ آزمایشهای بالینی شود، متوقف شد و شرکت مذکور نیز چندی بعد، منحل گشت.
در سال ۲۰۱۳ تا ۲۰۱۴ میلادی، تعدادی اندکی از کودکان مبتلا به نوع ۱ بیماری در ایتالیا با دستور دادگاه و در جریان برنامهٔ عوامفریبانهٔ «استامینا تراپی»، تحت درمان تزریق سلولهای بنیادی قرار گرفتند، اما گزارشهای بعدی حاکی از آن بود که این درمان، هیچ نتیجهای در پی نداشت.[121][122]
با اینکه استفاده از سلولهای بنیادی، هرگز بهعنوان یک روش درمانی مؤثر برای این بیماری، موردِ پذیرش نبودهاست، تعدادی شرکتِ دارویی خصوصی، که اغلب در کشورهایی واقع شدهاند که سیستمهای مقرراتی و نظارتیشان، سست و سهلانگار است، با بهرهجویی از گزافهپردازیها و تبلیغات اغراقآمیزِ رسانهای، از این روش به عنوان یک درمانِ قطعی برای بسیاری از بیماریها - از جمله آتروفی عضلانی نخاعی - نام بردهاند. اجماع علمی و پزشکی بر آن است که چنین روشهایی، نه تنها اثربخش نیست، بلکه خطرهای بالقوه و مهمی را نیز بهدنبال دارند و بنابراین، به مبتلایان توصیه میشود تا چنین روشی را بکار نگیرند.[123][124]
جستارهای وابسته
منابع
- "Spinal muscular atrophy". nhs.uk. 2017-10-23. Retrieved 2020-10-24.
- "Spinal muscular atrophy: MedlinePlus Genetics". medlineplus.gov. Retrieved 2020-10-24.
- "Spinal Muscular Atrophy (SMA) | Boston Children's Hospital". www.childrenshospital.org. Retrieved 2020-10-25.
- "FDA approves innovative gene therapy to treat pediatric patients with spinal muscular atrophy, a rare disease and leading genetic cause of infant mortality". FDA. 24 May 2019. Retrieved 27 May 2019.
- "Spinal Muscular Atrophy Fact Sheet | National Institute of Neurological Disorders and Stroke". NINDS. Retrieved 27 May 2019.
- "Spinal muscular atrophy". Genetics Home Reference. Retrieved 27 May 2019.
- "Spinal Muscular Atrophy". NORD (National Organization for Rare Disorders). Retrieved 27 May 2019.
- "Spinal muscular atrophy". Genetic and Rare Diseases Information Center (GARD) – an NCATS Program. Retrieved 27 May 2019.
- "Spinal Muscular Atrophy - Conditions | Children's National". childrensnational.org. Retrieved 2020-10-25.
- "Spinal muscular atrophy". Genetic and Rare Diseases Information Center (GARD) – an NCATS Program. Retrieved 27 May 2019.
- Prior, Thomas W.; Leach, Meganne E.; Finanger, Erika (1993), Adam, Margaret P.; Ardinger, Holly H.; Pagon, Roberta A.; Wallace, Stephanie E., eds., "Spinal Muscular Atrophy", GeneReviews®, Seattle (WA): University of Washington, Seattle, PMID 20301526, retrieved 2020-10-25
- Verhaart, Ingrid E. C.; Robertson, Agata; Leary, Rebecca; McMacken, Grace; König, Kirsten; Kirschner, Janbernd; Jones, Cynthia C.; Cook, Suzanne F.; Lochmüller, Hanns (July 2017). "A multi-source approach to determine SMA incidence and research ready population". Journal of Neurology. 264 (7): 1465–1473. doi:10.1007/s00415-017-8549-1. ISSN 0340-5354. PMC 5502065. PMID 28634652.
- "Spinal Muscular Atrophy". NORD (National Organization for Rare Disorders). Retrieved 27 May 2019.
- Main, M.; Kairon, H.; Mercuri, E.; Muntoni, F. (2003). "The Hammersmith Functional Motor Scale for Children with Spinal Muscular Atrophy: A Scale to Test Ability and Monitor Progress in Children with Limited Ambulation". European Journal of Paediatric Neurology. 7 (4): 155–159. doi:10.1016/S1090-3798(03)00060-6. PMID 12865054.
- Krosschell, K. J.; Maczulski, J. A.; Crawford, T. O.; Scott, C.; Swoboda, K. J. (2006). "A modified Hammersmith functional motor scale for use in multi-center research on spinal muscular atrophy". Neuromuscular Disorders. 16 (7): 417–426. doi:10.1016/j.nmd.2006.03.015. PMC 3260054. PMID 16750368.
- O'Hagen, J. M.; Glanzman, A. M.; McDermott, M. P.; Ryan, P. A.; Flickinger, J.; Quigley, J.; Riley, S.; Sanborn, E.; Irvine, C.; Martens, W. B.; Annis, C.; Tawil, R.; Oskoui, M.; Darras, B. T.; Finkel, R. S.; De Vivo, D. C. (2007). "An expanded version of the Hammersmith Functional Motor Scale for SMA II and III patients". Neuromuscular Disorders. 17 (9–10): 693–697. doi:10.1016/j.nmd.2007.05.009. PMID 17658255.
- Glanzman, A. M.; O'Hagen, J. M.; McDermott, M. P.; Martens, W. B.; Flickinger, J.; Riley, S.; Quigley, J.; Montes, J.; Dunaway, S.; Deng, L.; Chung, W. K.; Tawil, R.; Darras, B. T.; De Vivo, D. C.; Kaufmann, P.; Finkel, R. S.; Pediatric Neuromuscular Clinical Research Network for Spinal Muscular Atrophy (PNCR) (2011). "Validation of the Expanded Hammersmith Functional Motor Scale in Spinal Muscular Atrophy Type II and III". Journal of Child Neurology. 26 (12): 1499–1507. doi:10.1177/0883073811420294. PMID 21940700.
- Dubowitz, V. (2009). "Ramblings in the history of spinal muscular atrophy". Neuromuscular Disorders. 19 (1): 69–73. doi:10.1016/j.nmd.2008.10.004. PMID 18951794.
- Brzustowicz, L. M.; Lehner, T.; Castilla, L. H.; Penchaszadeh, G. K.; Wilhelmsen, K. C.; Daniels, R.; Davies, K. E.; Leppert, M.; Ziter, F.; Wood, D.; Dubowitz, V.; Zerres, K.; Hausmanowa-Petrusewicz, I.; Ott, J.; Munsat, T. L.; Gilliam, T. C. (1990). "Genetic mapping of chronic childhood-onset spinal muscular atrophy to chromosome 5q11.2–13.3". Nature. 344 (6266): 540–541. Bibcode:1990Natur.344..540B. doi:10.1038/344540a0. PMID 2320125.
- Jędrzejowska, M.; Milewski, M.; Zimowski, J.; Borkowska, J.; Kostera-Pruszczyk, A.; Sielska, D.; Jurek, M.; Hausmanowa-Petrusewicz, I. (2009). "Phenotype modifiers of spinal muscular atrophy: The number of SMN2 gene copies, deletion in the NAIP gene and probably gender influence the course of the disease". Acta Biochimica Polonica. 56 (1): 103–108. PMID 19287802.
- Su, Y. N.; Hung, C. C.; Lin, S. Y.; Chen, F. Y.; Chern, J. P. S.; Tsai, C.; Chang, T. S.; Yang, C. C.; Li, H.; Ho, H. N.; Lee, C. N. (2011). Schrijver, Iris, ed. "Carrier Screening for Spinal Muscular Atrophy (SMA) in 107,611 Pregnant Women during the Period 2005–2009: A Prospective Population-Based Cohort Study". PLoS ONE. 6 (2): e17067. Bibcode:2011PLoSO...617067S. doi:10.1371/journal.pone.0017067. PMC 3045421. PMID 21364876.
- Sugarman, E. A.; Nagan, N.; Zhu, H.; Akmaev, V. R.; Zhou, Z.; Rohlfs, E. M.; Flynn, K.; Hendrickson, B. C.; Scholl, T.; Sirko-Osadsa, D. A.; Allitto, B. A. (2011). "Pan-ethnic carrier screening and prenatal diagnosis for spinal muscular atrophy: Clinical laboratory analysis of>72 400 specimens". European Journal of Human Genetics. 20 (1): 27–32. doi:10.1038/ejhg.2011.134. PMC 3234503. PMID 21811307.
- Ottesen EW (January 2017). "ISS-N1 makes the First FDA-approved Drug for Spinal Muscular Atrophy". Translational Neuroscience. 8 (1): 1–6. doi:10.1515/tnsci-2017-0001. PMC 5382937. PMID 28400976.
- "Carrier Screening in the Age of Genomic Medicine - ACOG". www.acog.org. Retrieved 24 February 2017.
- Little, S. E.; Janakiraman, V.; Kaimal, A.; Musci, T.; Ecker, J.; Caughey, A. B. (2010). "The cost-effectiveness of prenatal screening for spinal muscular atrophy". American Journal of Obstetrics and Gynecology. 202 (3): 253.2e1. doi:10.1016/j.ajog.2010.01.032. PMID 20207244.
- Prior, T. W.; Professional Practice Guidelines Committee (2008). "Carrier screening for spinal muscular atrophy". Genetics in Medicine. 10 (11): 840–842. doi:10.1097/GIM.0b013e318188d069. PMC 3110347. PMID 18941424.
- "Spinraza- nusinersen injection, solution". DailyMed. 30 June 2020. Retrieved 8 August 2020.
- Grant, Charley (2016-12-27). "Surprise Drug Approval Is Holiday Gift for Biogen". The Wall Street Journal. ISSN 0099-9660. Retrieved 2016-12-27.
- Finkel RS, Mercuri E, Darras BT, Connolly AM, Kuntz NL, Kirschner J, et al. (November 2017). "Nusinersen versus Sham Control in Infantile-Onset Spinal Muscular Atrophy". New England Journal of Medicine. 377 (18): 1723–32. doi:10.1056/NEJMoa1702752. PMID 29091570. S2CID 4771819.
- Wadman, Renske I.; van der Pol, W. Ludo; Bosboom, Wendy Mj; Asselman, Fay-Lynn; van den Berg, Leonard H.; Iannaccone, Susan T.; Vrancken, Alexander Fje (1 June 2020). "Drug treatment for spinal muscular atrophy types II and III". The Cochrane Database of Systematic Reviews. 1: CD006282. doi:10.1002/14651858.CD006282.pub5. ISSN 1469-493X. PMC 6995983 Check
|pmc=value (help). PMID 32006461. - Grant, Charley (2016-12-27). "Surprise Drug Approval Is Holiday Gift for Biogen". Wall Street Journal. ISSN 0099-9660. Retrieved 2016-12-27.
- "Spinraza (nusinersen) Injection". U.S. Food and Drug Administration (FDA). 18 January 2017. Retrieved 8 August 2020.
- "Spinraza EPAR". European Medicines Agency (EMA). Retrieved 8 August 2020.
- "SPINRAZA® (Nusinersen) Approved in the European Union as First Treatment for Spinal Muscular Atrophy". AFP. 2017-06-01. Retrieved 2017-06-01.
- "Zolgensma 2 x 1013 vector genomes/mL solution for infusion". www.medicines.org.uk. Retrieved 8 August 2020.
- "Zolgensma- onasemnogene abeparvovec-xioi kit". DailyMed. 24 May 2019. Retrieved 8 August 2020.
- "FDA approves innovative gene therapy to treat pediatric patients with spinal muscular atrophy, a rare disease and leading genetic cause of infant mortality". U.S. Food and Drug Administration (FDA) (Press release). 24 May 2019. Retrieved 27 May 2019.
 This article incorporates text from this source, which is in the مالکیت عمومی.
This article incorporates text from this source, which is in the مالکیت عمومی. - "Zolgensma". U.S. Food and Drug Administration (FDA). 24 May 2019. Retrieved 8 August 2020.
- "Zolgensma EPAR". European Medicines Agency (EMA). 24 March 2020. Retrieved 8 August 2020.
- "Novartis receives approval from Japanese Ministry of Health, Labour and Welfare for Zolgensma the only gene therapy for patients with spinal muscular atrophy (SMA)". Novartis (Press release). Retrieved 8 August 2020.
- "FDA Approves Oral Treatment for Spinal Muscular Atrophy". U.S. Food and Drug Administration (FDA) (Press release). 7 August 2020. Retrieved 7 August 2020.
- "Evrysdi (risdiplam) for oral solution" (PDF). Genentech. Retrieved 8 August 2020.
- Maria Joao Almeida (2016-09-08). "RG7916". BioNews Services. Retrieved 2017-10-08.
- Zhao X, Feng Z, Ling KK, Mollin A, Sheedy J, Yeh S, et al. (May 2016). "Pharmacokinetics, pharmacodynamics, and efficacy of a small-molecule SMN2 splicing modifier in mouse models of spinal muscular atrophy". Human Molecular Genetics. 25 (10): 1885–1899. doi:10.1093/hmg/ddw062. PMC 5062580. PMID 26931466.
- Wang, Ching (Summer 2007). "Consensus Statement for Standard of Care in Spinal Muscular Atrophy". Journal of Child Neurology. 22 – via PubMed.
- Bodamer, olaf (November 2017). "Spinal Muscular Atrophy". uptodate.com. Retrieved December 1, 2017.
- Bach, J. R.; Niranjan, V.; Weaver, B. (2000). "Spinal Muscular Atrophy Type 1: A Noninvasive Respiratory Management Approach". Chest. 117 (4): 1100–1105. doi:10.1378/chest.117.4.1100. PMID 10767247.
- Bach, J. R.; Saltstein, K.; Sinquee, D.; Weaver, B.; Komaroff, E. (2007). "Long-Term Survival in Werdnig–Hoffmann Disease". American Journal of Physical Medicine & Rehabilitation. 86 (5): 339–45 quiz 346–8, 379. doi:10.1097/PHM.0b013e31804a8505. PMID 17449977.
- Messina, S.; Pane, M.; De Rose, P.; Vasta, I.; Sorleti, D.; Aloysius, A.; Sciarra, F.; Mangiola, F.; Kinali, M.; Bertini, E.; Mercuri, E. (2008). "Feeding problems and malnutrition in spinal muscular atrophy type II". Neuromuscular Disorders. 18 (5): 389–393. doi:10.1016/j.nmd.2008.02.008. PMID 18420410.
- Chen, Y. S.; Shih, H. H.; Chen, T. H.; Kuo, C. H.; Jong, Y. J. (2011). "Prevalence and Risk Factors for Feeding and Swallowing Difficulties in Spinal Muscular Atrophy Types II and III". The Journal of Pediatrics. 160 (3): 447–451.e1. doi:10.1016/j.jpeds.2011.08.016. PMID 21924737.
- Tilton, A.; Miller, M.; Khoshoo, V. (1998). "Nutrition and swallowing in pediatric neuromuscular patients". Seminars in Pediatric Neurology. 5 (2): 106–115. doi:10.1016/S1071-9091(98)80026-0. PMID 9661244.
- Tein, I.; Sloane, A. E.; Donner, E. J.; Lehotay, D. C.; Millington, D. S.; Kelley, R. I. (1995). "Fatty acid oxidation abnormalities in childhood-onset spinal muscular atrophy: Primary or secondary defect(s)?". Pediatric neurology. 12 (1): 21–30. doi:10.1016/0887-8994(94)00100-G. PMID 7748356.
- Crawford, T. O.; Sladky, J. T.; Hurko, O.; Besner-Johnston, A.; Kelley, R. I. (1999). "Abnormal fatty acid metabolism in childhood spinal muscular atrophy". Annals of Neurology. 45 (3): 337–343. doi:10.1002/1531-8249(199903)45:3<337::AID-ANA9>3.0.CO;2-U. PMID 10072048.
- Leighton, S. (2003). "Nutrition issues associated with spinal muscular atrophy". Nutrition & Dietetics. 60 (2): 92–96.
- Apkon, Susan (Summer 2017). "SMA CARE SERIES - Musculoskeletal System" (PDF). www.curesma.org. Archived from the original (PDF) on 19 February 2018.
- Rudnik-Schoneborn, S.; Heller, R.; Berg, C.; Betzler, C.; Grimm, T.; Eggermann, T.; Eggermann, K.; Wirth, R.; Wirth, B.; Zerres, K. (2008). "Congenital heart disease is a feature of severe infantile spinal muscular atrophy". Journal of Medical Genetics. 45 (10): 635–638. doi:10.1136/jmg.2008.057950. PMID 18662980.
- Heier, C. R.; Satta, R.; Lutz, C.; Didonato, C. J. (2010). "Arrhythmia and cardiac defects are a feature of spinal muscular atrophy model mice". Human Molecular Genetics. 19 (20): 3906–3918. doi:10.1093/hmg/ddq330. PMC 2947406. PMID 20693262.
- Shababi, M.; Habibi, J.; Yang, H. T.; Vale, S. M.; Sewell, W. A.; Lorson, C. L. (2010). "Cardiac defects contribute to the pathology of spinal muscular atrophy models". Human Molecular Genetics. 19 (20): 4059–4071. doi:10.1093/hmg/ddq329. PMID 20696672.
- Bevan, A. K.; Hutchinson, K. R.; Foust, K. D.; Braun, L.; McGovern, V. L.; Schmelzer, L.; Ward, J. G.; Petruska, J. C.; Lucchesi, P. A.; Burghes, A. H. M.; Kaspar, B. K. (2010). "Early heart failure in the SMNΔ7 model of spinal muscular atrophy and correction by postnatal scAAV9-SMN delivery". Human Molecular Genetics. 19 (20): 3895–3905. doi:10.1093/hmg/ddq300. PMC 2947399. PMID 20639395.
- Von Gontard, A.; Zerres, K.; Backes, M.; Laufersweiler-Plass, C.; Wendland, C.; Melchers, P.; Lehmkuhl, G.; Rudnik-Schöneborn, S. (2002). "Intelligence and cognitive function in children and adolescents with spinal muscular atrophy". Neuromuscular Disorders. 12 (2): 130–136. doi:10.1016/S0960-8966(01)00274-7. PMID 11738354.
- Billard, C.; Gillet, P.; Signoret, J. L.; Uicaut, E.; Bertrand, P.; Fardeau, M.; Barthez-Carpentier, M. A.; Santini, J. J. (1992). "Cognitive functions in duchenne muscular dystrophy: A reappraisal and comparison with spinal muscular atrophy". Neuromuscular Disorders. 2 (5–6): 371–378. doi:10.1016/S0960-8966(06)80008-8. PMID 1300185.
- Laufersweiler-Plass, C.; Rudnik-Schöneborn, S.; Zerres, K.; Backes, M.; Lehmkuhl, G.; Von Gontard, A. (2002). "Behavioural problems in children and adolescents with spinal muscular atrophy and their siblings". Developmental Medicine & Child Neurology. 45. doi:10.1017/S0012162203000082.
- De Oliveira, C. M.; Araújo, A. P. D. Q. C. (2011). "Self-reported quality of life has no correlation with functional status in children and adolescents with spinal muscular atrophy". European Journal of Paediatric Neurology. 15 (1): 36–39. doi:10.1016/j.ejpn.2010.07.003. PMID 20800519.
- Yuan, N.; Wang, C. H.; Trela, A.; Albanese, C. T. (2007). "Laparoscopic Nissen Fundoplication During Gastrostomy Tube Placement and Noninvasive Ventilation May Improve Survival in Type I and Severe Type II Spinal Muscular Atrophy". Journal of Child Neurology. 22 (6): 727–731. doi:10.1177/0883073807304009. PMID 17641258.
- Bach, J. R. (2007). "Medical Considerations of Long-Term Survival of Werdnig–Hoffmann Disease". American Journal of Physical Medicine & Rehabilitation. 86 (5): 349–55. doi:10.1097/PHM.0b013e31804b1d66. PMID 17449979.
- Oskoui, M; Levy, G; Garland, C. J.; Gray, J. M.; O'Hagen, J; De Vivo, D. C.; Kaufmann, P (2007). "The changing natural history of spinal muscular atrophy type 1". Neurology. 69 (20): 1931–6. doi:10.1212/01.wnl.0000290830.40544.b9. PMID 17998484.
- Lefebvre, Suzie; Bürglen, Lydie; Reboullet, Sophie; Clermont, Olivier; Burlet, Philippe; Viollet, Louis; Benichou, Bernard; Cruaud, Corinne; Millasseau, Philippe (1995). "Identification and characterization of a spinal muscular atrophy-determining gene". Cell. 80 (1): 155–165. doi:10.1016/0092-8674(95)90460-3. PMID 7813012.
- d’Ydewalle, Constantin; Sumner, Charlotte J. (2015-01-29). "Spinal Muscular Atrophy Therapeutics: Where do we Stand?". Neurotherapeutics. 12 (2): 303–316. doi:10.1007/s13311-015-0337-y. ISSN 1933-7213. PMC 4404440. PMID 25631888.
- "$2.1m Novartis gene therapy to become world's most expensive drug". The Guardian. Reuters. 2019-05-25. ISSN 0261-3077.
- Benkhelifa-Ziyyat, Sofia; Besse, Aurore; Roda, Marianne; Duque, Sandra; Astord, Stéphanie; Carcenac, Romain; Marais, Thibaut; Barkats, Martine (2013). "Intramuscular scAAV9-SMN Injection Mediates Widespread Gene Delivery to the Spinal Cord and Decreases Disease Severity in SMA Mice". Molecular Therapy. 21 (2): 282–290. doi:10.1038/mt.2012.261. PMC 3594018. PMID 23295949.
- "Biogen Releases Community Statement on Spinraza Access and New Data | Cure SMA". www.curesma.org. Archived from the original on 19 July 2019. Retrieved 2018-09-11.
- "Novartis Releases Update on LMI070 (Branaplam) Clinical Trial". CureSMA. Archived from the original on 25 November 2017. Retrieved 2017-10-07.
- Zhang, M. L.; Lorson, C. L.; Androphy, E. J.; Zhou, J. (2001). "An in vivo reporter system for measuring increased inclusion of exon 7 in SMN2 mRNA: Potential therapy of SMA". Gene Therapy. 8 (20): 1532–1538. doi:10.1038/sj.gt.3301550. PMID 11704813.
- Andreassi, C.; Jarecki, J.; Zhou, J.; Coovert, D. D.; Monani, U. R.; Chen, X.; Whitney, M.; Pollok, B.; Zhang, M.; Androphy, E.; Burghes, A. H. (2001). "Aclarubicin treatment restores SMN levels to cells derived from type I spinal muscular atrophy patients". Human Molecular Genetics. 10 (24): 2841–2849. doi:10.1093/hmg/10.24.2841. PMID 11734549.
- Zhou, Haiyan; Meng, Jinhong; Marrosu, Elena; Janghra, Narinder; Morgan, Jennifer; Muntoni, Francesco (2015). "Repeated low doses of morpholino antisense oligomer: An intermediate mouse model of spinal muscular atrophy to explore the window of therapeutic response". Human Molecular Genetics. 24 (22): 6265–77, 6265. doi:10.1093/hmg/ddv329. PMC 4614699. PMID 26264577.
- Hammond, Suzan M.; Hazell, Gareth; Shabanpoor, Fazel; Saleh, Amer F.; Bowerman, Melissa; Sleigh, James N.; Meijboom, Katharina E.; Zhou, Haiyan; Muntoni, Francesco (2016-09-27). "Systemic peptide-mediated oligonucleotide therapy improves long-term survival in spinal muscular atrophy". Proceedings of the National Academy of Sciences. 113 (39): 10962–10967. doi:10.1073/pnas.1605731113. ISSN 0027-8424. PMC 5047168. PMID 27621445.
- Angelozzi, C.; Borgo, F.; Tiziano, F. D.; Martella, A.; Neri, G.; Brahe, C. (2007). "Salbutamol increases SMN mRNA and protein levels in spinal muscular atrophy cells". Journal of Medical Genetics. 45 (1): 29–31. doi:10.1136/jmg.2007.051177. PMID 17932121.
- Pane, M.; Staccioli, S.; Messina, S.; d'Amico, A.; Pelliccioni, M.; Mazzone, E. S.; Cuttini, M.; Alfieri, P.; Battini, R.; Main, M.; Muntoni, F.; Bertini, E.; Villanova, M.; Mercuri, E. (2008). "Daily salbutamol in young patients with SMA type II". Neuromuscular Disorders. 18 (7): 536–540. doi:10.1016/j.nmd.2008.05.004. PMID 18579379.
- Tiziano, F. D.; Lomastro, R.; Pinto, A. M.; Messina, S.; d'Amico, A.; Fiori, S.; Angelozzi, C.; Pane, M.; Mercuri, E.; Bertini, E.; Neri, G.; Brahe, C. (2010). "Salbutamol increases survival motor neuron (SMN) transcript levels in leucocytes of spinal muscular atrophy (SMA) patients: Relevance for clinical trial design". Journal of Medical Genetics. 47 (12): 856–858. doi:10.1136/jmg.2010.080366. PMID 20837492.
- Morandi, L. (2013). "P.6.4 Salbutamol tolerability and efficacy in adult type III SMA patients: Results of a multicentric, molecular and clinical, double-blind, placebo-controlled study". Neuromuscular Disorders. 23 (9–10): 771. doi:10.1016/j.nmd.2013.06.475.
- Chang, J. -G.; Hsieh-Li, H. -M.; Jong, Y. -J.; Wang, N. M.; Tsai, C. -H.; Li, H. (2001). "Treatment of spinal muscular atrophy by sodium butyrate". Proceedings of the National Academy of Sciences. 98 (17): 9808–9813. Bibcode:2001PNAS...98.9808C. doi:10.1073/pnas.171105098.
- Andreassi, C.; Angelozzi, C.; Tiziano, F. D.; Vitali, T.; De Vincenzi, E.; Boninsegna, A.; Villanova, M.; Bertini, E.; Pini, A.; Neri, G.; Brahe, C. (2003). "Phenylbutyrate increases SMN expression in vitro: Relevance for treatment of spinal muscular atrophy". European Journal of Human Genetics. 12 (1): 59–65. doi:10.1038/sj.ejhg.5201102. PMID 14560316.
- Brahe, C.; Vitali, T.; Tiziano, F. D.; Angelozzi, C.; Pinto, A. M.; Borgo, F.; Moscato, U.; Bertini, E.; Mercuri, E.; Neri, G. (2004). "Phenylbutyrate increases SMN gene expression in spinal muscular atrophy patients". European Journal of Human Genetics. 13 (2): 256–259. doi:10.1038/sj.ejhg.5201320. PMID 15523494.
- Mercuri, E.; Bertini, E.; Messina, S.; Solari, A.; d'Amico, A.; Angelozzi, C.; Battini, R.; Berardinelli, A.; Boffi, P.; Bruno, C.; Cini, C.; Colitto, F.; Kinali, M.; Minetti, C.; Mongini, T.; Morandi, L.; Neri, G.; Orcesi, S.; Pane, M.; Pelliccioni, M.; Pini, A.; Tiziano, F. D.; Villanova, M.; Vita, G.; Brahe, C. (2007). "Randomized, double-blind, placebo-controlled trial of phenylbutyrate in spinal muscular atrophy". Neurology. 68 (1): 51–55. doi:10.1212/01.wnl.0000249142.82285.d6. PMID 17082463.
- "Study to Evaluate Sodium Phenylbutyrate in Pre-symptomatic Infants With Spinal Muscular Atrophy (STOPSMA)". Retrieved 28 December 2011.
- Brichta, L.; Hofmann, Y.; Hahnen, E.; Siebzehnrubl, F. A.; Raschke, H.; Blumcke, I.; Eyupoglu, I. Y.; Wirth, B. (2003). "Valproic acid increases the SMN2 protein level: A well-known drug as a potential therapy for spinal muscular atrophy". Human Molecular Genetics. 12 (19): 2481–2489. doi:10.1093/hmg/ddg256. PMID 12915451.
- Tsai, L. K.; Tsai, M. S.; Ting, C. H.; Li, H. (2008). "Multiple therapeutic effects of valproic acid in spinal muscular atrophy model mice". Journal of Molecular Medicine. 86 (11): 1243–1254. doi:10.1007/s00109-008-0388-1. PMID 18649067.
- Swoboda, K. J.; Scott, C. B.; Crawford, T. O.; Simard, L. R.; Reyna, S. P.; Krosschell, K. J.; Acsadi, G.; Elsheik, B.; Schroth, M. K.; d'Anjou, G.; Lasalle, B.; Prior, T. W.; Sorenson, S. L.; MacZulski, J. A.; Bromberg, M. B.; Chan, G. M.; Kissel, J. T.; Project Cure Spinal Muscular Atrophy Investigators Network (2010). Boutron, Isabelle, ed. "SMA CARNI-VAL Trial Part I: Double-Blind, Randomized, Placebo-Controlled Trial of L-Carnitine and Valproic Acid in Spinal Muscular Atrophy". PLoS ONE. 5 (8): e12140. Bibcode:2010PLoSO...512140S. doi:10.1371/journal.pone.0012140. PMC 2924376. PMID 20808854.
- Kissel, J. T.; Scott, C. B.; Reyna, S. P.; Crawford, T. O.; Simard, L. R.; Krosschell, K. J.; Acsadi, G.; Elsheik, B.; Schroth, M. K.; d'Anjou, G.; Lasalle, B.; Prior, T. W.; Sorenson, S.; MacZulski, J. A.; Bromberg, M. B.; Chan, G. M.; Swoboda, K. J.; Project Cure Spinal Muscular Atrophy Investigators' Network (2011). Feany, Mel B., ed. "SMA CARNI-VAL TRIAL PART II: A Prospective, Single-Armed Trial of L-Carnitine and Valproic Acid in Ambulatory Children with Spinal Muscular Atrophy". PLoS ONE. 6 (7): e21296. Bibcode:2011PLoSO...621296K. doi:10.1371/journal.pone.0021296. PMC 3130730. PMID 21754985.
- Darbar, I. A.; Plaggert, P. G.; Resende, M. B. D.; Zanoteli, E.; Reed, U. C. (2011). "Evaluation of muscle strength and motor abilities in children with type II and III spinal muscle atrophy treated with valproic acid". BMC Neurology. 11: 36. doi:10.1186/1471-2377-11-36. PMC 3078847. PMID 21435220.
- Garbes, L.; Heesen, L.; Holker, I.; Bauer, T.; Schreml, J.; Zimmermann, K.; Thoenes, M.; Walter, M.; Dimos, J.; Peitz, M.; Brustle, O.; Heller, R.; Wirth, B. (2012). "VPA response in SMA is suppressed by the fatty acid translocase CD36". Human Molecular Genetics. 22 (2): 398–407. doi:10.1093/hmg/dds437. PMID 23077215.
- Rak, K.; Lechner, B. D.; Schneider, C.; Drexl, H.; Sendtner, M.; Jablonka, S. (2009). "Valproic acid blocks excitability in SMA type I mouse motor neurons". Neurobiology of Disease. 36 (3): 477–487. doi:10.1016/j.nbd.2009.08.014. PMID 19733665.
- Grzeschik, S. M.; Ganta, M.; Prior, T. W.; Heavlin, W. D.; Wang, C. H. (2010). "Hydroxyurea enhances SMN2 gene expression in spinal muscular atrophy cells". Annals of Neurology. 58 (2): 194–202. doi:10.1002/ana.20548. PMID 16049920.
- Chen, T. - H.; Chang, J. - G.; Yang, Y. - H.; Mai, H. - H.; Liang, W. - C.; Wu, Y. - C.; Wang, H. - Y.; Huang, Y. - B.; Wu, S. - M.; Chen, Y. - C.; Yang, S. - N.; Jong, Y. - J. (2010). "Randomized, double-blind, placebo-controlled trial of hydroxyurea in spinal muscular atrophy". Neurology. 75 (24): 2190–2197. doi:10.1212/WNL.0b013e3182020332. PMID 21172842.
- Evans, M. C.; Cherry, J. J.; Androphy, E. J. (2011). "Differential regulation of the SMN2 gene by individual HDAC proteins". Biochemical and Biophysical Research Communications. 414 (1): 25–30. doi:10.1016/j.bbrc.2011.09.011. PMID 21925145.
- Riessland, M.; Brichta, L.; Hahnen, E.; Wirth, B. (2006). "The benzamide M344, a novel histone deacetylase inhibitor, significantly increases SMN2 RNA/protein levels in spinal muscular atrophy cells". Human Genetics. 120 (1): 101–110. doi:10.1007/s00439-006-0186-1. PMID 16724231.
- Garbes, L.; Riessland, M.; Hölker, I.; Heller, R.; Hauke, J.; Tränkle, C.; Coras, R.; Blümcke, I.; Hahnen, E.; Wirth, B. (2009). "LBH589 induces up to 10-fold SMN protein levels by several independent mechanisms and is effective even in cells from SMA patients non-responsive to valproate". Human Molecular Genetics. 18 (19): 3645–3658. doi:10.1093/hmg/ddp313. PMID 19584083.
- Narver, H. L.; Kong, L.; Burnett, B. G.; Choe, D. W.; Bosch-Marcé, M.; Taye, A. A.; Eckhaus, M. A.; Sumner, C. J. (2008). "Sustained improvement of spinal muscular atrophy mice treated with trichostatin a plus nutrition". Annals of Neurology. 64 (4): 465–470. doi:10.1002/ana.21449. PMID 18661558.
- Avila, A. M.; Burnett, B. G.; Taye, A. A.; Gabanella, F.; Knight, M. A.; Hartenstein, P.; Cizman, Z.; Di Prospero, N. A.; Pellizzoni, L.; Fischbeck, K. H.; Sumner, C. J. (2007). "Trichostatin a increases SMN expression and survival in a mouse model of spinal muscular atrophy". Journal of Clinical Investigation. 117 (3): 659–671. doi:10.1172/JCI29562. PMC 1797603. PMID 17318264.
- Riessland, M.; Ackermann, B.; Förster, A.; Jakubik, M.; Hauke, J.; Garbes, L.; Fritzsche, I.; Mende, Y.; Blumcke, I.; Hahnen, E.; Wirth, B. (2010). "SAHA ameliorates the SMA phenotype in two mouse models for spinal muscular atrophy". Human Molecular Genetics. 19 (8): 1492–1506. doi:10.1093/hmg/ddq023. PMID 20097677.
- Farooq, F.; Molina, F. A. A.; Hadwen, J.; MacKenzie, D.; Witherspoon, L.; Osmond, M.; Holcik, M.; MacKenzie, A. (2011). "Prolactin increases SMN expression and survival in a mouse model of severe spinal muscular atrophy via the STAT5 pathway". Journal of Clinical Investigation. 121 (8): 3042–3050. doi:10.1172/JCI46276. PMC 3148738. PMID 21785216.
- Sakla, M. S.; Lorson, C. L. (2007). "Induction of full-length survival motor neuron by polyphenol botanical compounds". Human Genetics. 122 (6): 635–643. doi:10.1007/s00439-007-0441-0. PMID 17962980.
- Dayangaç-Erden, D.; Bora, G.; Ayhan, P.; Kocaefe, Ç.; Dalkara, S.; Yelekçi, K.; Demir, A. S.; Erdem-Yurter, H. (2009). "Histone Deacetylase Inhibition Activity and Molecular Docking of (E)-Resveratrol: Its Therapeutic Potential in Spinal Muscular Atrophy". Chemical Biology & Drug Design. 73 (3): 355–364. doi:10.1111/j.1747-0285.2009.00781.x.
- Farooq, F.; Abadia-Molina, F.; MacKenzie, D.; Hadwen, J.; Shamim, F.; O'Reilly, S.; Holcik, M.; MacKenzie, A. (2013). "Celecoxib increases SMN and survival in a severe spinal muscular atrophy mouse model via p38 pathway activation". Human Molecular Genetics. 22 (17): 3415–3424. doi:10.1093/hmg/ddt191. PMID 23656793.
- Burnett, B. G.; Munoz, E.; Tandon, A.; Kwon, D. Y.; Sumner, C. J.; Fischbeck, K. H. (2008). "Regulation of SMN Protein Stability". Molecular and Cellular Biology. 29 (5): 1107–1115. doi:10.1128/MCB.01262-08. PMC 2643817. PMID 19103745.
- Mattis, V. B.; Rai, R.; Wang, J.; Chang, C. W. T.; Coady, T.; Lorson, C. L. (2006). "Novel aminoglycosides increase SMN levels in spinal muscular atrophy fibroblasts". Human Genetics. 120 (4): 589–601. doi:10.1007/s00439-006-0245-7. PMID 16951947.
- Mattis, V. B.; Fosso, M. Y.; Chang, C. W.; Lorson, C. L. (2009). "Subcutaneous administration of TC007 reduces disease severity in an animal model of SMA". BMC Neuroscience. 10: 142. doi:10.1186/1471-2202-10-142. PMC 2789732. PMID 19948047.
- Lunn, M. R.; Root, D. E.; Martino, A. M.; Flaherty, S. P.; Kelley, B. P.; Coovert, D. D.; Burghes, A. H.; Thi Man, N.; Morris, G. E.; Zhou, J.; Androphy, E. J.; Sumner, C. J.; Stockwell, B. R. (2004). "Indoprofen Upregulates the Survival Motor Neuron Protein through a Cyclooxygenase-Independent Mechanism". Chemistry & Biology. 11 (11): 1489–1493. doi:10.1016/j.chembiol.2004.08.024. PMC 3160629. PMID 15555999.
- Takeuchi, Y.; Miyanomae, Y.; Komatsu, H.; Oomizono, Y.; Nishimura, A.; Okano, S.; Nishiki, T.; Sawada, T. (1994). "Efficacy of Thyrotropin-Releasing Hormone in the Treatment of Spinal Muscular Atrophy". Journal of Child Neurology. 9 (3): 287–289. doi:10.1177/088307389400900313. PMID 7930408.
- Tzeng, A. C.; Cheng, J.; Fryczynski, H.; Niranjan, V.; Stitik, T.; Sial, A.; Takeuchi, Y.; Foye, P.; Deprince, M.; Bach, J. R. (2000). "A study of thyrotropin-releasing hormone for the treatment of spinal muscular atrophy: A preliminary report". American Journal of Physical Medicine & Rehabilitation. 79 (5): 435–440. doi:10.1097/00002060-200009000-00005. PMID 10994885.
- Kato, Z.; Okuda, M.; Okumura, Y.; Arai, T.; Teramoto, T.; Nishimura, M.; Kaneko, H.; Kondo, N. (2009). "Oral Administration of the Thyrotropin-Releasing Hormone (TRH) Analogue, Taltireline Hydrate, in Spinal Muscular Atrophy". Journal of Child Neurology. 24 (8): 1010–1012. doi:10.1177/0883073809333535. PMID 19666885.
- Bosboom, W. M.; Vrancken, A. F. E.; Van Den Berg, L. H.; Wokke, J. H.; Iannaccone, S. T. (2009). Bosboom, Wendy MJ, ed. "Drug treatment for spinal muscular atrophy type I". The Cochrane Library. doi:10.1002/14651858.CD006281.pub2.
- Haddad, Hafedh; Cifuentes-Diaz, Carmen; Miroglio, Audrey; Roblot, Natacha; Joshi, Vandana; Melki, Judith (2003). "Riluzole attenuates spinal muscular atrophy disease progression in a mouse model". Muscle & Nerve. 28 (4): 432–437. doi:10.1002/mus.10455.
- Dimitriadi, M.; Kye, M. J.; Kalloo, G.; Yersak, J. M.; Sahin, M.; Hart, A. C. (2013). "The Neuroprotective Drug Riluzole Acts via Small Conductance Ca2+-Activated K+ Channels to Ameliorate Defects in Spinal Muscular Atrophy Models". Journal of Neuroscience. 33 (15): 6557–62, p. 6557. doi:10.1523/JNEUROSCI.1536-12.2013. PMC 3652322. PMID 23575853.
- "Study to Evaluate the Efficacy of Riluzole in Children and Young Adults With Spinal Muscular Atrophy (SMA)". ClinicalTrials.gov. Retrieved 2016-05-20.
- "Riluzole: premiers résultats décevants" (به فرانسوی). AFM Téléthon. 2010-09-22. Archived from the original on 8 December 2017. Retrieved 8 December 2017.
- Nizzardo, M.; Nardini, M.; Ronchi, D.; Salani, S.; Donadoni, C.; Fortunato, F.; Colciago, G.; Falcone, M.; Simone, C.; Riboldi, G.; Govoni, A.; Bresolin, N.; Comi, G. P.; Corti, S. (2011). "Beta-lactam antibiotic offers neuroprotection in a spinal muscular atrophy model by multiple mechanisms". Experimental Neurology. 229 (2): 214–225. doi:10.1016/j.expneurol.2011.01.017. PMID 21295027.
- Hedlund, E. (2011). "The protective effects of beta-lactam antibiotics in motor neuron disorders". Experimental Neurology. 231 (1): 14–18. doi:10.1016/j.expneurol.2011.06.002. PMID 21693120.
- Rose, F. F.; Mattis, V. B.; Rindt, H.; Lorson, C. L. (2009). "Delivery of recombinant follistatin lessens disease severity in a mouse model of spinal muscular atrophy". Human Molecular Genetics. 18 (6): 997–1005. doi:10.1093/hmg/ddn426. PMC 2649020. PMID 19074460.
- "CK-2127107". Archived from the original on 11 May 2017. Retrieved 8 December 2017.
- Carrozzi, Marco; Amaddeo, Alessandro; Biondi, Andrea; Zanus, Caterina; Monti, Fabrizio; Alessandro, Ventura (2012). "Stem cells in severe infantile spinal muscular atrophy (SMA1)". Neuromuscular Disorders. 22 (11): 1032–1034. doi:10.1016/j.nmd.2012.09.005.
- Mercuri, Eugenio; Bertini, Enrico (2012). "Stem cells in severe infantile spinal muscular atrophy". Neuromuscular Disorders. 22 (12): 1105. doi:10.1016/j.nmd.2012.11.001.
- Committee for Advanced Therapies CAT Scientific Secretariat. (2010). "Use of unregulated stem-cell based medicinal products". The Lancet. 376 (9740): 514. doi:10.1016/S0140-6736(10)61249-4. PMID 20709228.
- European Medicines Agency (16 April 2010). "Concerns over unregulated medicinal products containing stem cells" (PDF). European Medicines Agency.
- مشارکتکنندگان ویکیپدیا. «Spinal muscular atrophy». در دانشنامهٔ ویکیپدیای انگلیسی، بازبینیشده در ۶ دسامبر ۲۰۱۷.