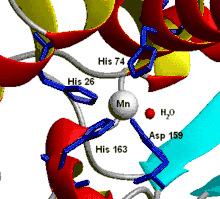
سوپراکسید دیسموتاز
سوپراکسید دیسموتاز (انگلیسی: Superoxide dismutase) یا بهاختصار SOD یک آنزیم است که واکنشِ گسست ناهمگن (و یا تجزیه و تفکیکِ) رادیکالِ سوپراکسید (O2−) را، به مولکول اکسیژن معمولی (O2) یا هیدروژن پراکسید (H2O2) کاتالیزه و تسهیل میکند. سوپراکسید یک محصول فرعی و ثانویهٔ متابولیسم اکسیژن است و اگر تحت کنترل نباشد، موجب بروز انواع متفاوتی از آسیبهای سلولی میگردد.[2] هیدروژن پراکسید یا همان آب اکسیژنه هم برای سلول زیانآور است و توسط آنزیمهای دیگری همچون کاتالازها تجزیه میشود؛ بنابراین سوپراکسید دیسموتاز، یکی از انواع مهمِ سیستم دفاعی آنتیاکسیدان است و تقریباً در تمامی سلولهایی که در معرض اکسیژن قرار دارند، وجود دارد. یک استثنای این قاعده، لاکتوباسیلوس پلانتاروم و لاکتوباسیلوسهای مشابه است که از مکانیسمهای دیگری جهت جلوگیری از آسیب ناشی از سوپراکسید (O2−) استفاده میکنند.
| سوپراکسید دیسموتاز | |||||||||
|---|---|---|---|---|---|---|---|---|---|
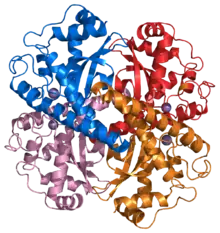 ساختار چهارگانهٔ آنزیم سوپراکسید دیسموتاز منگنزدار انسان.[1] | |||||||||
| شناساگرها | |||||||||
| شمارهٔ ایسی | ۱٫۱۵٫۱٫۱ | ||||||||
| شمارهٔ سیایاس | ۹۰۵۴-۸۹-۱ | ||||||||
| پایگاههای داده | |||||||||
| اینتنز | نمایش اینتنز | ||||||||
| برندا | مدخل برندا | ||||||||
| اکسپسی | نمایش NiceZyme | ||||||||
| کیایجیجی | مدخل کیایجیجی | ||||||||
| متاسایک | گذرگاه سوختوساز | ||||||||
| پریام | نمایه | ||||||||
| ساختارهای پیدیبی | RCSB PDB PDBe پیدیبیسام | ||||||||
| هستیشناسی ژن | AmiGO / QuickGO | ||||||||
| |||||||||
انواع در انسان
در انسان و همچنین پستانداران و طنابداران، ۳ نوع سوپراکسید دیسموتاز وجود دارد.
- SOD1 در سیتوپلاسم؛ دارای مس و روی؛ ساختمانش، از ۲ بخش تشکیل شدهاست. (دایمر)؛ ژن آن بر روی کروموزوم ۲۱ واقع است. (21q22.1)
- SOD2 در میتوکندری؛ دارای منگنز؛ ساختمانش، از ۴ بخش تشکیل شدهاست. (تترامر)؛ ژن آن بر روی کروموزوم ۶ واقع است. (6q25.3)
- SOD3 در فضای خارج سلولی؛ دارای مس و روی؛ ساختمانش، از ۴ بخش تشکیل شدهاست. (تترامر)؛ ژن آن بر روی کروموزوم ۴ واقع است. (4p15.3-p15.1)
|
|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
جستارهای وابسته
منابع
- پیدیبی 1VAR; Borgstahl GE, Parge HE, Hickey MJ, Johnson MJ, Boissinot M, Hallewell RA, Lepock JR, Cabelli DE, Tainer JA (April 1996). "Human mitochondrial manganese superoxide dismutase polymorphic variant Ile58Thr reduces activity by destabilizing the tetrameric interface". Biochemistry. 35 (14): 4287–97. doi:10.1021/bi951892w. PMID 8605177.
- Hayyan M, Hashim MA, Al Nashef IM (2016). "Superoxide Ion: Generation and Chemical Implications". Chem. Rev. 116 (5): 3029–3085. doi:10.1021/acs.chemrev.5b00407.
- پیدیبی 3CQQ; Cao X, Antonyuk SV, Seetharaman SV, Whitson LJ, Taylor AB, Holloway SP, Strange RW, Doucette PA, Valentine JS, Tiwari A, Hayward LJ, Padua S, Cohlberg JA, Hasnain SS, Hart PJ (June 2008). "Structures of the G85R variant of SOD1 in familial amyotrophic lateral sclerosis". J. Biol. Chem. 283 (23): 16169–77. doi:10.1074/jbc.M801522200. PMC 2414278. PMID 18378676.
- پیدیبی 2JLP; Antonyuk SV, Strange RW, Marklund SL, Hasnain SS (May 2009). "The structure of human extracellular copper-zinc superoxide dismutase at 1.7 A resolution: insights into heparin and collagen binding". J. Mol. Biol. 388 (2): 310–26. doi:10.1016/j.jmb.2009.03.026. PMID 19289127.
- مشارکتکنندگان ویکیپدیا. «Superoxide dismutase». در دانشنامهٔ ویکیپدیای انگلیسی، بازبینیشده در ۲۳ مه ۲۰۱۸.