پیوند دو الکترون -سه مرکزی
پیوند دو الکترون-سه مرکزی (به انگلیسی: Three-center two-electron bond) یک پیوند شیمیایی با کمبود الکترون است که سه اتم، دو الکترون به اشتراک میگذارند. همپوشانی سه اوربیتال اتمی منجر به پدید آمدن سه اوربیتال مولکولی میشود که عبارتند از پیوندی و ناپیوندی و ضد پیوندی. دو الکترون در اوربیتال پیوندی مستقر شده و در نتیجه در تمام سه اوربیتال مولکولی به اشتراک گذاشته میشود. در اکثر ترکیبات شامل این پیوند، اوربیتال پیوندی بیشتر به سمت دو تا از اتمها کشیده میشود و بهطور مساوی بین سه اتم تقسیم نمیشود. کاتیون تری هیدروژن، دارای پیوند دو الکترون -سه مرکزی است.
بورانها و کربورانها
پیوند سه مرکزی استفادههای زیادی در بورانها و کربورانها دارد و میتوان پایداری این نوع ترکیبات را بر اساس قوانین وید توضیح داد.
مولکول BH3، به دلیل خالی بودن یکی از سه اوربیتال اتمی پی در اتم بور ناپایدار است و برای پایدار شدن نیاز به تشکیل دیمر دارد. اما نمیتواند مانند اکثر مولکولها با یک پیوند داتیو از طریق یکی از مولکولهای متصل به اتم مرکزی به اوربیتال خالی مولکول دیگر به پایداری برسد. پس مجبور است که از سمت H-B که دارای دو هسته و دو الکترون است، به سمت اوربیتال خالی اتم بور دیگر مولکول پیوند دهد که نتیجه آن، B-H-B است که دو الکترون بین سه اتم به اشتراک گذاشته شده و به این پیوند میگویند پیوند دو الکترون-سه مرکزی.[1] در دیمر دیبوران، دو نوع پیوند بین یک اتم بور و یک اتم هیدروژن وجود دارد. یک نوع آن در اطراف اتم بور به دور از پل بین دو اتم بور وجود دارد و یک پیوند یگانه بین بور و هیدروژن است. نوع دیگر آن هم بین اتم و هیدروژن بین هر دو اتم بور است که طول آن بلندتر از طول پیوند یگانه و در نتیجه، پیوند ضعیفتری نسبت به دیگر اتمها است.
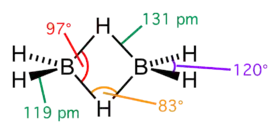 مرتبه پیوند در هیدروژنهای پل دی بوران، ۰٫۵ است.[2]
مرتبه پیوند در هیدروژنهای پل دی بوران، ۰٫۵ است.[2]
کمپلکس های فلزات واسطه
پیوند دو الکترون-سه مرکزی، یک نوع پیوند معمول و فراگیر در شیمی آلی فلزات واسطه است و به خانواده ای در شیمی آلی فلز که دارای این نوع برهمکنش می باشد برهمکنش آگوستیک می گویند.
دیگر ترکیبات
این نوع پیوند در تری متیل آلومینیوم نیز دیده می شود که هنگامی که به شکل دیمر در می آید، کربن های دو گروه از شش گروه متیل در بین دو اتم آلومینیوم در موقعیت پل قرار می گیرد.
کربوکاتیون ها
سطح انرژی کربوکاتیون ها تقریباً با سطح انرژی ترکیبات دارای پیوند های دو الکترون-سه مرکزی برابر است. به همین دلیل، به طور کلی مقدار انرژی فعالسازی برای تبدیل این دو گونه به دیگری صفر است. این قضیه باعث شده که در واکنش های بازآرایی کربوکاتیون ها، به وفور اتفاق بیفتد.
یک سری از کربونیم ها مانند اتانیم، دارای این نوع پیوند نیز هستند.
منابع
- I. Mayer (1989). "Bond orders in three-centre bonds: an analytical investigation into the electronic structure of diborane and the three-centre four-electron bonds of hypervalent sulphur". Journal of Molecular Structure. 186: 43–52. doi:10.1016/0166-1280(89)87037-X.
- F. Albert Cotton, Geoffrey Wilkinson and Paul L. Gaus, Basic Inorganic Chemistry, 2nd ed. (Wiley 1987), p.113
- Nikonov, G. I. (2005). "Recent advances in nonclassical interligand SiH interactions". Adv. Organomet. Chem. 53: 217–309. doi:10.1016/s0065-3055(05)53006-5.
- Arrowsmith, M; Braunschweig, H.; Celik, M.A.; Dellermann, T.; Dewhurst, R.D.; Ewing, W.C.; Hammond, K.; Kramer, T.; Krummenacher, I.; Mies, J.; Radacki, K.; and Schuster, J.K. (2016). "Neutral zero-valent s-block complexes with strong multiple bonding". Nature Chemistry. 8 (9): 890–894. Bibcode:2016NatCh...8..890A. doi:10.1038/nchem.2542. PMID 27334631.
2(HSiPh3).png.webp)