دفراسیروکس
دفراسیروکس (انگلیسی: Deferasirox) با نامهای تجاریِ «دسیروکس»، «دفریجت»، «دِسیفر»، «راسیروکسپین» و «نانوجِید[1]» یک داروی خوراکی شلاتهکنندهٔ آهن است که برای کاهش هموکروماتوز در افرادی که مجبور به تزریق خون طولانیمدت در بیماریهایی همچون تالاسمی یا کمخونیهای مزمن هستند، بهکار میرود.[2][3] این نخستین داروی خوراکی است که بدین منظور در آمریکا پذیرفته شد.[4]
 | |
|---|---|
 | |
| سامانهشناسی نام (آیوپاک) | |
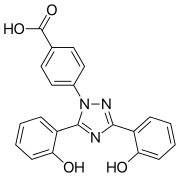
| 4-[(3Z,5E)-3,5-bis(6-oxo-1-cyclohexa-۲٬۴- dienylidene)-1,2,4-triazolidin-1-yl]benzoic acid | |
| دادههای بالینی | |
| Licence data | EMA:Link, US FDA:link |
| رده بارداری | B(US) |
| تجویز | خوراکی |
| دادههای فارماکوکینتیکی | |
| فراهمی زیستی | ۷۰٪ |
| پیوند پروتئینی | ۹۹٪ |
| متابولیسم | کبدی (گلوکورونیداسیون) |
| نیمهعمر | ۸ تا ۱۶ ساعت |
| دفع | مدفوع (۸۴٪) و ادرار (۸٪) |
| شناسه | |
| شماره سیایاس | 201530-41-8 |
| کد ATC | V03AC03 |
| پابکم | CID 5493381 |
| بانکدارو | DB01609 |
| کماسپایدر | 4591431 |
| UNII | V8G4MOF2V9 |
| KEGG | D03669 |
| ChEMBL | CHEMBL550348 |
| دادههای شیمی | |
| فرمول | C21H15N3O۴ |
| وزن مولکولی | 373.362 g/mol |
| SMILES | eMolecules & PubChem |
| |
| | |
سازمان غذا و داروی آمریکا در نوامبر ۲۰۰۵ میلادی این دارو را تأیید کرد.[2][4] مطابق گزارش این سازمان در مه ۲۰۰۷ میلادی، عارضهٔ بالقوهٔ این دارو در کسانی که سوسپانسیونِ خوراکی آنرا دریافت میدارند، نارسایی کلیه و سیتوپنی است. اتحادیه اروپا هم این دارو را برای همین مصارف در کودکان ۶ سال به بالا تأیید نمودهاست.[5][6][7] از سایر عوارض این دارو میتوان به احتمال خونریزی گوارشی و نارسایی کبدی اشاره نمود.[8] تاکنون ۱۳۲۰ مرگِ مرتبط با مصرف این دارو، گزارش شدهاست.
_complex.png.webp)
منابع
- «جزئیات تولید جدیدترین قرص بیماران تالاسمی در ایران/کاهش کیفیت دارو از گلایههای مهم بیماران - اخبار تسنیم - Tasnim». خبرگزاری تسنیم - Tasnim. دریافتشده در ۲۰۱۸-۱۱-۱۲.
- Choudhry VP, Naithani R (2007). "Current status of iron overload and chelation with deferasirox". Indian J Pediatr. 74 (8): 759–64. doi:10.1007/s12098-007-0134-7. PMID 17785900. Free full text بایگانیشده در ۲۹ آوریل ۲۰۱۴ توسط Wayback Machine
- Yang LP, Keam SJ, Keating GM (2007). "Deferasirox : a review of its use in the management of transfusional chronic iron overload". Drugs. 67 (15): 2211–30. doi:10.2165/00003495-200767150-00007. PMID 17927285.
- "FDA Approves First Oral Drug for Chronic Iron Overload" (Press release). United States Food and Drug Administration. November 9, 2005. Retrieved 2007-10-31.
- Exjade - deferasirox, from EMA website
- Turning a blind eye to deferasirox's toxicity? , The Lancet, Volume 381, No. 9873, p1183–1184, 6 April 2013
- Review: Exjade side effects
- ISMP (2010). "ISMP QuarterWatch(TM)". 15 (12). ISMP Medication Safety Alert. pp. 1–3.
- مشارکتکنندگان ویکیپدیا. «Deferasirox». در دانشنامهٔ ویکیپدیای انگلیسی، بازبینیشده در ۲۹ دسامبر ۲۰۱۷.