فتالوسیانین
فتالوسیانین (به انگلیسی: Phthalocyanine) از لغت یونانی نفتا (rock oil) وblue oil) cyanine) گرفته شدهاست. ماده سوختنی rock و(oil) ازبابیلونین آسفالت فراهم میشود واولین باراین لغت را هومر استفاده کردهاست. گوردن، نفتالین را در سال ۱۸۱۹ در یک معدن زغال سنگ کشف کردوکید آن رادر دانشگاه آکسفورد مورد بررسی قرار داد و نخست نام آن را در سال ۱۸۲۱ در مقاله مشاهدهٔ نفتالین بکار برد.
| فتالوسیانین[1] | |
|---|---|
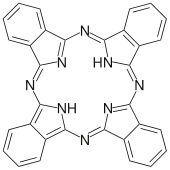 | |
 | |
دیگر نامها Phthalocyanin | |
| شناساگرها | |
| شماره ثبت سیایاس | ۵۷۴-۹۳-۶ |
| پابکم | ۵۲۸۲۳۳۰ |
| کماسپایدر | ۴۴۴۵۴۹۷ |
| جیمول-تصاویر سه بعدی | Image 1 |
SMILES
| |
| |
| خصوصیات | |
| فرمول مولکولی | C32H18N۸ |
| جرم مولی | ۵۱۴٫۵۴ g mol−1 |
| خطرات | |
| شمارههای نگهداری | S۲۲ S24/25 |
| به استثنای جایی که اشاره شدهاست در غیر این صورت، دادهها برای مواد به وضعیت استانداردشان داده شدهاند (در 25 °C (۷۷ °F)، ۱۰۰ kPa) | |
| | |
| Infobox references | |
|
| |
فتالوسیانین برای اولین بار در سال ۱۹۰۷ به وسیله براون وچرنیاک در کمپانی گاز متروپلیتن شمالی در لندن به عنوان فراوردههای جانبی در تهیه آرتوسیانوبنزآمید ازفتالیمید و آنهیدرید استیک بدست آمد.
همچنین فتالوسیانین مس به وسیلهٔ دیس باخ و وندروید، در سال ۱۹۲۷ از برهم کنش اورتودی برموبنزن وسیانیدمس به دست آمد. آنها همچنین مشاهده کردند که محصولاتشان در مواد قلیایی، اسیدسولفوریک و گرما، یک ثبات استثنایی دارد[2]
مشاهدهٔ بعدی فتالوسیانین در سال ۱۹۲۸ زمانی که عدهای میخواستند فتالامید از فتالیک انهیدرید وآمونیا در کارخانه رنگ اسکاتلند تولیدکننداتفاق افتاد. این مشاهده به این صورت بود در یک رآکتور فلزی مجهز به جدارهٔ شیشهای پهن یک ناخالصی آبی متمایل به سبز ملاحظه گردید. آزمایشهای مقدماتی بر روی این ترکیب انجام شد ومشخص شد که این ترکیب بسیار پایدار است وآهن موجود در آن به وسیلهٔ اسید سولفوریک از آن جدا نمیشود. در سال ۱۹۲۹ نخستین حق ثبت برای ترکیباتی که امروزه به نام فتالوسیانین میشناسیم به داندریج، درشروتوماس از کمپانی اسکاتیش دایز اعطا شد.[3]
لینستید با همکارانش به کمک یک گروه شیمیدان برای اولین بار در سال ۱۹۲۹ ساختار فتالوسیانین وچندین ترکیب فلزی آن را به دست آوردند. عنوان فتالوسیانین برای اولین بارتوسط لینستد برای توصیف دستهای جدیداز موادآلی در سال ۱۹۳۳و۱۹۳۴ استفاده شد. ساختار مولکول فتالوسیانین صفحهای که ابتدا توسط دنت ودیگران گزارش شد متشکل از چهارواحدایزوایندل که توسط اتمهای آزاد نیتروژن بهم خوردهاند ودواتم هیدروژن را احاطه کردهاند، بود.
در فتالوسیانین فلزی سادهای مثلCuPc، دو اتم هیدروژن مرکزی با یک اتم فلز جایگزین شدهاست. یک خاصیت عمده مربوط به این ساختار این است که عمدتاً مولکولهای مختلف فتالوسیانین از نظر گرمایی پایدارند و میتوانند بدون تجزیه، تصفیه شوند. به این دلیل است که برخلاف ترکیبات آلی دیگر تهیهٔ لایه نازک فتالوسیانین به وسیله دستگاههای تبخیر در خلا امکانپذیر است. اولین بار در سال ۱۹۴۸توسط الی و وارتانیان رفتار نیمرسانایی در فتالوسیانینهای حجمی مشاهده شد.[4]
این نوع مشاهدات در سال ۱۹۶۳ توسط هلیمر و وارفیلد روی تک بلور H_2 Pc دنبال شد. در همان سال بود که هیلمر وهریسون اندازهگیریهای الکتریکی اولیهای را که بر روی فتالوسیانین مس تک بلوری انجام داده بودند گزارش کردند[5] .
در دهه ۱۹۳۰ ،۱۹۴۰ ،۱۹۵۰ تحقیقات زیادی روی طیف X-ray، طیف جذبی، خصوصیات مغناطیسی، رسانندگی نوری وخصوصیات فیزیکی آنها مثل قابلیت حل شدگی، دی الکتریکی و ویژگیهای نیمه رسانایی و غیره انجام شد. و همچنین بهطور همزمان در این سالها ۴۰ ترکیب از ترکیبات فلزی فتالوسیانینها در همهٔ گروههای جدول تناوبی مورد بررسی قرار گرفت، همچنین در این سالها استفاده از فتالوسیانینها در رنگآمیزی، صنایع پلاستیکی، جوهرهای رنگی، نساجی، جوهر خودکار، چرمسازی، نفت، بنزین، پرینترهای رنگی و حتی در رنگ دهندههای خوراکی رواج پیدا کرد.
فتالوسیانین با علامت اختصاری Pc نمایش داده میشود؛ که دارای ترکیب C_32 H_16 N_8^(-2) میباشد. فتالوسیانینها مولکولهای
آلی بزرگی هستند که با خصوصیاتی مانند تقارن بالا، در صفحه بودن ودرمحل نبودن الکترون مشخص میشوند وهمه این خصوصیات به خاطرالکترونهای π ی موجود در ساختارش است. فتالوسیانینها با توجه به اتمی که در میان حلقههای بنزنی قرار گرفتهاست کلاسه بندی میشوند. اگر دو اتم هیدروژن در میان حلقههای بنزنی قرار گرفته باشد فتالوسیانین عاری از فلز مینامند. اگر اتمی از فلزی خاص در میان حلقههای بنزنی نشانده شود، به آن ترکیب فتالوسیانین فلزی می-گویند واگر به جای اتمهای هیدروژن یک اتم فلزی ویک اتم گروه هالوژنه{در جدول تناوبی، نشانده شود ترکیب حاصل فتالوسیانین هالوژندار نامیده میشود.
بیشتر نیمه رساناهای آلی شامل مولکولهای آروماتیک وجفت شدهاند. ساختار مشترکی که در تمام این مولکولها واقع است وجزء اصلی این مولکولها به حساب میآید بنزن با فرمول C_6 H_6 است. در مولکول بنزن اتمهای کربن درگوشههای یک شش ضلعی منظم تخت واقع شدهاند وشش اتم هیدروژن در همان صفحه و به صورت شعاعی به طرف بیرون کربنها واقعاند. بهطوریکه زوایای پیوند آنها ۱۲۰درجه میباشد. این ترکیب سبب میشود چهار الکترون ظرفیت اتم کربن که در تراز S وP قرار دارد، سه تا اوربیتال درحالت سه گوش هیبرید به وجود آورد به این ترتیب پیوندهای جایگزیده C-HوC-C به وجود میآید. هردو نوع پیوند ازنوع اوربیتال σ است که دراطراف محورپیوند تقارن دارد. الکترونهای چهارم ظرفیت در اتم کربن هیبرید نشده هستندکه این الکترونها برای هر کربن الکترون هایπ محسوب میشودبهطوریکه اوربیتالهای اتمی اینها همه موازی یکدیگر بوده و به صورت عمودی بر صفحه¬ مولکول گسترده شدهاند ودارای مؤلفه اندازه حرکت ∓۱ در اطراف جهت پیوند میباشند.
جفت شدگی الکترونهای مجاور به اوربیتالهای مولکولی π سبب ایجاد محورهای پیوندی نامتقارن میشود. هرکدام از اوربیتالهای اتمی، بهطور مساوی با دو اتم مجاور خود همپوشانی میکند. بهطور که شش الکترون π بالاجبار تمام اوربیتالهای مولکولی که روی اتمهای کربن نشستهاند را اشغال کنند این موضوع نا جایگزیدگی الکترونهای π در بر دارد.
این بدان معنی است که این الکترونها در طول اتم کربن به هم پیوسته و در حال حرکتاند. تحرک این دسته از الکترونها در خواص شیمیایی وفیزیکی ترکیبات آروماتیک نقش بسزایی دارد. مولکولهای آروماتیک خواص دیامغناطیسی ناهمگنی از خود به نمایش میگذارند.[6][7]
از آنجا که جریانهای الکتریکی ضعیف زمانی که میدان مغناطیسی بر سطح مولکول عمود باشد یک بخش دیامغناطیسی بزرگی را به وجود میآورند با افزایش اندازه مولکولها تعداد الکترونها π افزایش مییابد در نتیجه ناهماهنگی بیشتر میگردد.[8][8]
گذار الکترونی انجام شده توسط این نوع از الکترونها بسیار بیشتر از الکترونهای σ میباشد این خاصیت از دیگر خواصی که سبب تحرک الکترونهای π ایجاد میشود و به علتگذار الکترونی که از الکترونهای π به الکترونهای غیرپیوندیπ^* صورت میگیرد بالاترین و قویترین جذب در طیف مرئی قابل مشاهده است.[9]
در حالت جامد نیروهای بین مولکولی (مولکولهای پلاریزه شونده) بیشتر از نیروهای جاذبه پراکنده (که بهطورقوی جهت دار نیستند) ونیروهای کوتاه برد هستند. همانطور که در بلورهای بس مولکولی این امر منجر به وقوع پلی مرفیزم (چند ریختی) میشود، چندین ترتیب توده مولکولی متفاوت برای انرزی شبکه سراسری ممکن خواهد بود. فتالوسیانینهای صفحهای دو شکل پلی مرفیک به نامهای αوβ دارند. فرق اصلی این دو فاز در زاویه بین محورهای توده و صفحه عمود بر مولکول میباشد.
فتالوسیانینها به راحتی در سیستمهای با خلا بالا تصعید شده و منجر به ساخت فیلمهای نازک با خلوص بالا میگردد.[10]
از ویژگیهای الکتریکی این ترکیبات این است که بسیار به حضور اکسیژن حساس اند ومشخص شده که اکسیژن به عنوان مراکز پذیرنده در بیشتر فتالوسیانینها عمل میکند و بنابراین رسانندگی آنها را افزایش میدهد. برای بررسی اثر اکسیژن ابتدا آزمایش را در مکانی تحت خلا کامل به منظور حذف اثر جذب اکسیژن انجام داده و سپس به بررسی اثر تزریق اکسیژن میپردازیم.
علاوه بر این رسانندگی الکتریکی در فتالوسیانینها به شدت وابسته به ماهیت تماس دهنده فلزی به کار گرفته شدهاست طلا به عنوان تماس دهنده شناخته شده در حالی که آلومینیوم و سرب در ترکیب با خیلی از فتالوسیانینها به عنوان تماس دهنده بلوکهکننده ویکسوکننده شناخته میشوند.
فتالوسیانینها در ساخت وسایل وابزاری که در زیر نام بردیم کاربرد دارد.
دیودهای نورگسیل– سلولهای خورشیدی– ترانزیستورهای اثرمیدانی– قطعات اپتیک غیرخطی – فیلترهای رنگی و غیره میتوان از آن استفاده نمود.
از ترکیبات فتالوسیانین نیز در صنعت استفادههایی میگردد که چند موردازآن هارا دراینجا نام میبریم. مثلاً از فتالوسیانین مس آبی رنگ به شکل بلوری، به عنوان رنگ در پلاستیکها، پوششها و رنگهای نساجی و روغنی درغیاب حلالهای آروماتیک کلردار استفاده میشود. در رنگهای چاپ، لعاب و نقاشی کاربرد دارد. گریسهای مورد استفاده در دماهایی بالا از رنگدانههای فتالوسیانین مس که بر روی ورقه نازکی از سیلیکون مایع قرار میگیرد تهیه شود. برای رنگ آمیزی آلومینیوم از سولفات فتالوسیانین استفاده میشود. سدیم سولفات مس در فرایندهای فتوگرافی کاربرد دارد.[11]
منابع
- Phthalocyanine at Sigma-Aldrich
- L. Pauling, "The dimagnetic entropy of aromatic molecules," chemical physics, vol. 4, pp. 673-677, 1936.
- F. H. Moser and A. L. Thomas, Phthalocyanines Properties, CRC Press, 1983.
- A. T. Vartanyan, "Semiconductor properties of organic dyes I. Phtholocyanines," Zhurnal Fizicheskoi Khimii, vol. 22, p. 796, 1948.
- G. H. Heilmeier and G. Wafield, "Photoconductivity in Metal‐Free Phthalocyanine Single Crystals," chemial physics, vol. 38, p. 136, 1963
- G. H. Heilmerier and S. E. Harrison, "Charge Transport in Copper Phthalocyanine Single Crystal," Physical Review, vol. 132, p. 2010, 1963
- K. Inokuchi, "Rheology of surface films. IV. Viscoelastic properties of 6-nylon films at air/water interface," Bulletin of the Chemical Society of Japan, vol. 28, p. 453, 1955.
- H. Akamatu, H. Inokuchi and Y. Motasunaga, "Organic Semiconductor with High Conductivity. I. Complexes between Polycyclic Aromatic Hydrocarbons and Halogens," Bulletin of the Chemical Society of Japan, vol. 29, p. 213, 1956.
- J. M. Robertson, "High-Temperature Steels and Alloys for Gas Turbines," symp, vol. 167, p. 35, 1951.
- J. M. Robertson and J. G. White, "The crystal structure of coronene: a quantitative X-ray investigation," Chemical Socity, vol. 35, p. 607, 1945.
- J. Puigdollers, C. Voz, M. Fonrodona, S. Cheylan, M. Stella, J. Andreu, M. Vetter and R. Alcubilla, "Copper phthalocyanine thin-film transistors with