هالوژن
هالوژنها (به انگلیسی: Halogen) با ترکیب شدن با گروه اول تولید نمک میکنند به همین خاطر به آنها هالوژن میگویند.
| گروه → | ۱۷ | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| دوره ↓ | |||||||||||||
| ۲ | 9 F | ||||||||||||
| ۳ | 17 Cl | ||||||||||||
| ۴ | 35 Br | ||||||||||||
| ۵ | 53 I | ||||||||||||
| ۶ | 85 At | ||||||||||||
| ۷ | 117 Ts | ||||||||||||
| |||||||||||||
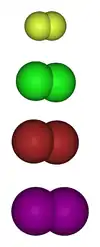
گروه هالوژن عناصر گروه ۱۷ (گروه ۷ اصلی) جدول تناوبی هستند؛ یعنی: فلوئور (F)، کلر (Cl)، برم (Br)، ید (I) و آستاتین (At).
هالوژنها در حالت طبیعی خود مولکولهای دواتمی هستند.
واژهٔ هالوژن از زبان یونانی گرفته شده و به معنی نمکزا است.
خواص تناوبی
همانند روند کلی موجود در جدول تناوبی، از بالا به پایین، عدد اتمی و جرم اتمی هالوژنها زیاد میشود. همچنین الکترونگاتیوی آنها نیز کاهش مییابد.[1]
| جرم اتمی | نقطه ذوب | نقطه جوش | الکترونگاتیویته | |
|---|---|---|---|---|
| فلوئور | ۱۹ | ۵۳/۵۳ | ۸۵/۰۳ | ۳/۹۸ |
| کلر | ۳۵/۵ | ۱۷۱/۶ | ۲۳۹/۱۱ | ۳/۱۶ |
| برم | ۸۰ | ۲۶۵/۸ | ۳۳۲/۰ | ۲/۹۶ |
| ید | ۱۲۷ | ۳۹۶/۸۵ | ۴۵۷/۴ | ۲/۶۶ |
| استاتین | ۲۱۰ | ۵۷۵ | ۶۱۰ | ۲/۲ |
خواص فیزیکی
در گروه هالوژنها، از بالا به پایین، با افزایش شعاع اتمی، طول پیوند در مولکول هالوژن افزایش مییابد؛ این عامل و همینطور افزایش تعداد الکترونها و نیز افزایش جرم مولکول، باعث افزایش نقطه ذوب و نقطه جوش میشود. در نتیجه فلوئور و کلر گاز هستند؛ اما برم مایع است و ید جامدی میباشد که به راحتی تصعید میگردد.[2]
خواص شیمیایی
هالوژنها میتوانند با دریافت یک الکترون و تشکیل آنیون، به آرایش پایدار هشتایی گاز نجیب (اوکتت) برسند (الکترونخواهی آنها منفی است)؛ به همین دلیل واکنشپذیری زیادی دارند که البته از بالا به پایین کاهش مییابد.[3] همین عامل سبب شده عناصر گروه ۱۷ به شدت سمی باشند. خواص ضدعفونیکنندگی هالوژنها نیز بر همین اساس است، یعنی مولکول هالوژن با اکسید کردن مولکولهای دیواره سلولی باکتریها، آنها را میکشد. به همین دلیل در تصفیه آب از کلر استفاده میگردد.
منابع
- Chemistry; Charles E. Mortimer; 6th Edition; Chapter6
- Chemistry; Charles E. Mortimer; 6th Edition; Chapter21
- Chemistry; Charles E. Mortimer; 6th Edition; Chapter7
ویکیانگلیسی
| در ویکیانبار پروندههایی دربارهٔ هالوژن موجود است. |