کربوکسیلاستراز ۱
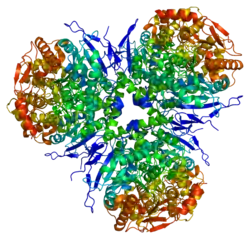
کربوکسیلاستراز ۱ کبدی (انگلیسی: Liver carboxylesterase 1) که با حروف اختصاری CES1 و hCE-1 هم شناخته میشود، یک آنزیم است که در انسان توسط ژن «CES1» کُدگذاری میشود.[4][5] در گذشته به این آنزیم «سرین استراز ۱»، «مونوسیت استراز» و «کلسترول استر هیدرولاز» هم میگفتند. این ژن سه گونه پیرایش دگرسان دارد که هر کدام یک پروتئین مجزا میسازند.[5]
این آنزیم در تمامی بافتهای بدن موجود است، اما به میزان فراوانی در کبد و میزان کمتری در لوله گوارش یافت میشود.[6]
عملکرد
کربوکسیلاستراز ۱، عضوی از اَبَـرخانواده هیدرولاز آلفا/بتا است[6] که سبب هیدرولیز مواد بیگانهزیست و داروهای حاوی پیوندهای استری و آمیدی همچون کوکائین و هروئین میگردند. این خانوادهٔ آنزیمی میتوانند سبب تجزیهٔ اسید چرب با زنجیرهٔ بلند و تیواسترها نیز بشوند.
کربوکسیلاستراز ۱ همچنین میتواند موجب هیدرولیز استرهای آروماتیک و آلیفاتیک شده و میزان استریفیکاسیون کلسترول در سلولها را مدیریت کند. این آنزیم احتمالاً در سمزدایی ریهها و محافظت از دستگاه عصبی مرکزی در برابر استرها و آمیدها هم نقش دارد.[5]
اهمیت بالینی
کربوکسیلاستراز ۱ احتمالاً در بیماریهای لنفوم غیرهاجکین یا لوسمی لنفوسیتیک سلولهای بی اهمیت دارد. مهار کردن این آنزیم با ارگانوفسفاتها، قدرت تومورکُشی مونوسیتها را کاهش میدهد.[7][8] همچنین فقدان این پروتئین در مونوسیتها یکی از نتایج مسمومیت با ارگانوفسفاتها است.[8]
کربوکسیلاستراز ۱ میتواند برخی داروها را فعال یا غیرفعال کند. این آنزیم مسئول فعالشدن برخی پیشداروها همچون بازدارندههای آنزیم مبدل آنژیوتانسین (ACEIs)، اُسلتامیویر و دابیگاتران است.[9][10][11][12] گوناگونی جزئی در ژن «CES1» سبب تغییر فراوان در فارماکوکینتیک و فارماکودینامیک برخی داروها مثل متیلفنیدات و کلوپیدوگرل میشود.[13] توانایی این آنزیم در تجزیهٔ کوکائین و هروئین به عنوان نقش دارویی آن مطرح شدهاست.[14]
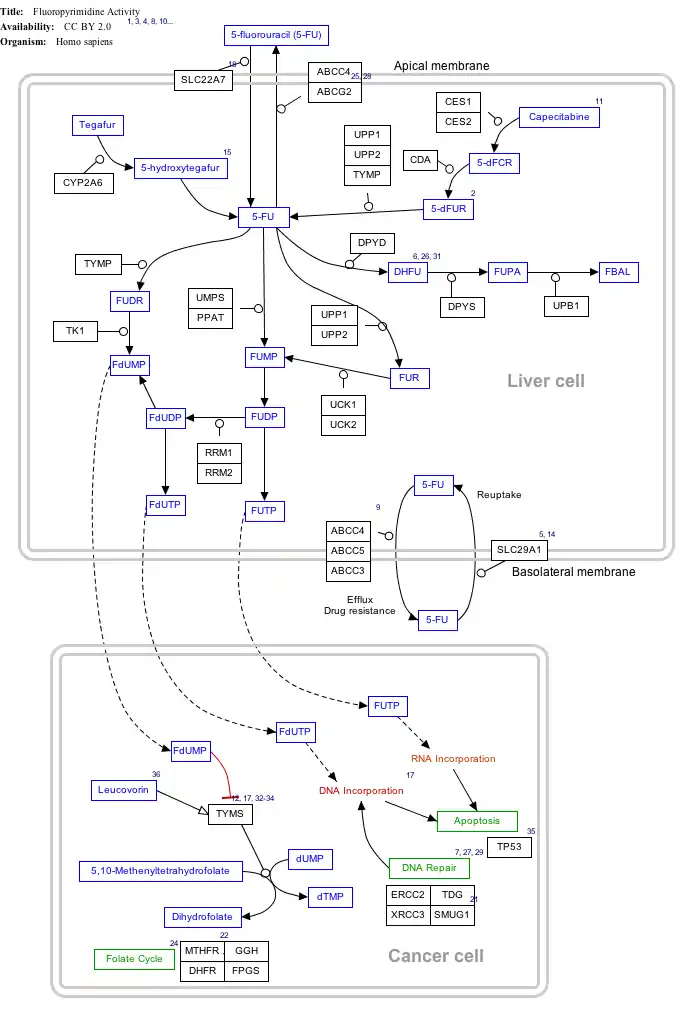
نقشهٔ تعاملی مسیرهای ملکولی
| بر روی نام ژنها، پروتئینها و متابولیتها کلیک کنید تا به مقالهٔ اختصاصی هر یک از آنها هدایت شوید.[§ 1]
فعالیت (5-FU) فلوروراسیل؛ ویرایش
|
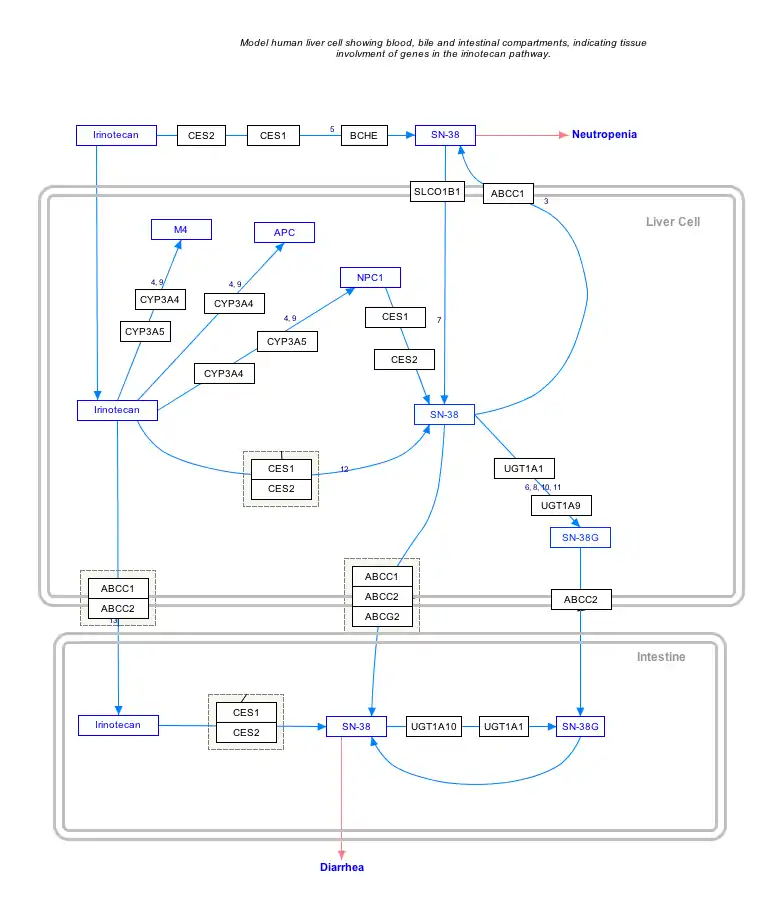
بر روی نام ژنها، پروتئینها و متابولیتها کلیک کنید تا به مقالهٔ اختصاصی هر یک از آنها هدایت شوید. [§ 1]
مسیر ایرینوتکان؛ ویرایش
|
منابع
- GRCm38: Ensembl release 89: ENSMUSG00000056973 - Ensembl, May 2017
- "Human PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- "Mouse PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- Zschunke F, Salmassi A, Kreipe H, Buck F, Parwaresch MR, Radzun HJ (Aug 1991). "cDNA cloning and characterization of human monocyte/macrophage serine esterase-1". Blood. 78 (2): 506–12. doi:10.1182/blood.V78.2.506.506. PMID 2070086.
- "Entrez Gene: CES1 carboxylesterase 1 (monocyte/macrophage serine esterase 1)".
- Imai T (Jun 2006). "Human Carboxylesterase Isozymes: Catalytic Properties and Rational Drug Design". Drug Metabolism and Pharmacokinetics. 21 (3): 173–185. doi:10.2133/dmpk.21.173. PMID 16858120.
- Oertel J, Hagner G, Kastner M, Huhn D (Dec 1985). "The relevance of alpha-naphthyl acetate esterases to various monocyte functions". Br J Haematol. 61 (4): 717–26. doi:10.1111/j.1365-2141.1985.tb02886.x. PMID 4084460. S2CID 84899499.
- Markey GM (Feb 2011). "Carboxylesterase 1 (Ces1): from monocyte marker to major player". J Clin Pathol. 64 (2): 107–9. doi:10.1136/jcp.2010.084657. PMID 21177752. S2CID 32622794.
- Zhu HJ, Appel DI, Johnson JA, Chavin KD, Markowitz JS (Jan 2009). "Role of carboxylesterase 1 and impact of natural genetic variants on the hydrolysis of trandolapril". Biochem Pharmacol. 77 (7): 1266–72. doi:10.1016/j.bcp.2008.12.017. PMID 19185566.
- Thomsen R, Rasmussen HB, Linnet K, INDICES Consortium (Jan 2014). "In vitro drug metabolism by human carboxylesterase 1: focus on angiotensin-converting enzyme inhibitors". Drug Metab Dispos. 42 (1): 126–33. doi:10.1124/dmd.113.053512. PMID 24141856. S2CID 206496779.
- Zhu HJ, Markowitz JS (Feb 2009). "Activation of the antiviral prodrug oseltamivir is impaired by two newly identified carboxylesterase 1 variants". Drug Metab Dispos. 37 (2): 264–7. doi:10.1124/dmd.108.024943. PMID 19022936. S2CID 9277216.
- Paré G, Eriksson N, Lehr T, Connolly S, Eikelboom J, Ezekowitz MD, Axelsson T, Haertter S, Oldgren J, Reilly P, Siegbahn A, Syvanen AC, Wadelius C, Wadelius M, Zimdahl-Gelling H, Yusuf S, Wallentin L (Apr 2013). "Genetic determinants of dabigatran plasma levels and their relation to bleeding". Circulation. 127 (13): 1404–12. doi:10.1161/CIRCULATIONAHA.112.001233. PMID 23467860.
- Zhu HJ, Patrick KS, Yuan HJ, Wang JS, Donovan JL, DeVane CL, Malcolm R, Johnson JA, Youngblood GL, Sweet DH, Langaee TY, Markowitz JS (Jun 2008). "Two CES1 gene mutations lead to dysfunctional carboxylesterase 1 activity in man: clinical significance and molecular basis". Am J Hum Genet. 82 (6): 1241–8. doi:10.1016/j.ajhg.2008.04.015. PMC 2427248. PMID 18485328.
- Redinbo MR, Bencharit S, Potter PM (Jun 2003). "Human carboxylesterase 1: from drug metabolism to drug discovery". Biochem Soc Trans. 31 (Pt 3): 620–4. doi:10.1042/bst0310620. PMID 12773168.
- مشارکتکنندگان ویکیپدیا. «Carboxylesterase 1». در دانشنامهٔ ویکیپدیای انگلیسی، بازبینیشده در ۱۴ مارس ۲۰۲۱.
برای مطالعهٔ بیشتر
- Riddles PW, Richards LJ, Bowles MR, Pond SM (1992). "Cloning and analysis of a cDNA encoding a human liver carboxylesterase". Gene. 108 (2): 289–92. doi:10.1016/0378-1119(91)90448-K. PMID 1748313.
- Munger JS, Shi GP, Mark EA, et al. (1991). "A serine esterase released by human alveolar macrophages is closely related to liver microsomal carboxylesterases". J. Biol. Chem. 266 (28): 18832–8. PMID 1918003.
- Long RM, Calabrese MR, Martin BM, Pohl LR (1991). "Cloning and sequencing of a human liver carboxylesterase isoenzyme". Life Sci. 48 (11): PL43–9. doi:10.1016/0024-3205(91)90515-D. PMID 1997784.
- Ketterman AJ, Bowles MR, Pond SM (1990). "Purification and characterization of two human liver carboxylesterases". Int. J. Biochem. 21 (12): 1303–12. doi:10.1016/0020-711X(89)90149-3. PMID 2612723.
- Becker A, Böttcher A, Lackner KJ, et al. (1994). "Purification, cloning, and expression of a human enzyme with acyl coenzyme A: cholesterol acyltransferase activity, which is identical to liver carboxylesterase". Arterioscler. Thromb. 14 (8): 1346–55. doi:10.1161/01.atv.14.8.1346. PMID 8049197.
- Kroetz DL, McBride OW, Gonzalez FJ (1993). "Glycosylation-dependent activity of baculovirus-expressed human liver carboxylesterases: cDNA cloning and characterization of two highly similar enzyme forms". Biochemistry. 32 (43): 11606–17. doi:10.1021/bi00094a018. PMID 8218228.
- Shibata F, Takagi Y, Kitajima M, et al. (1993). "Molecular cloning and characterization of a human carboxylesterase gene". Genomics. 17 (1): 76–82. doi:10.1006/geno.1993.1285. PMID 8406473.
- Langmann T, Becker A, Aslanidis C, et al. (1997). "Structural organization and characterization of the promoter region of a human carboxylesterase gene". Biochim. Biophys. Acta. 1350 (1): 65–74. doi:10.1016/S0167-4781(96)00142-X. PMID 9003459.
- Brzezinski MR, Spink BJ, Dean RA, et al. (1997). "Human liver carboxylesterase hCE-1: binding specificity for cocaine, heroin, and their metabolites and analogs". Drug Metab. Dispos. 25 (9): 1089–96. PMID 9311626.
- Yan B, Matoney L, Yang D (1999). "Human carboxylesterases in term placentae: enzymatic characterization, molecular cloning and evidence for the existence of multiple forms". Placenta. 20 (7): 599–607. doi:10.1053/plac.1999.0407. PMID 10452915.
- Mori M, Hosokawa M, Ogasawara Y, et al. (1999). "cDNA cloning, characterization and stable expression of novel human brain carboxylesterase". FEBS Lett. 458 (1): 17–22. doi:10.1016/S0014-5793(99)01111-4. PMID 10518925. S2CID 5792413.
- Islam MR, Waheed A, Shah GN, et al. (1999). "Human egasyn binds beta-glucuronidase but neither the esterase active site of egasyn nor the C terminus of beta-glucuronidase is involved in their interaction". Arch. Biochem. Biophys. 372 (1): 53–61. doi:10.1006/abbi.1999.1449. PMID 10562416.
- Ghosh S (2001). "Cholesteryl ester hydrolase in human monocyte/macrophage: cloning, sequencing, and expression of full-length cDNA". Physiol. Genomics. 2 (1): 1–8. doi:10.1152/physiolgenomics.2000.2.1.1. PMID 11015575.
- Ghosh S, Natarajan R (2001). "Cloning of the human cholesteryl ester hydrolase promoter: identification of functional peroxisomal proliferator-activated receptor responsive elements". Biochem. Biophys. Res. Commun. 284 (4): 1065–70. doi:10.1006/bbrc.2001.5078. PMID 11409902.
- Alam M, Ho S, Vance DE, Lehner R (2002). "Heterologous expression, purification, and characterization of human triacylglycerol hydrolase". Protein Expr. Purif. 24 (1): 33–42. doi:10.1006/prep.2001.1553. PMID 11812220.
- Satoh T, Taylor P, Bosron WF, et al. (2002). "Current progress on esterases: from molecular structure to function". Drug Metab. Dispos. 30 (5): 488–93. doi:10.1124/dmd.30.5.488. PMID 11950776.
- Alam M, Vance DE, Lehner R (2002). "Structure-function analysis of human triacylglycerol hydrolase by site-directed mutagenesis: identification of the catalytic triad and a glycosylation site". Biochemistry. 41 (21): 6679–87. doi:10.1021/bi0255625. PMID 12022871.
- Strausberg RL, Feingold EA, Grouse LH, et al. (2003). "Generation and initial analysis of more than 15,000 full-length human and mouse cDNA sequences". Proc. Natl. Acad. Sci. U.S.A. 99 (26): 16899–903. doi:10.1073/pnas.242603899. PMC 139241. PMID 12477932.
- Bencharit S, Morton CL, Xue Y, et al. (2003). "Structural basis of heroin and cocaine metabolism by a promiscuous human drug-processing enzyme". Nat. Struct. Biol. 10 (5): 349–56. doi:10.1038/nsb919. PMID 12679808. S2CID 1108060.
- Zhu HJ, Brinda B, Froehlich TE, Markowitz JS (2012). "A discriminative analytical method for detection of CES1A1 and CES1A2/CES1A3 genetic variants". Pharmacogenet Genomics. 22 (3): 215–8. doi:10.1097/FPC.0b013e32834f03eb. PMC 3412537. PMID 22237548.