لوزالمعده مصنوعی
لوزالمعده مصنوعی یک تکنولوژی در حال توسعه برای کمک به افراد مبتلا به دیابت نوع ۱ است. این تکنولوژی بهطور خودکار و بهطور پیوسته سطح قند خون را کنترل میکند و با ارائه راه کاری جایگزین برای عملکرد غدد درون ریز سعی دارد عملکرد سالم لوزالمعده بهطور مصنوعی تحقق بخشد.
عملکرد غدد درون ریز لوزالمعده وابسته به سلولهای جزیره لانگرهانس است. در این ناحیه همچنین هورمونهای انسولین و گلوکاگون تولید میشود. تکنولوژی لوزالمعده مصنوعی ترشح این هورمونها را در جریان خون در پاسخ به تغییرات سطح گلوکز خون بدن، بهطور مصنوعی تأمین میکند. حفظ سطح متعادل قند خون برای عملکرد مغز، کبد و کلیهها ضروری است.[1] بنابراین، برای بیماران نوع ۱ ضروری است که وقتی بدن قادر به تولید انسولین خود نیست، سطوح متعادل باقی بمانند.[1]
لوزالمعده مصنوعی یک اصطلاح وسیع است که برای استراتژیهای مختلف زیست فناوری که هماکنون در حال توسعه میباشند مورد استفاده قرار میگیرد و تلاش دارد تا هرچه بهتر به نیازهایی که در بالا گفته شد پاسخ دهد. روشهای مختلف زیست فناوری در نظر گرفته شده عبارتند از:
- رویکرد تجهیزات پزشکی - استفاده از یک پمپ انسولین به منظور تزریق تحت کنترل حلقه بسته با استفاده از اطلاعات فیدبکی لحظه ای ناشی از یک نمایشگر قند خون که بهطور پیوسته قادر به اندازهگیری است.
- رویکرد فیزیولوژیکی - توسعه یک درمان با استفاده از سلولهای بنیادی مهندسی که در بدن برای تنظیم قند خون کارآمد تنظیم شدهاند.
رویکردها
رویکرد تجهیزات پزشکی شامل ترکیب یک نمایشگر گلوکز مداوم و یک پمپ انسولین ایمپلنت است. این دستگاه با الگوریتم کنترل کامپیوتری کار میکند تا عملکرد طبیعی لوزالمعده را جایگزین کند.[2][3][4] توسعه نمایشگرهای پیوسته در زمان سطح گلوکز منجر به پیشرفت تکنولوژی لوزالمعده مصنوعی با استفاده از این سیستم یکپارچه شدهاست.[5]
نمایشگرهای مداوم سطح گلوکز
دستگاههای اصلی رایج مورد استفاده در دیابت نوع ۱ دستگاه تست سطح قند خون (انواع گلوکومترها) بودهاست. نمایشگرهای قند خون مداوم یا پیوسته در زمان یکی از اجزای جدا نشدنی لوزالمعده مصنوعی است. همچنین پمپهای انسولین و یک دستگاه قند خون (گلوکومتر) که برای کالیراسیون دستگاه به کار میرود از دیگر اجزای این تکنولوژی است.[6] نمایشگرهای مداوم گلوکز یک پیشرفت جدیدتر هستند و بعد از تصویب FDA در بازار برای استفاده بیماران عرضه شدهاند. هر دو نمایشگر سنتی و مداوم نیاز به تزریق انسولین بهطور دستی یا مصرف کربوهیدرات بسته به میزان عددی که نمایشگر نشان میدهد، دارند. در دستگاههای سنتی قند خون بیمار برای استفاده میبایست انگشت خود برای هر چند ساعت خراش دهد تا بتواند اطلاعات را دریافت کند اما نمایشگرهای مداوم از سنسورهایی که فقط زیر پوست بر روی بازو یا شکم قرار میگیرند، برای ارسال اطلاعات سطح قند خون استفاده میکنند. این اطلاعات به سمت گیرندهها یا برنامههای گوشیهای هوشمند، فرستاده میشود.[7] سنسورها میتوانند تا ۱۰ روز استفاده شوند. تعدادی از نمایشگرهای مداوم مختلف در حال حاضر توسط FDA تأیید شدهاست.[8]
اولین نمایشگر گلوکز مداوم (CGM) در دسامبر ۲۰۱۶ تأیید شد و توسط Dexcom توسعه یافت. سیستم کنترل پیوسته تلفن همراه G5 در این دستگاه این مزیت را داشت که کاربران تنها دو بار در روز انگشت خود را خراش دهند (در حالی که در دستگاههای قدیمی بهطور معمول این عمل ۸ بار صورت میگرفت) این خراش دادن به منظور کالیراسیون حسگرها انجام میگیرد. حسگرها تا هفت روز طول فعالیت درست و دقیق دارند. این دستگاه از فناوری بلوتوث برای هشدار دادن به کاربر از طریق یک گیرنده دستی یا اپلیکیشن در تلفن هوشمند استفاده میکند. این هشدار وقتی صادر میشود که سطح قند خون پایینتر از یک نقطه خاص قرار گیرد. هزینهٔ این دستگاه به بدون در نظر گرفتن خدمات بیمه ای، سالانه حدود ۴۸۰۰ دلار است.[8]
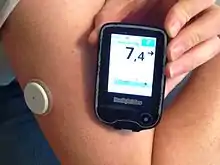
دستگاه نمایشگر مداوم گلوکز یا CGM به اسم FreeStyle متعلق به آزمایشگاه Abbott در سپتامبر ۲۰۱۷ تأیید شد. به تازگی، این تکنولوژی از طریق برنامه LibreLink قادر است تا برای استفاده از گوشیهای هوشمند رابط کاربری خود را بهبود ببخشد. خبر خوشحالکننده این که این دستگاه به هیچ وجه نیازی به خراش انگشت ندارد و سنسور، بر روی بازو قرار میگیرد و تا ۱۰ روز حسگرها قادر به اندازهگیری صحیح هستند. هزینه برآورد شده برای این نمایشگر ۱٬۳۰۰ دلار در سال است.[8]
مدل CGM بعدی G6 مدل Dexcom در مارس ۲۰۱۸ تأیید شد، که سنسورها تا ده روز عملکرد صحیح دارند و نیازی به کالیبراسیون از طریق خراش انگشت و نمونه برداری نیست. این محصول مانند نمایشگر Medtronic، میتواند روند سطح گلوکز را پیشبینی کند. این نمایشگرها برای ادغام با پمپهای انسولین سازگار هستند.[8]
سیستم حلقه بسته
صرف نظر از سنسور مداوم، سیستم پاسخ بسته به غیر نیاز به خواندن مقادیر از مانیتور یا نمایشگر مداوم، نیازی به ورود مقادیر از سمت کاربر ندارد. نمایشگر مداوم و سیستم پمپ انسولین به همراه یکدیگر بهطور خودکار میزان هورمون مورد نیاز را محاسبه کرده و به فرد تزریق میکند. طبیعتاً این محاسبه از طریق اطلاعاتی است که سنسورهای مداوم از سطح قند خون به دست آوردهاند. این سیستم همان چیزی است که دستگاه لوزالمعده مصنوعی را تشکیل میدهد.[6][7]
MiniMed 670G
در سپتامبر ۲۰۱۶ دستگاه Medtronic MiniMed 670G را سازمان FDA تأیید کرد. این مورد اولین سیستم تأیید شده هیبرید بسته بود. این دستگاه نیاز فرد دیابتی به انسولین را حس میکند و بهطور خودکار بسته به نیاز فرد، تزریق ماده به بدن فرد را خواهد داشت.[9] این سیستم از یک نمایشگر مداوم گلوکز، یک پمپ انسولین و یک گلوکومتر یا اندازه گیرگلوکز برای کالیبراسیون ساخته شدهاست. این دستگاه بهطور خودکار میزان انسولین تحولی را تنظیم میکند این اصلاح میزان انسولین تزریقی بر اساس اطلاعاتی است که نمایشگر مداوم قند خون به دست میآورد. این کار با ارسال دادههای قند خون از طریق الگوریتمی انجام میشود که تجزیه و تحلیل و تنظیمات بعدی مورد احتیاج را انجام میدهد.[9] سیستم دارای دو حالت است. حالت دستی به کاربر اجازه میدهد تا نرخ میزان انسولین تحویلی را انتخاب کند. حالت اتوماتیک سطوح انسولین پایه را از خواندن هر مانیتور مداوم هر پنج دقیقه تنظیم میکند.[10]
این دستگاه در ابتدا تنها برای کسانی که در سن ۱۴ سالگی یا بیشتر بودند، مجاز بود و در ماه ژوئن ۲۰۱۸ توسط FDA برای استفاده در کودکان ۷ تا ۱۴ ساله نیز تأیید شد. خانوادهها با استفاده از این سیستم جدید کیفیت خواب بهتر را گزارش کردهاند، زیرا آنها مجبور نیستند نگرانیهای خود را در مورد بررسی میزان قند خون در شب داشته باشند.[11] هزینه کامل این سیستم ۳۷۰۰ دلار است، اما بیماران این فرصت را دارند تا آن را با قیمت کمتری دریافت کنند.[12]
لوزالمعده بیونیک iLet
یک تیم در دانشگاه بوستون که در همکاری با بیمارستان عمومی ماساچوست در یک سیستم لوزالمعده مصنوعی هورمون دوگانه[13] کار میکرد، آزمایشهای بالینی را بر روی دستگاه خود به نام پانکراس بیونیک در سال ۲۰۰۸ آغاز کرد.[14] در سال ۲۰۱۶ شرکت Benefit Public Beta Bionics تشکیل شد. در رابطه با تشکیل این شرکت، Beta Bionics نام اولیه برای دستگاه خود را از لوزالمعده بیونیک به iLet تغییر داد.[14] این دستگاه با استفاده از یک سیستم حلقه بسته به تزریق هر دو هورمون انسولین و گلوکاگون در پاسخ به تغییرات سطح قند خون شناخته شدهاست. نسل چهارم نسخهٔ iLet که در سال ۲۰۱۷ عرضه شدهاست، هنوز برای استفاده عمومی تأیید نشدهاست، این دستگاه اندازه ای در حدود یک آیفون با رابط کاربری صفحه لمسی است. این دستگاه شامل دو مخزن برای هر دو هورمون انسولین و گلوکاگون است و دستگاه برای استفاده از تنها یک هورمون یا هر دو قابل تنظیم است.[15] در حالی که آزمایشهای همچنان ادامه دارد، iLet تأیید نهایی را برای سیستم انسولین به تنهایی در سال ۲۰۲۰ را در نظر دارد.[14]
مطالعات فعلی
چهار مطالعه در سیستمهای مختلف لوزالمعده مصنوعی از سال ۲۰۱۷ آغاز شدهاست و نوید تغییر در آینده نزدیکی را میدهند. این پروژهها توسط موسسه ملی دیابت و بیماریهای گوارشی و کلیه (NIDDK) سرمایهگذاری میشود و در بخش پایانی آزمایش دستگاه درست قبل از درخواست تأیید نهایی برای استفاده عمومی قرار دارد. شرکت کنندگان در این مطالعات میتوانند در هنگام استفاده از دستگاههای خود زندگی خود را در خانه تجربه کنند و از راه دور برای ایمنی، کارایی و تعدادی از عوامل دیگر مورد نظارت واقع شوند.[16]
آزمایش دیالیز بینالمللی دیابتی[17] که توسط محققان از دانشگاه ویرجینیا هدایت میشود، یک سیستم حلقه بسته با نام inControl را آزمایش میکند که دارای رابط کاربری گوشی هوشمند است. ۲۴۰ نفر از افراد سنین ۱۴ و بالاتر برای ۶ ماه شرکت میکنند.[16]
یک آزمایش سالانه به رهبری محققان دانشگاه کمبریج در ماه مه ۲۰۱۷ آغاز شده و حدود ۱۵۰ نفر از افراد سنین ۶ تا ۱۸ سال را مورد بررسی قرار داده است.[16] سیستم لوزالمعده مصنوعی مورد مطالعه از یک گوشی هوشمند استفاده میکند و دارای ویژگی سطح گلوکز پایین برای بهبود کنترل سطح قند است.[18]
مرکز بینالمللی دیابت در مینیاپولیس، مینه سوتا، در همکاری با مرکز پزشکی اشنایدر کودکان در پتخ تیکوا، اسرائیل، در حال برنامهریزی یک مطالعه ۶ ماهه است که در اوایل ۲۰۱۹ آغاز خواهد شد و شامل ۱۱۲ نوجوان و جوان ۱۴ تا ۳۰ ساله است.[16][19] هدف اصلی مطالعه این است که سیستم کنونی Medtronic 670G را با یک سیستم جدید توسعه یافته Medtronic مقایسه کنند. سیستم جدید دارای برنامهریزی است که در نهایت هدف آن بهبود کنترل قند خون در طول صرف غذا است، که هنوز هم به عنوان یک چالش بزرگ در این زمینه مطرح است.[19]
این مطالعه ۶ ماهه که توسط تیم لوزالمعده بیونیک انجام میشود، در اواسط سال ۲۰۱۸ آغاز شد و ۳۱۲ شرکتکننده در سن ۱۸ و بالاتر را مورد بررسی قرار دادهاست.[16]
فیزیولوژیکی
شرکت Biotechnical Defymed که در فرانسه مستقر است، در حال توسعه یک دستگاه بیو مصنوعی ایمپلنت به نام MailPan است که دارای یک غشاء سازگار با بافت بدن با نفوذپذیری انتخابی برای کپسوله کردن و پیچیدن انواع سلولهای مختلف، از جمله سلولهای بتای لوزالمعده است.[20] برای کاشت و جایگذاری این دستگاه نیازی به اقدام از طریق سرکوب سیستم ایمنی نیست زیرا غشا مانع از ورود آنتیبادی بیمار به دستگاه و آسیب رساندن به سلولهای پیچیده شده میشود. پس از جراحی کاشته، ورقه غشا برای سالها قابل استفاده است. سلولهایی که دستگاه نگه میدارد میتواند به جای اهداکنندگان انسان از سلولهای بنیادی تولید شود و همچنین ممکن است در آینده با استفاده از اتصالات ورودی و خروجی بدون جراحی جایگزین شود.[20][21] Defymed بهطور جزئی توسط JDRF تأمین مالی میشود این ارگان قبلاً به عنوان بنیاد تحقیقات دیابت نوجوانان شناخته شدهاست، اما اکنون به عنوان یک سازمان برای همه سنین و تمام مراحل دیابت نوع ۱ تعریف میشود.[22][23]
در ماه نوامبر سال ۲۰۱۸، اعلام شد که Defymed با شرکت Kadimastem وابسته به اسرائیل، یک شرکت زیست دارویی که در حال توسعه درمانهای بازسازی مبتنی بر سلولهای بنیادی است، اعلام همکاری کرد. این همکاری برای دریافت کمک مالی دو ساله به ارزش تقریبی ۱٫۴۷ میلیون دلار برای توسعه یک بیو مصنوعی لوزالمعده که دیابت نوع ۱ را درمان میکند، انجام گرفت.[20][24] فناوری سلولهای بنیادی Kadimastem از تمایز سلولهای بنیادی جنینی انسان برای به دست آوردن سلولهای غدد درون ریز لوزالمعده استفاده میکند. اینها شامل سلولهای بتا تولیدکننده انسولین و همچنین سلولهای آلفا است که گلوکاگون تولید میکنند. هر دو سلول خوشههایی مانند جزیره را ترتیب میدهند که ساختار لوزالمعده را مشابه سازی میکنند.[25] هدف از همکاری این است که هر دو تکنولوژی را در یک دستگاه لوزالمعده بیو مصنوعی ترکیب کنند که انسولین را در پاسخگویی به سطوح گلوکز خون آزاد میکند تا به مراحل آزمایش بالینی برسد.[20]
سن دیگو، کالیفرنیا مبتنی بر شرکت زیست فناوری ViaCyte همچنین محصولاتی را برای تهیه یک راه حل برای دیابت نوع ۱ توسعه دادهاست و از یک دستگاه که به وسیله غشاء محافظتی نیمه نفوذ پذیر واکنشی کپسوله گردیدهاست استفاده میکند. این دستگاه حاوی سلولهای نمونه لوزالمعده است که از سلولهای بنیادی جنینی جدا شدهاند.[26][27] بعد از پیوند جراحی در یک روش سرپایی، سلولها به سلولهای غدد درون ریز تبدیل میشوند و خوشههایی مانند جزیره را ترتیب میدهند و عملکرد لوزالمعده را مشابه سازی میکنند و انسولین و گلوکاگون تولید میکنند.[28][29] این تکنولوژی از مطالعات پیش درمانی تا تأیید FDA برای آزمایشهای بالینی فاز ۱ در سال ۲۰۱۴ و ارائه اطلاعات دو ساله از آزمایش در ژوئن ۲۰۱۸ حرکت رو به پیشرفتی داشتهاست.[26][27] آنها گزارش دادند که محصولاتشان، به نام PEC-Encap، در بیماران با دوز کمتر از سطوح درمانی تاکنون همراه با ایمنی بوده و به خوبی با سیستم بدن هماهنگ شدهاست. سلولهای بستهبندی شده پس از کاشته شدن قادر به زنده ماندن و بالغ شدن بودند و با توجه به غشای محافظتی، سیستم ایمنی نتوانست خللی در ادامه حیات آن داشته باشد. فاز دوم آزمایش، اثربخشی محصول را ارزیابی خواهد کرد.[26] ViaCyte نیز حمایت مالی از JDRF در این پروژه دریافت کردهاست.[29]
ابتکارات در سراسر جهان
در ایالات متحده در سال ۲۰۰۶، JDRF (که قبلاً به عنوان بنیاد تحقیقات دیابت نوجوانان شناخته میشد) یک طرح چند ساله را برای کمک به تسریع در توسعه، تصویب قانونی و پذیرش نمایش سطح گلوکز بهطور مداوم و تکنولوژی لوزالمعده مصنوعی راه اندازی کرد.[30][31]
تلاشهای مردمی برای ایجاد و تجاری سازی یک سیستم لوزالمعده مصنوعی کاملاً اتوماتیک نیز بهطور مستقیم از سوی ارگانهای حامی بیمار و جامعه بیماران دیابتی به وجود آمدهاست.[32] Bigfoot Biomedical، یک شرکت که توسط والدین کودکان T1D تأسیس شدهاست، الگوریتمی را ایجاد کرده و در حال توسعه یک دستگاه حلقه بستهاست که میزان قند خون را نمایش میدهد و مقدار انسولین مناسب را مهیا میکند.[33]
منابع
- "The Pancreas and Its Functions | Columbia University Department of Surgery". columbiasurgery.org. Retrieved 2018-11-07.
- Gingras V, Taleb N, Roy-Fleming A, Legault L, Rabasa-Lhoret R (February 2018). "The challenges of achieving postprandial glucose control using closed-loop systems in patients with type 1 diabetes". Diabetes, Obesity & Metabolism. 20 (2): 245–256. doi:10.1111/dom.13052. PMID 28675686.
- Uduku C, Oliver N (October 2017). "Pharmacological aspects of closed loop insulin delivery for type 1 diabetes". Current Opinion in Pharmacology. 36: 29–33. doi:10.1016/j.coph.2017.07.006. PMID 28802779.
- Graf A, McAuley SA, Sims C, Ulloa J, Jenkins AJ, Voskanyan G, O'Neal DN (March 2017). "Moving Toward a Unified Platform for Insulin Delivery and Sensing of Inputs Relevant to an Artificial Pancreas". Journal of Diabetes Science and Technology. 11 (2): 308–314. doi:10.1177/1932296816682762. PMC 5478040. PMID 28264192.
- Apablaza P, Soto N, Codner E (May 2017). "[From insulin pump and continuous glucose monitoring to the artificial pancreas]". Revista Medica De Chile. 145 (5): 630–640. doi:10.4067/S0034-98872017000500011. PMID 28898340.
- Health, Center for Devices and Radiological. "Artificial Pancreas Device System - What is the pancreas? What is an artificial pancreas device system?". www.fda.gov. Retrieved 2018-11-27.
- Elleri D, Dunger DB, Hovorka R (November 2011). "Closed-loop insulin delivery for treatment of type 1 diabetes". BMC Medicine. 9 (1): 120. doi:10.1186/1741-7015-9-120. PMID 22071283.
- "The First Four Continuous Glucose Monitors". Managed Care magazine. 2018-07-04. Archived from the original on 18 April 2019. Retrieved 2018-11-07.
- Health, Center for Devices and Radiological. "Recently-Approved Devices - The 670G System - P160017". wayback.archive-it.org. Retrieved 2018-11-07.
- "MiniMed 670G Insulin Pump System | World's First Hybrid Closed Loop System". www.medtronicdiabetes.com. Retrieved 2018-11-07.
- "FDA Approves the MiniMed 670G System for Children 7-13 - The LOOP Blog". www.medtronicdiabetes.com. Retrieved 2018-11-07.
- "Update on MiniMed 670G Availability". www.medtronicdiabetes.com. Retrieved 2018-11-07.
- "bionicpancreas.org". www.bionicpancreas.org. Retrieved 2018-11-07.
- "Update on the iLet Bionic Pancreas Closed Loop System". Healthline. Retrieved 2018-11-07.
- "Bionic Pancreas Passes Critical Science Hurdle | BU Today | Boston University". BU Today. Retrieved 2018-11-07.
- "The Miracle of an Artificial Pancreas | NIH MedlinePlus the Magazine". Retrieved 2018-11-28.
- ClinicalTrials.gov NCT02844517 International Diabetes Closed Loop (iDCL) Trial: Research Site Training Protocol
- ClinicalTrials.gov NCT02925299 Day and Night Closed-loop in Young People With Type 1 Diabetes
- ClinicalTrials.gov NCT03040414 Fuzzy Logic Automated Insulin Regulation
- "Israeli and French Biotech Companies Partner to Fight Diabetes With Bio-Artificial Pancreas". CTECH - www.calcalistech.com. 2018-11-12. Retrieved 2018-11-28.
- "MailPan ® BioArtificial Pancreas | Defymed, advanced therapies inspired for you". Defymed (به فرانسوی). Retrieved 2018-11-28.
- "Innovative Medical Devices for the Treatment of Diabetes, Defymed Strengthens Its Position as a Worldwide Leader". Retrieved 2018-11-28.
- Canada, JDRF. "What Does JDRF Stand For?". JDRF Canada. Retrieved 2018-11-28.
- "Kadimastem - Stem Cell to Cure Diseases". www.kadimastem.com. Retrieved 2018-11-28.
- "Diabetes - Kadimastem". www.kadimastem.com. Retrieved 2018-11-28.
- Inc., ViaCyte,. "Two-year Data from ViaCyte's STEP ONE Clinical Trial Presented at ADA 2018". www.prnewswire.com. Retrieved 2018-11-29.
- "PEC‐Encap™ (VC-01™)". Viacyte, Inc. Retrieved 2018-11-29.
- "Home". Viacyte, Inc. Retrieved 2018-11-29.
- Schulz TC (August 2015). "Concise Review: Manufacturing of Pancreatic Endoderm Cells for Clinical Trials in Type 1 Diabetes". Stem Cells Translational Medicine. 4 (8): 927–31. doi:10.5966/sctm.2015-0058. PMC 4511151. PMID 26062982.
- KMorandi says (2017-08-10). "Insurers can profit while improving the lives of people with type 1 diabetes". STAT. Retrieved 2017-08-10.