Bcl-2
لنفومای ۲ لنفوسیتهای بی (انگلیسی: B-cell lymphoma 2) که بیشتر با نام اختصاری Bcl-2 شناخته میشود، یک پروتئین است که در انسان توسط ژن «BCL2» کُدگذاری میشود. این مولکول یکی از اعضای اصلی خانواده Bcl-2 است که در ساماندهی بیان ژن و همچنین القا یا مهار آپوپتوز نقش دارند.[1][2] این مولکول نخستین تنظیمکنندهٔ آپوپتوزی بود که در موجودات زنده کشف شد.[3] پروتئین Bcl-2 یکی از نخستین پروتئینهایی که در جریان کشف فرایند جابهجایی کروموزومی میان کروموزومهای ۱۴ و ۱۸ در لنفوم فولیکولار شناسایی شد. اُرتولوگهای[4] این پروتئین در بسیاری از پستانداران کشف شده و نقشهٔ کامل ژنی آن در دسترس است. همچون BCL3، BCL5، BCL9، BCL7A، BCL6 و BCL10، این پروتئین نیز نقش مهمی در سرطان لنفوم دارد.
| BCL2 apoptosis regulator | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| معینکنندهها | |||||||||||||||
| نامهای دیگر | protein phosphatase 1regulatory subunit 50B-cell CLL/lymphoma 2apoptosis regulator Bcl-2Bcl-2BCL2PPP1R50 | ||||||||||||||
| شناسههای بیرونی | GeneCards: | ||||||||||||||
| |||||||||||||||
| همساختشناسی | |||||||||||||||
| گونهها | انسان | موش | |||||||||||||
| Entrez |
|
| |||||||||||||
| آنسامبل |
|
| |||||||||||||
| یونیپروت |
|
| |||||||||||||
| RefSeq (mRNA) |
|
| |||||||||||||
| RefSeq (پروتئین) |
|
| |||||||||||||
| موقعیت (UCSC) | n/a | n/a | |||||||||||||
| جستجوی PubMed | n/a | n/a | |||||||||||||
| ویکیداده | |||||||||||||||
| |||||||||||||||
ایزوفرمها
دو ایزوفرم این مولکول، یعنی ایزوفرمهای ۱ و ۲، تاشدگی مشابهی دارند. اما توانایی متفاوت این ایزوفرمها در اتصال به پروتئینهای BAD و BAK1 و همچنین توپولوژی ساختمانی و پتانسیل الکتریکی شیارهای اتصالی آنان نشان میدهد که فعالیتهای ضد آپوپتوزی مختلفی از یکدیگر دارند.[5]
اهمیت بالینی
آسیب به ژن سازندهٔ Bcl-2 در بروز چندین نوع سرطان از جمله ملانوما،[6][7] سرطان پستان، سرطان پروستات، لوسمی مزمن لنفاوی و سرطان ریه (کارسینومای سلول کوچک)[8] نقش دارد. همچنین نقص ژنی BCL2 ممکن است سببساز اسکیزوفرنی[9] و اختلالات خودایمنی[10] شود. علاوه بر اینها، این پروتئین در شکلگیری مقاومتهای درمانی در سرطان حائز اهمیت است.[11]
تعاملهای شیمیایی
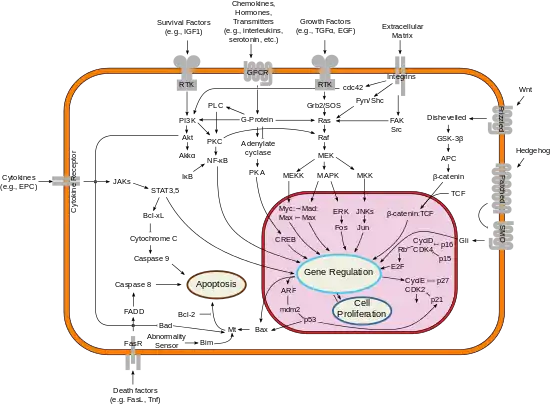
پروتئینِ Bcl-2 با مولکولهای زیر تعامل پروتئین-پروتئین دارد:
منابع
- Tsujimoto Y, Finger LR, Yunis J, Nowell PC, Croce CM (Nov 1984). "Cloning of the chromosome breakpoint of neoplastic B cells with the t(14;18) chromosome translocation". Science. 226 (4678): 1097–9. Bibcode:1984Sci...226.1097T. doi:10.1126/science.6093263. PMID 6093263.
- Cleary ML, Smith SD, Sklar J (Oct 1986). "Cloning and structural analysis of cDNAs for bcl-2 and a hybrid bcl-2/immunoglobulin transcript resulting from the t(14;18) translocation". Cell. 47 (1): 19–28. doi:10.1016/0092-8674(86)90362-4. PMID 2875799. S2CID 31493780.
- Kelly GL, Strasser A (2020). "Toward Targeting Antiapoptotic MCL-1 for Cancer Therapy". Annual Review of Cancer Biology. 4: 299–313. doi:10.1146/annurev-cancerbio-030419-033510.
- "OrthoMaM phylogenetic marker: Bcl-2 coding sequence". Archived from the original on 24 September 2015. Retrieved 20 December 2009.
- پیدیبی 1G5M; Petros AM, Medek A, Nettesheim DG, Kim DH, Yoon HS, Swift K, Matayoshi ED, Oltersdorf T, Fesik SW (March 2001). "Solution structure of the antiapoptotic protein bcl-2". Proceedings of the National Academy of Sciences of the United States of America. 98 (6): 3012–7. Bibcode:2001PNAS...98.3012P. doi:10.1073/pnas.041619798. PMC 30598. PMID 11248023.
- Otake Y, Soundararajan S, Sengupta TK, Kio EA, Smith JC, Pineda-Roman M, Stuart RK, Spicer EK, Fernandes DJ (Apr 2007). "Overexpression of nucleolin in chronic lymphocytic leukemia cells induces stabilization of bcl2 mRNA". Blood. 109 (7): 3069–75. doi:10.1182/blood-2006-08-043257. PMC 1852223. PMID 17179226.
- Vaux DL, Cory S, Adams JM (Sep 1988). "Bcl-2 gene promotes haemopoietic cell survival and cooperates with c-myc to immortalize pre-B cells". Nature. 335 (6189): 440–2. Bibcode:1988Natur.335..440V. doi:10.1038/335440a0. PMID 3262202. S2CID 23593952.
- Kaiser, U.; Schilli, M.; Haag, U.; Neumann, K.; Kreipe, H.; Kogan, E.; Havemann, K. (August 1996). "Expression of bcl-2 — protein in small cell lung cancer". Lung Cancer. 15 (1): 31–40. doi:10.1016/0169-5002(96)00568-5. PMID 8865121.
- Glantz LA, Gilmore JH, Lieberman JA, Jarskog LF (Jan 2006). "Apoptotic mechanisms and the synaptic pathology of schizophrenia". Schizophrenia Research. 81 (1): 47–63. doi:10.1016/j.schres.2005.08.014. PMID 16226876. S2CID 22388783.
- Li A, Ojogho O, Escher A (2006). "Saving death: apoptosis for intervention in transplantation and autoimmunity". Clinical & Developmental Immunology. 13 (2–4): 273–82. doi:10.1080/17402520600834704. PMC 2270759. PMID 17162368.
- Garcia-Aranda M, Perez-Ruiz E, Redondo M (Dec 2018). "Bcl-2 Inhibition to Overcome Resistance to Chemo- and Immunotherapy". International Journal of Molecular Sciences. 19 (12): 3950. doi:10.3390/ijms19123950. PMC 6321604. PMID 30544835.
- Lin B, Kolluri SK, Lin F, Liu W, Han YH, Cao X, Dawson MI, Reed JC, Zhang XK (Feb 2004). "Conversion of Bcl-2 from protector to killer by interaction with nuclear orphan receptor Nur77/TR3". Cell. 116 (4): 527–40. doi:10.1016/s0092-8674(04)00162-x. PMID 14980220. S2CID 17808479.
- Enyedy IJ, Ling Y, Nacro K, Tomita Y, Wu X, Cao Y, Guo R, Li B, Zhu X, Huang Y, Long YQ, Roller PP, Yang D, Wang S (Dec 2001). "Discovery of small-molecule inhibitors of Bcl-2 through structure-based computer screening". Journal of Medicinal Chemistry. 44 (25): 4313–24. doi:10.1021/jm010016f. PMID 11728179.
- Zhang H, Nimmer P, Rosenberg SH, Ng SC, Joseph M (Aug 2002). "Development of a high-throughput fluorescence polarization assay for Bcl-x(L)". Analytical Biochemistry. 307 (1): 70–5. doi:10.1016/s0003-2697(02)00028-3. PMID 12137781.
- Chen L, Willis SN, Wei A, Smith BJ, Fletcher JI, Hinds MG, Colman PM, Day CL, Adams JM, Huang DC (Feb 2005). "Differential targeting of prosurvival Bcl-2 proteins by their BH3-only ligands allows complementary apoptotic function". Molecular Cell. 17 (3): 393–403. doi:10.1016/j.molcel.2004.12.030. PMID 15694340.
- Real PJ, Cao Y, Wang R, Nikolovska-Coleska Z, Sanz-Ortiz J, Wang S, Fernandez-Luna JL (Nov 2004). "Breast cancer cells can evade apoptosis-mediated selective killing by a novel small molecule inhibitor of Bcl-2". Cancer Research. 64 (21): 7947–53. doi:10.1158/0008-5472.CAN-04-0945. PMID 15520201.
- Qin W, Hu J, Guo M, Xu J, Li J, Yao G, Zhou X, Jiang H, Zhang P, Shen L, Wan D, Gu J (Aug 2003). "BNIPL-2, a novel homologue of BNIP-2, interacts with Bcl-2 and Cdc42GAP in apoptosis". Biochemical and Biophysical Research Communications. 308 (2): 379–85. doi:10.1016/s0006-291x(03)01387-1. PMID 12901880.
- Boyd JM, Malstrom S, Subramanian T, Venkatesh LK, Schaeper U, Elangovan B, D'Sa-Eipper C, Chinnadurai G (Oct 1994). "Adenovirus E1B 19 kDa and Bcl-2 proteins interact with a common set of cellular proteins". Cell. 79 (2): 341–51. doi:10.1016/0092-8674(94)90202-X. PMID 7954800. S2CID 38609845.
- Ray R, Chen G, Vande Velde C, Cizeau J, Park JH, Reed JC, Gietz RD, Greenberg AH (Jan 2000). "BNIP3 heterodimerizes with Bcl-2/Bcl-X(L) and induces cell death independent of a Bcl-2 homology 3 (BH3) domain at both mitochondrial and nonmitochondrial sites". The Journal of Biological Chemistry. 275 (2): 1439–48. doi:10.1074/jbc.275.2.1439. PMID 10625696.
- Yasuda M, Han JW, Dionne CA, Boyd JM, Chinnadurai G (Feb 1999). "BNIP3alpha: a human homolog of mitochondrial proapoptotic protein BNIP3". Cancer Research. 59 (3): 533–7. PMID 9973195.
- Komatsu K, Miyashita T, Hang H, Hopkins KM, Zheng W, Cuddeback S, Yamada M, Lieberman HB, Wang HG (Jan 2000). "Human homologue of S. pombe Rad9 interacts with BCL-2/BCL-xL and promotes apoptosis". Nature Cell Biology. 2 (1): 1–6. doi:10.1038/71316. PMID 10620799. S2CID 52847351.
- Yang E, Zha J, Jockel J, Boise LH, Thompson CB, Korsmeyer SJ (Jan 1995). "Bad, a heterodimeric partner for Bcl-XL and Bcl-2, displaces Bax and promotes cell death". Cell. 80 (2): 285–91. doi:10.1016/0092-8674(95)90411-5. PMID 7834748. S2CID 10343291.
- Hoetelmans RW (Jun 2004). "Nuclear partners of Bcl-2: Bax and PML". DNA and Cell Biology. 23 (6): 351–4. doi:10.1089/104454904323145236. PMID 15231068.
- Oltvai ZN, Milliman CL, Korsmeyer SJ (Aug 1993). "Bcl-2 heterodimerizes in vivo with a conserved homolog, Bax, that accelerates programmed cell death". Cell. 74 (4): 609–19. doi:10.1016/0092-8674(93)90509-O. PMID 8358790. S2CID 31151334.
- Gillissen B, Essmann F, Graupner V, Stärck L, Radetzki S, Dörken B, Schulze-Osthoff K, Daniel PT (Jul 2003). "Induction of cell death by the BH3-only Bcl-2 homolog Nbk/Bik is mediated by an entirely Bax-dependent mitochondrial pathway". The EMBO Journal. 22 (14): 3580–90. doi:10.1093/emboj/cdg343. PMC 165613. PMID 12853473.
- Wang HG, Rapp UR, Reed JC (Nov 1996). "Bcl-2 targets the protein kinase Raf-1 to mitochondria". Cell. 87 (4): 629–38. doi:10.1016/s0092-8674(00)81383-5. PMID 8929532. S2CID 16559750.
- Poulaki V, Mitsiades N, Romero ME, Tsokos M (Jun 2001). "Fas-mediated apoptosis in neuroblastoma requires mitochondrial activation and is inhibited by FLICE inhibitor protein and Bcl-2". Cancer Research. 61 (12): 4864–72. PMID 11406564.
- Guo Y, Srinivasula SM, Druilhe A, Fernandes-Alnemri T, Alnemri ES (Apr 2002). "Caspase-2 induces apoptosis by releasing proapoptotic proteins from mitochondria". The Journal of Biological Chemistry. 277 (16): 13430–7. doi:10.1074/jbc.M108029200. PMID 11832478.
- Iwahashi H, Eguchi Y, Yasuhara N, Hanafusa T, Matsuzawa Y, Tsujimoto Y (Nov 1997). "Synergistic anti-apoptotic activity between Bcl-2 and SMN implicated in spinal muscular atrophy". Nature. 390 (6658): 413–7. Bibcode:1997Natur.390..413I. doi:10.1038/37144. PMID 9389483. S2CID 1936633.
- Pasinelli P, Belford ME, Lennon N, Bacskai BJ, Hyman BT, Trotti D, Brown RH (Jul 2004). "Amyotrophic lateral sclerosis-associated SOD1 mutant proteins bind and aggregate with Bcl-2 in spinal cord mitochondria". Neuron. 43 (1): 19–30. doi:10.1016/j.neuron.2004.06.021. PMID 15233914. S2CID 18141051.
- O'Connor L, Strasser A, O'Reilly LA, Hausmann G, Adams JM, Cory S, Huang DC (Jan 1998). "Bim: a novel member of the Bcl-2 family that promotes apoptosis". The EMBO Journal. 17 (2): 384–95. doi:10.1093/emboj/17.2.384. PMC 1170389. PMID 9430630.
- Hsu SY, Lin P, Hsueh AJ (Sep 1998). "BOD (Bcl-2-related ovarian death gene) is an ovarian BH3 domain-containing proapoptotic Bcl-2 protein capable of dimerization with diverse antiapoptotic Bcl-2 members". Molecular Endocrinology. 12 (9): 1432–40. doi:10.1210/mend.12.9.0166. PMID 9731710.
- مشارکتکنندگان ویکیپدیا. «Bcl-2». در دانشنامهٔ ویکیپدیای انگلیسی، بازبینیشده در ۱۴ نوامبر ۲۰۲۰.
پیوند به بیرون
- bcl-2 Genes در سرعنوانهای موضوعی پزشکی (MeSH) در کتابخانهٔ ملی پزشکی ایالات متحدهٔ آمریکا
- c-bcl-2 Proteins در سرعنوانهای موضوعی پزشکی (MeSH) در کتابخانهٔ ملی پزشکی ایالات متحدهٔ آمریکا
- مکان ژنوم BCL2 انسانی و صفحهٔ جزئیات ژنی BCL2 در سامانه جستجوی بانک ژنی دانشگاه کالیفرنیا، سانتا کروز.
- خلاصهای از اطلاعات ساختاری موجود در بانک داده پروتئین برای یونیپروت: P10415 (Human Apoptosis regulator Bcl-2) در PDBe-KB.