سرطان ریه
سرطان ریه (به انگلیسی: Lung cancer) نوعی بیماری است که مشخصه آن رشد کنترلنشده سلول در بافتهای ریه است. اگر این بیماری درمان نشود، رشد سلولی میتواند در یک فرایند به نام متاستاز به بیرون از ریه گسترش پیدا کند و به بافتهای اطراف یا سایر اعضای بدن برسد. اکثر سرطانهایی که از ریه شروع میشوند، به نام سرطانهای ابتدایی ریه، کارسینوماهایی هستند که از بافت پوششی نشات میگیرند. انواع اصلی سرطان ریه سرطانهای ریه سلول کوچک (SCLC)، که سرطان سلولی جو شکل نیز نامیده میشود، و سرطان ریه سلول غیر کوچک (NSCLC) هستند. شایعترین علائم عبارتند از سرفه (همراه با خلط خونی)، کاهش وزن و تنگی نفس.[1]
| سرطان ریه | |
|---|---|
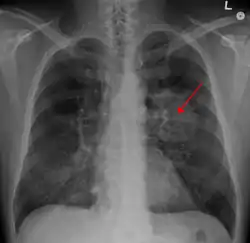 | |
| نمونهای از تومور موجود در ریه که توسط پیکانی بر روی رادیوگرافی قفسه سینه نشان داده شدهاست. | |
| طبقهبندی و منابع بیرونی | |
| تخصص | سرطانشناسی |
| آیسیدی-۱۰ | C33-C34 |
| آیسیدی-9-CM | 162 |
| دادگان بیماریها | 7616 |
| مدلاین پلاس | 007194 |
| ئیمدیسین | med/۱۳۳۳ med/1336 emerg/335 radio/807 radio/405radio/406 |
| پیشنت پلاس | سرطان ریه |
| سمپ | D002283 |
شایعترین علت سرطان ریه قرار گرفتن در معرض دود دخانیات[2] برای مدتی طولانی دلیل ۹۰٪ سرطانهای ریه است.[1] درصد ابتلا به سرطان ریه در افرادی که سیگار نمیکشند ۱۵٪ است،[3] و دلیل این موارد اغلب ترکیبی از عوامل ژنتیکی،[4] گاز رادون،[4] آزبست،[5] و آلودگی هوا[4] از جمله دود سیگار فرد ثالث مربوط میشود.[6][7] ممکن است سرطان ریه در رادیوگرافی قفسه سینه و مقطعنگاری رایانهای (سیتی اسکن) قابل تشخیص باشد. تشخیص با یک بافتبرداری[8] که اغلب از طریق برونکوسکوپی یا راهنمای سیتی انجام میشود، قابل تأیید شدن است. درمان و نتایج طولانی مدت به نوع سرطان، مرحله (شدت گسترش) و سلامت کلی فرد، که از طریق وضعیت عملکرد سنجیده میشود، بستگی دارد.
درمانهای رایج، عبارتند از جراحی، شیمیدرمانی و پرتودرمانی. گاهی اوقات NSCLC با جراحی قابل درمان است، اما معمولاً SCLC به شیمی درمانی و پرتودرمانی بهتر پاسخ میدهد.[9] بهطور کل، ۱۵٪ از مردم ایالات متحده آمریکا که طبق تشخیص پزشک به سرطان ریه مبتلا بودهاند پنج سال بعد از تشخیص بیماری زنده ماندند.[10] در سراسر دنیا، سرطان ریه شایعترین دلیل مرگ و میر مربوط به سرطان در بین زنان و مردان بهشمار میرود، و مسئول ۱٫۳۸ میلیون مرگ و میر در سال، طبق گزارش سال ۲۰۰۸ است.[11]
نشانهها و علائم
نشانهها و علائمی که ممکن است نشان دهنده سرطان ریه باشند:[1]
- علائم تنفسی: سرفه، خلط خونی، خس خس سینه یا تنگی نفس
- علائم سیستمیک: کاهش وزن، تب، چماقی شدن ناخنهای انگشت، یا ضعف
- علائم ناشی از فشار موضعی: درد قفسه سینه، درد استخوان، انسداد ورید اجوف فوقانی، مشکل در بلعیدن
اگر سرطان در راه تنفسی رشد کند، ممکن است جلوی جریان هوا را سد سازد، و موجب مشکل در تنفس شود. این امر میتواند منجر به تجمع ترشحات در پشت گرفتگی شود، و مستعد سینهپهلو خواهد بود.[1]
بسته به نوع تومور، به اصطلاح پدیده پارانئوپلاستیک ممکن است در آغاز به بیماری جلب توجه کند.[12] در سرطان ریه، این پدیدهها میتوانند شامل سندرم میاستنیک لامبرت-ایتون (ضعف عضلات به دلیل بیماری خودایمنی) هایپرکلسمی، یا سندرم هورمون ضد ادرار نامناسب (SIADH) شوند. تومورها در بالای ریه، به نام تومور پانکوست، ممکن است به بخش موضعی از دستگاه عصبی سمپاتیک حمله کنند، و موجب سندرم هورنر (افتادگی پلک و کوچک شدن مردمک در آن طرف)، و نیز آسیب به شبکه بازویی شوند.[1]
این سرطانها بهطور تصادفی و هنگام انجام رادیوگرافیهای بهطور منظم تشخیص داده میشوند.[10] بسیاری از علائم سرطان ریه (کم اشتهایی، کم شدن وزن، تب، خستگی) مختص این بیماری نیستند.[8] در بسیاری از افراد، قبل از اینکه علائم مشخص شوند و فرد به دنبال درمان پزشکی برود، سرطان از محل اصلی خود فراتر رفته و گسترش پیدا کردهاست. محلهای شایع گسترش سرطان ریه عبارتند از مغز، استخوان، غدد فوق کلیوی، ریه دیگر، کبد، پیراشامه، و کلیهها.[13] در حدود ۱۰٪ از افراد مبتلا به سرطان ریه در زمان تشخیص علائمی قابل مشاهده نیست؛ این سرطانها در زمان رادیوگرافی منظم قفسه سینه بهطور تصادفی تشخیص داده میشوند.[10]
علل
سرطان پس از آسیب ژنتیکی به دیانای گسترش مییابد. این آسیب ژنتیکی بر روی عملکرد طبیعی سلول، از جمله تکثیر سلولی، مرگ سلولی برنامهریزی شده (آپوپتوز) و ترمیم دی ان ای تأثیر میگذارد. هر چقدر آسیب بیشتر شود، خطر ابتلا به سرطان افزایش مییابد.[14]
سیگار کشیدن
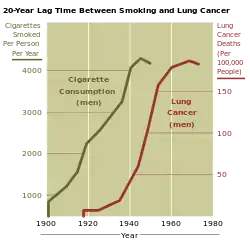
استعمال دخانیات، به ویژه سیگار تاکنون دلیل اصلی ابتلا به سرطان ریه بودهاست.[15] دود سیگار حاوی بیش از ۶۰ ماده سرطانزا شناخته شدهاست[16] از جمله ایزوتوپ پرتوزا ناشی از فرایند تجزیه رادون، نیترو آمین و بنزوپیرین. به علاوه، نیکوتین واکنش ایمنی بدن را در مقابل رشد سلولهای سرطانی در بافتهای آسیب دیده سرکوب میکند.[17] در سراسر دنیای توسعه یافته، ۹۰٪ از مرگ و میرهای ناشی از سرطان ریه در مردان در طول سال ۲۰۰۰ به استعمال دخانیات مربوط بودهاست (۷۰٪ برای زنان).[18] کشیدن سیگار علت ۸۹–۹۰٪ از موارد ابتلا به سرطان ریه است.[1] به نظر متخصصان سیگار احتمال ابتلا به این بیماری را تا ۲۰ برابر و آلودگی هوا تا دو برابر افزایش میدهد.[19]
استنشاق دود سیگار —فروبردن دود زمانی که فرد دیگری سیگار میکشد -یکی از دلایل ابتلا به سرطان ریه در افرادی است که سیگار نمیکشند. فردی که دود سیگار استنشاق میکند در گروه فردی قرار میگیرد که با یک انسان سیگاری زندگی یا کار میکند. مطالعات بدست آمده از ایالات متحده آمریکا،[20][21] اروپا،[22] انگلستان، ,[23] و استرالیا،[24] بهطور مداوم نشان دادهاند که خطر ابتلا به سرطان ریه در میان افرادی که در معرض دود سیگار دیگران هستند، بهطور چشمگیری افزایش داشتهاست.[25] احتمال خطر ابتلا به سرطان ریه در افرادی که با یک فرد سیگاری زندگی میکنند، ۳۰٪ بیشتر است در حالیکه افرادی که در محیطی کار میکنند که دود سیگار دیگران در آنجا وجود دارد، با ۱۹٪ افزایش خطر ابتلا مواجه هستند.[26] تحقیقات دربارهٔ دود جریان کناری نشان میدهد که این نوع دود از دود مستقیم خطرناک تر است.[27] استنشاق دود سیگار دلیل سالانه حدود ۳٬۴۰۰ مرگ و میر ناشی از سرطان ریه در ایاات متحده آمریکا است.[21]
گاز رادون
رادون یک گاز بیرنگ و بیبو است که در اثر تجزیه رادیم رادیواکتیو که خود محصول تجزیه اورانیوم موجود در پوسته زمین است، به وجود میآید. محصولات تجزیه شده در اثر پرتو مواد ژنتیکی را یونیزه میکنند و موجب جهشهایی میشوند که گاهی اوقات سرطان زا هستند. رادون، بعد از استعمال دخانیات، دومین دلیل شایع سرطان ریه در ایالات متحده آمریکا است.[21] خطر سرطان درازای هر ۱۰۰ Bq/m³ افزایش در تجمع رادون، ۸–۱۶٪ افزایش مییابد.[28] میزان گاز رادون بسته به محل و ترکیب خاک و سنگهای زیرین متغیر است. برای نمونه، در مناطقی مانند کورنوال در انگلستان (که گرانیت لایه زیرین آنجا است)، گاز رادون یک مشکل اساسی است، و ساختمانها باید با فن کاملاً تهویه شوند تا تجمع گاز رادون کاهش یابد. آژانس حفاظت محیط زیست ایالات متحده آمریکا (EPA) برآورد کردهاست که از هر ۱۵ خانه در ایالات متحده آمریکا میزان رادون یک خانه بالای دستورالعمل توصیه شده ۴ کوری در لیتر (pCi/l) (148 Bq/m³) است.[29]
پنبه نسوز
پنبه نسوز (پنبه نسوز یا آزبست) میتواند دلیل انواع مختلفی از بیماریهای ریه، از جمله سرطان ریه، باشد. استعمال تنباکو و آزبست روی ایجاد سرطان ریه تأثیر سینرژیک دارد.[5]
آلودگی هوا
آلودگی هوای بیرون تأثیر ناچیزی روی افزایش خطر ابتلا به سرطان ریه دارد.[4] ذرات (PM2.5) و ذرات گوگرد، که ممکن است از دود اگزوز خودروها ساطع شود، باعث میشوند خطر ابتلا به سرطان به میزان ناچیزی افزایش یابد.[4][30] در خصوص نیتروژن دیاکسید، افزایش تدریجی ۱۰ قسمت در میلیارد احتمال خطر سرطان ریه را ۱۴٪ افزایش میدهد.[31] آلودگی هوای بیرون ۱–۲٪ احتمال خطر ابتلا به سرطان ریه را افزایش میدهد.[4]
شواهد تجربی نشان میدهد که احتمال خطر ابتلا به سرطان ریه در اثر آلودگی هوا در فضای سرپوشیده مربوط به سوختن چوب، زغال چوب، کود یا مانده محصول برای پختوپز و گرم کردن بیشتر است.[32] خطر سرطان ریه در زنانی که در معرض دود زغال در فضای سرپوشیده هستند دو برابر بیشتر است و تعدادی از ضایعات ناشی از سوختن زیستتوده سرطان زا شناخته شدهاند یا مشکوک به آن هستند.[33] این خطر حدود ۲٫۴ میلیون نفر را در سراسر دنیا تحت تأثیر خود قرار دادهاست،[32] و ۱٫۵٪ از مرگ و میرهای ناشی از سرطان ریه به این دلیل اتفاق میافتند.[33]
ژنتیک
اینگونه برآورد شدهاست که ۸ تا ۱۴٪ از موارد سرطان ریه به دلیل عوامل ارثی ایجاد میشوند.[34] احتمال خطر ابتلا به سرطان ریه در افرادی که خویشاوندان او به این بیماری مبتلا هستند، ۲٫۴ برابر بیشتر است. احتمال دارد دلیل این امر ترکیب ژنها باشد.[35]
سایر علل
مواد، مشاغل، و معرضگذاریهای بسیار دیگری با سرطان ریه ارتباط داده شدهاست. آژانس بینالمللی مطالعات سرطان (IARC) عنوان میکند که «شواهد کافی» برای سرطانزا بودن موارد زیر برای ریه در دست است:[36]
- برخی از فلزات (تولید آلومینیوم، کادمیم و ترکیبات کادمیوم، ترکیبات کروم(VI)، بریلیم و ترکیبات بریلیوم، مواد ریختهگری فولاد و آهن، ترکیبات نیکل، آرسنیک و ترکیبات غیرآلی آرسنیک، معدنکاری هماتیت زیرزمینی)
- برخی از محصولات احتراقی (احتراق ناقص، زغال (تابشهای فضای بسته سوخت زغال خانگی)، تبدیل زغال به سوخت گازی، قیر قطران زغالسنگ، تولید زغال کک، دوده، گازهای خروجی موتور دیزل)
- تابشهای یونیزهکننده (تابش اشعه ایکس، رادون-۲۲۲ و محصولات تحلیل رادیواکتیو آن، پرتو گاما، پلوتونیم)
- برخی از گازهای سمی (متیل اتر (رده فنی)، بیس-(کلرومتیل) اتر، گاز خردل، MOPP (ترکیب وینکریستین-پردنیسون-نیتروژن خردل-پروکاربازین)، بخارهای نقاشی)
- تولید لاستیک و کریستالین گرد سیلیکا
- تحقیقات نشان دادهاست که داروهای خوابآور خطر ابتلا به سرطان ریه را سه برابر افزایش میدهد.[37]
پیدایش بیماری
همانند بسیاری از سرطانهای دیگر، سرطان ریه نیز توسط فعال شدن آنکوژن یا غیرفعال شدن ژنهای سرکوبگر تومور آغاز میشود.[38] اعتقاد بر این است که انکوژنها (ژنهای تومورزا) انسانها را بیشتر مستعد سرطان میسازند. اعتقاد بر این است که پروتوانکوژنها در هنگام قرار گرفتن در معرض مواد سرطانزای خاص به انکوژنها (ژنهای تومورزا) تبدیل میشوند.[39] جهشهای ایجاد شده در پروتوانکوژن K-ras مسبب ۱۰–۳۰٪ از آدنوکارسینوماها میباشد.[40][41] پذیرنده عامل رشد روپوستی (EGFR) عملکردهای تکثیر سلولی، خزان یاختهای، رگزایی، و هجوم توموری را تنظیم میکند.[40] جهش و تقویت EGFR در سرطان ریهٔ از نوع «سلولهای غیرکوچک» رایج بوده و پایه و اساس درمان با مهارکنندههای EGFR را شکل میدهد. پروتئین Her2/neu کمتر مورد تأثیر قرار میگیرد.[40] آسیب کروموزومی میتواند به از دست رفتن هتروزیگوتی منجر شود. این موضوع میتواند به غیرفعال شدن ژنهای سرکوبگر تومور منجر شود. آسیبدیدگی کروموزومهای 3p، 5q، 13q، و 17p بهطور خاص در کارسینوم ریه سلول-کوچک رایج است. ژن سرکوبگر تومور پی۵۳، واقع بر روی کروموزوم 17p، در ۶۰–۷۵٪ موارد مورد تأثیر قرار میگیرد.[42] سایر ژنهایی که اغلب مورد جهش یا تقویت قرار میگیرند عبارتند از c-MET, NKX2-1، LKB1، PIK3CA، و BRAF.[40]
تشخیص بیماری
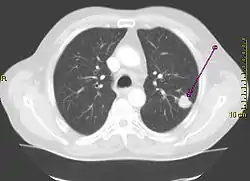
انجام یک رادیوگرافی قفسه سینه یکی از نخستین مراحل تحقیقی است که باید در صورت گزارش نشانههایی توسط فرد که ممکن است دال بر سرطان ریه باشد، صورت پذیرد. این کار میتواند یک توده مشخص، گشادگی میانسینه (که میتواند بیانگر گشادگی غدد لنفاوی واقع در آنجا باشد)، آتلکتازی (جمع شدن ریه)، التهاب ریه، یا ترشح پرده جنبی را آشکار نماید.[2] تصویربرداری سیتی نوعاً به منظور ارائه اطلاعات بیشتر در مورد نوع و درجهٔ بیماری مورد استفاده قرار میگیرد. نایژهبینی یا بافتبرداری هدایت شده توسط سیتی اغلب برای نمونهبرداری تومور برای بافتآسیبشناسی مورد استفاده قرار میگیرد.[10]
سرطان ریه اغلب به صورت یک توده ریوی منزوی بر روی یک پرتونگاری قفسه سینه ظاهر میشود. لیکن تشخیص افتراقی آن بسیار گستردهاست. بسیاری از بیماریهای دیگر نظیر سل، عفونتهای قارچی، سرطان دگردیس، یا التهاب سازماندهنده ریه نیز میتوانند چنین نمودی را نتیجه دهند. از جمله علل کمتر رایج «توده ریوی منزوی» میتوان به هامارتومها، کیستهای برونکوژنیکها، ورمهای غدهای، ناهنجاری شریانی و وریدی، انزوای ریوی، تودههای روماتیسمی، گرانولوماتوز وگنر یا لنفوم اشاره نمود.[43] سرطان ریه همچنین میتواند یک یافتن تصادفی باشد که به صورت یک توده ریوی منزوی بر روی یک پرتونگاری قفسه سینه یا سیتی اسکن انجام شده بنا بر یک دلیل ناشناخته ظاهر میگردد.[44] تشخیص قطعی سرطان ریه بر پایه یک بررسی بر پایهٔ بافتشناسی بافت مورد ظن از نظر ویژگیهای بالینی و ویژگیهای وابسته به پرتونگاری میباشد.[1]
ردهبندی
| نوع وابسته به بافتشناسی | شیوع به ازای هر ۱۰۰٬۰۰۰ نفر در سال |
|---|---|
| همه انواع | ۶۶٫۹ |
| آدنوکارسینوما | ۲۲/۱ |
| کارسینوم سلول-فلسدار | ۱۴/۴ |
| کارسینوم سلول-کوچک | ۹/۸ |
سرطانهای ریه بر اساس نوع وابسته به بافتشناسی ردهبندی میشوند.[8] این ردهبندی برای تعیین نوع مدیریت بیماری و پیشبینی نتایج بیماری حائز اهمیت است. اکثریت قریب به اتفاق سرطانهای ریه کارسینوماها هستند —بدخیمیهایی که در نتیجه بافت پوششی پدید میآیند. — کارسینومهای ریه بر اساس اندازه و شکل سلولهای بدخیم دیده شده توسط یک متخصص هیستوپاتولوژی در زیر یک میکروسکوپ ردهبندی میشوند. دو رده گسترده آنها کارسینوم ریه سلول-غیرکوچک و کارسینوم ریه سلول-کوچک میباشد.[45]
کارسینوم ریه سلول-غیرکوچک

سه نوع فرعی NSCLC عبارتند از آدنوکارسینوما، کارسینوم ریه سلول-فلسدار، و کارسینوم ریه سلول-بزرگ.[1]
حدود ۴۰٪ از سرطانهای ریه «آدنوکارسینوما» هستند که معمولاً در بافت ریوی جانبی شکل میگیرد.[8] اغلب موارد آدنوکارسینوما با سیگار کشیدن در ارتباط هستند؛ لیکن در میان افرادی که در طول عمر خود کمتر از ۱۰۰ نخ سیگار کشیدهاند (غیرسیگاریها)،[1] آدنوکارسینوما رایجترین شکل سرطان ریه است.[46] یک نوع فرعی از آدنوکارسینوما یعنی کارسینوم برونکیولوئالوئولار در زنهای غیرسیگاری رایجتر بوده و ممکن بقای طولانیمدت بهتری را به همراه داشته باشد.[47]
کارسینوم سلول-فلسدار حدود ۳۰٪ از سرطانهای ریه را تشکیل میدهد. آنها نوعاً در نزدیکی مجاری هوای بزرگ پدید میآیند. یک حفره توخالی و مرگ سلولی مرتبط با آن بهطور رایج در مرکز تومور یافت میشود.[8] حدود ۹٪ سرطانهای ریه «کارسینوم سلول-بزرگ» هستند. اینها به این دلیل اینگونه نام گرفتهاند که سلولهای سرطانی مرتبط با آنها بزرگ بوده و دارای سیتوپلاسم زیاد از حد، هستهها بزرگ و هستکهای گرد میانهسته بزرگ میباشند.[8]
کارسینوم ریه سلول-کوچک
_by_core_needle_biopsy.jpg.webp)
در کارسینوم ریه سلول-کوچک (SCLC)، سلولها در بر گیرنده دانههای ترشح عصبی (کیسههای کوچک در بر گیرنده هورمونهای درونتراو عصبی) میباشند که این تومور را با سندروم درونتراو/پارانئوپلاستیک مرتبط ساختهاست.[48] اغلب موارد در مجاری هوای بزرگتر (نایژههای اولیه و ثانویه) پدید میآیند.[10] این سرطانها خیلی سریع رشد پیدا میکنند و خیلی زود در همان مراحل اولیه بیماری گسترش مییابند. شصت تا هفتاد درصد مبتلایان دچار بیماری دگردیس هستند. این نوع سرطان ریه بشدت با سیگار کشیدن در ارتباط است.[1]
سایر موارد
از لحاظ بافتشناسی چهار نوع فرعی اصلی شناخته شدهاست، در حالیکه برخی از سرطانها ممکن است ترکیبی از انواع فرعی مختلف را دربر گیرند.[45] از جمله انواع فرعی نادر میتوان به تومورهای غدهای، تومورهای کارسینوئیدی، و کارسینومهای نامتمایز اشاره نمود.[1]
دگردیسی
| نوع وابسته به بافتشناسی | لکهگذاری ایمنی |
|---|---|
| کارسینوم سلول-فلسدار | CK5/6 مثبت CK7 منفی |
| آدنوکارسینوما | CK7 مثبت TTF-1 مثبت |
| کارسینوم سلول-بزرگ | TTF-1 منفی |
| کارسینوم سلول-کوچک | TTF-1 مثبت CD56 مثبت کروموگرانین مثبت سینپتوفیزین مثبت |
ریه محلی رایج برای گسترش تومور از سایر نقاط بدن است. ردهبندی سرطانهای ثانویه بر اساس محلی که از آن نشأت میگیرند صورت میپذیرد؛ برای مثال سرطان پستانی که به ریه گسترش یافته باشد سرطان پستان دگردیس نامیده میشود. دگردیسیها معمولاً دارای یک ظاهر مشخصه گرد بر روی پرتونگاری قفسه سینه هستند.[49]
خود سرطانهای ریه بهطور رایج به مغز، استخوانها، کبد، و غدد فوق کلیوی دگردیسی پیدا میکنند.[8] لکهگذاری ایمنی یک بیوپسی (زندهبینی) معمولاً برای تشخیص منشأ اصلی آن کارآمد است.[50]
ارزیابی مرحلهٔ پیشرفت بیماری
ارزیابی مرحله پیشرفت سرطان ریه عبارت از ارزیابی درجهٔ گسترش سرطان از منشأ اصلی آن میباشد. این یکی از عوامل مؤثر بر پیشبینی روند بیماری و معالجهٔ احتمالی سرطان ریه بهشمار میرود.[1]
برای ارزیابی اولیه مرحلهٔ پیشرفت سرطان ریه سلول-غیرکوچک (NSCLC) از ردهبندی TNM استفاده میشود. این سیستم بر اساس تومور (tumor) اولیه، درگیری غده لنفاوی (lymph node)، و دگردیسی (metastasis) راه دور میباشد. پس از این، با استفاده از توصیفگرهای TNM یک گروه مرحلهٔ پیشرفت بیماری در محدوده بین سرطان پنهان تا مراحل ۰، IA (یک-A), IB, IIA, IIB, IIIA, IIIB و IV (چهار) تخصیص داده میشود. این گروه مرحلهٔ پیشرفت بیماری در انتخاب نوع معالجه و پیشبینی روند بیماری مؤثر است.[51] کارسینوم ریه سلول-کوچک (SCLC) بهطور سنتی به عنوان سرطان دارای «پیشرفت محدود» (محدود شده به نیمی از قفسه سینه و در محدوده یک تکمیدان پرتودرمانی تابآوردنی) یا سرطان دارای «پیشرفت گسترده» (سرطان دارای میزان پیشرفت بیشتر) ردهبندی شدهاست.[1] لیکن سیستم ردهبندی و گروهبندی TNM برای پیشبینی روند بیماری مؤثر است.[51]
هم برای NSCLC و هم برای SCLC، دو نوع کلی ارزیابی مرحلهٔ پیشرفت بیماری عبارت از «ارزیابی بالینی» و «ارزیابی توسط جراحی» میباشند. ارزیابی بالینی مرحلهٔ پیشرفت بیماری پیش از جراحی قطعی صورت میپذیرد. این روش بر مبنای نتایج مطالعات تصویربرداری (نظیر سیتی اسکن و اسکن PET) و نتایج بیوپسی (زندهبینی) میباشد. ارزیابی مرحلهٔ پیشرفت بیماری توسط جراحی چه در حین عمل و چه پس از آن صورت میپذیرد و بر مبنای ترکیب نتایج یافتههای جراحی و بالینی، شامل نمونهبرداری غدد لنفاوی قفسه سینه توسط جراحی، میباشد.[8]
پیشگیری
پیشگیری، مقرونبهصرفهترین روش برای کاهش گسترش سرطان ریه است. با آنکه در اغلب کشورها مواد سرطانزای صنعتی و خانگی مورد شناسایی قرار گرفته و استفاده از آنها منع گردیدهاست، کشیدن تنباکو هنوز بسیار فراگیر است. حذف کشیدن تنباکو یک هدف اصلی در پیشگیری از سرطان ریه میباشد و توقف سیگار کشیدن یک ابزار پیشگیرانه مهم در این فرایند بهشمار میرود.[52]
تعیین مقررات به منظور کاهش آسیبپذیری از سیگار کشیدن دیگران در اماکن عمومی نظیر رستورانها و محلهای کار در بسیاری از کشورهای غربی از رواج بیشتری برخوردار گشتهاست.[53] کشور بوتان از سال ۲۰۰۵ مقررات منع کامل سیگار کشیدن را به اجرا درآورده است[54] در حالی که کشور هند سیگار کشیدن در اماکن عمومی را از ماه اکتبر ۲۰۰۸ منع کردهاست.[55] سازمان بهداشت جهانی از دولتها درخواست کردهاست تبلیغ تنباکو را بهطور کامل منع کنند تا از سیگاری شدن افراد جوان اجتناب گردد. آنها ارزیابی میکنند در جاهایی که چنین منعهایی به اجرا درآمدهاست مصرف تنباکو به میزان ۱۶٪ کاهش پیدا کردهاست.[56]
استفاده بلند مدت از مکمل ویتامین آ،[57][58] ویتامین ث،[57] ویتامین دی[59] یا ویتامین ای[57] احتمال ابتلا به سرطان ریه را کاهش نمیدهد. بعضی مطالعات نشان میدهد خطر ابتلا به این بیماری در افرادی که دارای رژیم غذایی محتوی سبزیجات و میوه جات زیاد میباشند کمتر است،[21][60] اما این امر به احتمال زیاد به دلیل اثر همزمان میباشد. مطالعات دقیق تر دیگر ارتباط واضحی بین این دو به دست نیامده است.[60]
بیماریابی
آزمایشهای غربالگری به استفاده از آزمایش پزشکی به منظور تشخیص بیماری در افرادی که فاقد علائم بیماری هستند اطلاق میشود. آزمایشهایی که ممکن است برای تشخیص سرطان ریه به کار روند شامل آزمایش آسیبشناسی سلول خلط سینه، رادیوگرافی قفسه سینه (CXR) و مقطعنگاری رایانهای (CT) میباشند. برنامههای بیماریابی با استفاده از رادیوگرافی قفسه سینه یا آسیبشناسی سلول مفید واقع نشدند.[61] فرایند بیماریابی در مورد افراد دارای ریسک بالا (به عبارتی افراد بین سنین ۵۵ تا ۷۹ سال که بیش از ۳۰ پاکت-سیگار استفاده میکنند یا افرادی که سابقه سرطان ریه بودهاند) به صورت سالانه با استفاده از سی تی اسکن دوز پایین ممکن است باعث کاهش احتمال مرگ ناشی از سرطان ریه به میزان کاهش ریسک مطلق ۳درصد و کاهش ریسک نسبی ۲۰درصد شود.[62][63] با این وجود، نرخ بالایی از اسکنهای مثبت وجود دارد که ممکن است باعث شود به روشهای تهاجمی و نیز هزینههای مالی قابل توجه نیاز نباشد.[64] به ازای هر اسکن مثبت واقعی بیش از ۱۹ اسکن مثبت اشتباه وجود دارد.[65] قرار گرفتن در معرض تشعشع یکی از آسیبهای احتمالی بیمار یابی است.[66]
درمان
درمان سرطان به نوع سلول، وسعت گسترش آن و وضعیت عملکردی بیمار بستگی دارد. درمانهای رایج شامل مراقبت تسکینی،[67] جراحی، شیمیدرمانی و پرتودرمانی میباشد.[1]
جراحی
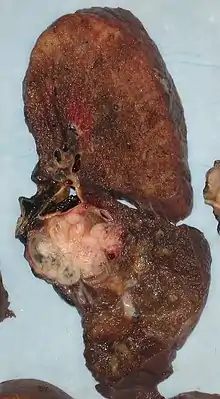
در صورتی که بررسیها سرطان سلولهای غیر کوچک ریه را تأیید کنند، مرحله بندی سرطان مورد ارزیابی قرار میگیرد تا مشخص شود این بیماری به وسیله جراحی قابل درمان است یا پیشروی آن به حدی است که نمیتوان به وسیله جراحی آن را درمان کرد. سی تی اسکن و برشنگاری با گسیل پوزیترون به منظور تعیین این امر مورد استفاده قرار میگیرند.[1] در صورتی وجود غدد لنفاوی مدیاستن از مدیاستینوسکپی به منظور نمونه برداری غدد و کمک به مرحله بندی استفاده میشود.[68] تست خون و آزمونهای عملکرد ریه مورد استفاده قرار میگیرند تا مشخص شود بیمار شرایط تحت عمل جراحی قرار گرفتن دارد یا خیر.[10] جراحی در صورتی صورت نمیگیرد که در آزمون عملکرد ریه مشخص شود بیمار دارای ظرفیت تنفسی پایین است.[1] در اکثر موارد سلولهای غیر کوچک ریه، برداشت ناحیه ریه لوبکتومی بهترین درمان میباشد. در بیمارانی که شرایط این گونه درمان را ندارند جداسازی قسمت کوچکتری از ریه برش گوهای انجام میشود. به هر حال، احتمال بازگشت بیماری در روش برش گوهای نسبت به روش لوبکتومی بیشتر است.[69]ید براکیتراپی رادیواکتیو در کنارههای محل جراحی میتواند احتمال بازگشت بیماری را کاهش دهد.[70] در موارد نادری برداشت تمام ریه نومونکتومی انجام میگیرد. روشهای جراحی از طریق ویدئو توراکوسکوپی و لوبکتومی تراسکوسکوپیک در جراحی سرطان ریه از فرایندی کم خطر تر در جراحی سرطان ریه بهره میبرند.[71] لوبکتومی تراسکوسکوپیک همان کارایی لوبکتومی باز معمول را دارد، ولی مزیت آن کاهش بیماریهای بعد از عمل جراحی است.[72] در سرطان سلول کوچک ریه، بهطور معمول از شیمی درمانی و/یا پرتو درمانی استفاده میشود.[73] با این وجود، نقش جراحی در سرطان سلول کوچک ریه در نظر گرفته میشود. جراحی ممکن است به همراه شیمی درمانی و پرتودرمانی در مراحل اولیه درمان سرطان سلول کوچک ریه بهبود قابل توجهی در وضعیت بیمار ایجاد کند.[74]
لوبکتومی- حذف لوب کامل ریه- روشی پذیرفتهشده برای از بین بردن سرطان ریه است، آنهمزمانی که ریه بهخوبی کار میکند. خطر مرگ بین ۳ تا ۴ درصد است و در بیماران سالمند، این درصد بالاتر است. اگر عملکرد ریه مانع لوبکتومی شود، سرطان کوچکی به منطقهای محدود، محدود میشود که میتوان با برداشتن برخش کوچکی از بافت حاشیه ریه، آن را حذف کرد. به این کار برداشتن سولوبار میگویند همچنین ممکن است به آن برداشت ناقص یا ناکامل نیز بگوید. برداشت سولوبار باعث کم شدن عملکرد ریه میشود. کل ریه لازم باشد که از طریق ریهبرداری حذف شود، میزان مرگومیر مورد انتظار، ۵ تا ۸ درصد میشود. بیماران سالمند درخطر بالاتری هستند.
پرتو درمانی
پرتودرمانی در بیشتر موارد با شیمی درمانی همراه است و ممکن است به قصد درمان در مورد افرادی که دارای سرطان سلولهای غیر کوچک ریه هستند و شرایط جراحی را نداشته باشند به کار رود. این نوع پرتودرمانی را پرتودرمانی رادیکال مینامند.[75] نوع جدید این شیوه پرتودرمانی تسریع شده و بیش تفکیک شده مداوم (CHART) نام دارد که در آن پرتودرمانی زیاد در یک بازه زمانی کوتاه صورت میگیرد.[76] پرتودرمانی سینهای پس از عمل نباید بعد از جراحی سرطان سلولهای غیر کوچک ریه به کار رود.[77] این احتمال وجود دارد که پرتودرمانی بعد از عمل در بعضی از بیمارانی که دارای درگیری غده لنفاوی میان سینهای هستند مفید واقع شود.[78] درکنار شیمی درمانی، پرتودرمانی قفسه سینه در مواردی از که احتمال درمان سرطان ریه با یاختههای کوچک وجود دارد توصیه میشود.[8] اگر رشد سرطان بخش کوچکی از نایژه را مسدود کند، براکیتراپی (پرتودرمانی موضعی) در داخل لوله تنفسی صورت میگیرد تا این راه را باز کند.[79] برایکی تراپی در مقایسه با پرتودرمانی بیرونی باعث کاهش زمان درمان و نیز کاهش در معرض اشعه قرار گرفتن کارکنان مراکز درمانی میشود.[80] پرتودرمانی پیشگیرانه جمجمه (PCI) نوعی از پرتودرمانی مغز است که به منظور کاهش احتمال متاستاز مورد استفاده قرار میگیرد. این شیوه در اکثر موارد سرطان ریه با یاختههای کوچک مفید است. پرتودرمانی پیشگیرانه جمجمه در مواردی که بیماری پیشرفت نکرده احتمال بهبود فرد در طول سه سال را از ۱۵٪ به ۲۰٪ افزایش میدهد؛ در مواردی که بیماری پیشرفت داشته، این احتمال از ۱۳٪ به ۲۷٪ میرسد.[81] پیشرفتهای اخیر در هدف درمانی و عکس برداری منجر به پیشرفت پرتودرمانی استریوتاکتیک در درمان سرطان ریه شدهاست. در این نوع پرتودرمانی، با استفاده از هدف درمانی، پرتو زیادی در جلسههای کوتاه بر روی بیمار صورت میگیرد. استفاده از این روش در مرحله اول برای بیمارانی است که به علت همایندی مرضی شرایط جراحی را ندارند.[82] در بیمارانی که دچار سرطان ریه با یاختههای کوچک یا با یاختههای بزرگتر هستند، انجام میزان کمی پرتو به سینه میتواند برای کنترل نشانه مراقبت تسکینی مورد استفاده قرار گیرد.[83] پس از مدتی سلول های سرطانی، به پرتو مقاوم میشوند.یکی از عوامل مقاوم کردن سلولها به پرتو، بیان بیش از حد آنزیم سیکلواکسیژناز-2 است.سنجش سمیت و آنالیز وسترن بلات نشان داده که تیمار اولیه سلولها با دوزهای غیرکشنده از آسپرین، با حساس کردن سلولهای این نوع سرطان به اشعه ی گاما باعث افزایش چشمگیر آپوپتوز و کاهش بقای سلولها میشود. با استفاده از تکنیک ثبت پیکربندی کروموزوم مشخص شده است که داروی آسپرین از طریق ایجاد اختلال در ساختار لوپ کروماتین آنزیم سیکلواکسیژناز-2 منجر به افزایش حساسیت سلولهای ریه به پرتوی گاما و آپوپتوز میشود. [84]
شیمیدرمانی
چگونگی شیمیدرمانی به نوع تومور بستگی دارد.[8] در سرطان ریه با یاختههای کوچک، سیس پلاتین و اتیپوساید بیشتر مورد استفاده قرار میگیرد. ترکیب کربوپلاتین، جمسیتابین، پاکلیتاکسل، وینورلبین، توپوتکان و ایرینوتکان نیز مورد استفاده قرار میگیرد.[85][86] در سرطان ریه با یاختههای بزرگتر پیشرفته (NSCLC)، شیمی درمانی باعث بهبود بیمار میشود و به عنوان اولین درمان مورد استفاده قرار میگیرد، به این شرط که بیمار شرایط درمان را داشته باشد.[87] بهطور کلی، دو دارو مورد استفاده قرار میگیرد، که یکی از آنها بر پایه پلاتین (یا سیس پلاتین یا کربوپلاتین) میباشد. داروهای معمول دیگر جمسیتابین، پاکلیتاکسل، دوستاکسل،[88][89] پمترکسد،[90]اتیوپوساید یا وینورلبیبن میباشند.[89]
شیمیدرمانی کمکی به استفاده از شیمی درمانی پس از جراحی به ظاهر درمانی برای بهبود نتیجه اشاره دارد. در NSCLC، نمونهها در طول جراحی از غدد لنفاوی اطراف گرفته میشوند تا به مرحله بندی کمک کنند. در صورت تأیید مرحله ۲ یا ۳ بیماری، شیمی درمانی کمکی میتواند پس از پنج سال احتمال زنده ماندن فرد را ۵٪ درصد افزایش بدهد. .[91][92] ترکیب وینورلبین و سیس پلاتین از رژیمهای قدیمی مؤثرتر است.[92] شیمی درمانی کمکی برای افرادی که مبتلا به مرحله IB سرطان هستند بحثبرانگیز است، زیرا آزمایشهای بالینی بهطور واضح نشان ندادهاند که این امر مفید واقع خواهد شد.[93][94] آزمایشهای شیمی درمانی قبل از عمل (شیمی درمانی نئوادجوانتی) NSCLC قابل برداشت بینتیجه بودهاند. .[95]
مراقبتهای تسکیندهنده
ممکن است مراقبت تسکینی یا مدیریت بیمارستانی برای افراد مبتلا به بیماری ترمینال مناسب باشد.[10] این رویکردها فرصتی برای بحث و گفتگوی بیشتر دربارهٔ گزینههای درمان ایجاد میکنند و امکان میدهند تا تصمیمات سنجیده و مناسبی اخذ شود[96][97] و میتوانند از مراقبتهای بیفایده اما پرهزینه در پایان عمر افراد جلوگیری کنند.
در درمان NSCLC ممکن است شیمی درمانی با مراقبتهای تسکین دهنده همراه شود. در موارد پیشرفته، شیمی درمانی مناسب نسبت به استفاده تنها از مراقبتهای حمایتی متوسط بقای افراد را افزایش میدهد و نیز سطح کیفی زندگی را بالا میبرد.[98] در صورت وجود آمادگی جسمانی مناسب، شیمی درمانی مداوم در طول تسکین سرطان ریه ۱٫۵ تا ۳ ماه به عمر فرد میافزاید، سرطان را تسکین میدهد و سطح کیفی زندگی را بالا میبرد و با وجود عوامل مدرن نتایج بهتری بدست آمدهاست. .[99][100] گروه مشارکتی تجزیه و تحلیل متا NSCLC پیشنهاد میدهد که اگر گیرنده میخواهد و میتواند درمان را تحمل کند، شیمی درمانی باید در مرحله پیشرفته NSCLC انجام شود.[87][101]
پیشبینی بیماری
| مرحله بالینی | درصد افرادی که پنج سال زنده ماندهاند | |
|---|---|---|
| سرطان ریه بدون سلول ریز | سرطان ریه سلول ریز | |
| IA | ۵۰ | ۳۸ |
| IB | ۴۷ | ۲۱ |
| IIA | ۳۶ | ۳۸ |
| IIB | ۲۶ | ۱۸ |
| IIIA | ۱۹ | ۱۳ |
| IIIB | ۷ | ۹ |
| IV | ۲ | ۱ |
پیشبینی این بیماری در کل ضعیف است. از بین تمام افراد مبتلا به سرطان ریه، ۱۵٪ به مدت پنج سال بعد از تشخیص بیماری زنده میمانند.[2] معمولاً مرحله بیماری در زمان تشخیص پیشرفتهاست. در زمان ارائه، ۳۰–۴۰٪ از موارد NSCLC در مرحله چهارم، و ۶۰٪ از SCLC در مرحله ششم هستند.[8]
عوامل پیش آگاهی در NSCLC عبارتست از وجود یا عدم وجود علائم ریوی، اندازه نئوپلاسم، بافتشناسی نوع سلول، شدت گسترش (مرحله) و متاستاز تا غدد لنفاوی چندگانه، و تهاجم عروقی. در خصوص افرادی که بیماری آنها جراحی نشدنی است، نتایج برای افرادی با وضعیت عملکرد ضعیف و کاهش وزن بیش از ۱۰٪ وخیم تر است.[102] عوامل پیش آگاهی در سرطان ریه سلول کوچک عبارتست از وضعیت عملکرد، جنسیت، مرحله بیماری، و درگیری دستگاه عصبی مرکزی یا کبد در زمان تشخیص.[103]
در خصوص NSCLC، بهترین پیشبینی بیماری از طریق برداشت کامل جراحی مرحله IA بیماری حاصل میشود، با حداکثر ۷۰٪ احتمال زنده ماندن برای پنج سال.[104] در خصوص SCLC، احتمال کلی زنده ماندن برای مدت پنج سال ۵٪ است.[1] احتمال زنده ماندن افراد مبتلا به SCLC مرحله شدید برای مدت پنج سال کمتر از ۱٪ است. میانگین مدت بقا برای بیماری که در مرحله محدود است ۲۰ ماه برآورد شدهاست و احتمال بقا به مدت پنج سال ۲۰٪ است.[2]
طبق دادههای ارائه شده از سوی انستیتو ملی سرطان ایالات متحده آمریکا، میانگین سنی در تشخیص سرطان ریه در ایالات متحده آمریکا ۷۰ سال است،[105] و میانگین سن فوت ۷۲ سال برآورده شدهاست.[106] در آمریکا، احتمال دارد افرادی که بیمه درمانی دارند به نتیجه بهتری دست یابند.[107]
شیوع
no data
≤ ۵
5-10
10-15
15-20
20-25
25-30
|
30-35
35-40
40-45
45-50
50-55
≥ ۵۵
|
در سراسر دنیا، سرطان ریه شایعترین سرطان از لحاظ شیوع و مرگ و میر بهشمار میرود. در سال ۲۰۰۸، ۱٫۶۱ میلیون مورد جدید، و ۱٫۳۸ میلیون مرگ و میر ناشی از سرطان ریه گزارش شد. بالاترین نرخها در اروپا و آمریکای شمالی است.[11] جمعیتی که احتمال ایجاد سرطان ریه در آنها بیشتر است افراد بالای ۵۰ سال هستند که سابقه کشیدن سیگار دارند. بر خلاف میزان مرگ و میر در مردان، که از بیش از ۲۰ سال پیش در حال کاهش است، نرخ مرگ و میر ناشی از سرطان ریه در زنان در طول دهههای گذشته افزایش یافتهاست، و اخیراً در حال تثبیت است.[109] در آمریکا، خطر مادامالعمر ابتلا به سرطان ریه در مردان ۸٪ و در زنان ۶٪ است.[1]
در ازای هر ۳–۴ میلیون سیگاری که روشن میشود، یک مرگ در اثر سرطان ریه اتفاق میافتد.[1][110] تأثیر صنعت توتون و تنباکو نقش مهمی را در فرهنگ استعمال دخانیات ایفا میکند.[111] افراد جوانی که سیگار نمیکشند، با مشاهده تبلیغات تنباکو بیشتر تشویق میشوند که سیگار بکشند. .[112] استنشاق دود سیگار بهطور روزافزون به عنوان یک عامل خطر ابتلا به سرطان ریه در حال شناخته شدن است[25] و منجر به دخالت سیاستی میشود تا میزان قرار گرفتن ناخواسته در معرض دود سیگار دیگران کاهش یابد.[113] دودی که از خودروها، کارخانجات، و نیروگاهها ساطع میشود نیز دارای خطرات بالقوه هستند.[4]
اروپای شرقی بالاترین آمار مرگ و میر ناشی از سرطان ریه را در بین مردان به خود اختصاص دادهاست، در حالیکه اروپای شمالی و آمریکا بالاترین آمار مرگ و میر را در میان زنان دارد. در آمریکا، مردان و زنان سیاهپوست بیشتر به این بیماری مبتلا میشوند.[114] نرخ سرطان ریه در حال حاضر در کشورهای در حال توسعه کمتر است.[115] با افزایش استعمال دخانیات در کشورهای در حال توسعه، انتظار میرود در چند سال آینده این نرخ به ویژه در چین[116] و هند بالا رود.
از دهه ۶۰، نرخ آدنوکارسینوم ریه نسبت به سایر انواع سرطانهای ریه افزایش یافت. این امر مقداری به معرفی سیگارهای فیلتردار مربوط میشود. استفاده از فیلتر ذرات بزرگتر را از دود تنباکو جدا میکند، بنابراین میزان رسوب در راههای تنفسی بزرگتر را کاهش میدهد. با این حال، فرد سیگاری باید بازدم عمیقتری داشته باشد تا همان میزان نیکوتین به بدن وی وارد شود، در نتیجه میزان رسوب ذرات در راههای تنفسی کوچک افزایش مییابد و در همانجا آدنوکارسینوم ایجاد میشود.[117] ابتلا به آدنوکارسینوم ریه همچنان اتفاق میافتد.[118]
تاریخچه
قبل از پیدایش دود سیگار سرطان ریه یک بیماری نادر بود؛ حتی تا سال ۱۷۶۱ به عنوان یک بیماری مجزا شناخته نشده بود.[119] در سال ۱۸۱۰ توضیحات بیشتری دربارهٔ جنبههای مختلف سرطان ریه ارائه شد.[120] در سال ۱۸۷۸ تومورهای کشنده ریه فقط ۱٪ از تمام سرطانهای مشاهده شده در کالبدشکافی را تشکیل داده بود، اما تا اوایل دهه ۱۹۰۰ این میزان به ۱۰–۱۵٪ رسید.[121] طبق گزارشهای پروندهای در سوابق پزشکی تعداد افراد مبتلا به سرطان ریه در سال ۱۹۱۲ فقط ۳۷۴ تن در سراسر دنیا بودهاست،[122] اما مروری بر کالبدشکافیها نشان داد که سرطان ریه از ۰٫۳٪ در سال ۱۸۵۲ به ۵٫۶۶٪ در سال ۱۹۵۲ رسید.[123] در آلمان، در سال ۱۹۲۹ پزشکی به نام Fritz Lickint رابطه بین سیگار کشیدن و سرطان ریه را کشف کرد،[121] که منجر به یک کمپین ضد سیگار تهاجمی شد.[124] تحقیق پزشکان بریتانیا، منتشر شده در دهه ۱۹۵۰، اولین مدرک معتبر اپیدمیولوژیک دربارهٔ رابطه بین سرطان ریه و سیگار کشیدن بود.[125] در نتیجه، در سال ۱۹۶۴ جراح عمومی ایالات متحده آمریکا به افراد سیگاری توصیه کرد که باید سیگار را ترک کنند.[126]
ارتباط با گاز رادون برای اولین بار در میان معدن چیان در کوههای سنگ معدن در نزدیکی اشنیبرگ، ساکسونی مشخص شد. از سال ۱۴۷۰ از این معدنها نقره استخراج میشد، و این معادن غنی از اورانیوم همراه با رادیوم و گاز رادون بودند.[127] این معدن چیان به بیماری ریوی مبتلا شدند، و در نهایت در دهه ۱۸۷۰ مشخص شد که سرطان ریه دارند.[128] با وجود این اکتشاف، کار در معادن تا دهه ۱۹۵۰ و به دلیل درخواست USSR برای اورانیوم ادامه یافت.[127] در دهه ۱۹۶۰ تأیید شد که رادون یک عامل ابتلا به سرطان ریه است.[129]
اولین پنومونکتومی موفقیتآمیز برای سرطان ریه در سال ۱۹۳۳ انجام شد.[130] پرتونگاری تسکین دهنده از دهه ۱۹۴۰ مورد استفاده قرار گرفت.[131] پرتونگاری رادیکال، که در ابتدا در دهه ۱۹۵۰ از آن استفاده شد، تلاشی بود برای استفاده از دوزهای پرتویی بزرگتر در بیماران مبتلا به سرطان ریهای که کم و بیش در مرحله ابتدایی قرار دارند، اما با این حال برای جراحی مناسب نیستند.[132] در سال ۱۹۹۷، پرتودرمانی هایپر فرکشن پرشتاب و مستمر نسبت به پرتودرمانی رادیکال معمول یک پیشرفت بهشمار میآمد.[133] تلاشهای اولیه در خصوص سرطان ریه سلول کوچک در دهه ۱۹۶۰ دربرداشت جراحی[134] و پرتودرمانی رادیکال[135] ناموفق بود. در دهه ۱۹۷۰، رژیمهای پرتودرمانی موفقیتآمیزی ایجاد شدند.[136]
| در ویکیانبار پروندههایی دربارهٔ سرطان ریه موجود است. |
منابع
- Horn, L (2012). "Chapter 89". In Longo, DL; Kasper, DL; Jameson, JL; Fauci, AS; Hauser, SL; Loscalzo, J. Harrison's Principles of Internal Medicine (18th ed.). McGraw-Hill. ISBN 0-07-174889-X. Unknown parameter
|coauthors=ignored (|author=suggested) (help) - "Lung Carcinoma: Tumors of the Lungs". Merck Manual Professional Edition, Online edition. Retrieved 15 August 2007.
- Thun, MJ (September 2008). "Lung cancer occurrence in never-smokers: an analysis of 13 cohorts and 22 cancer registry studies". PLoS Medicine. 5 (9): e185. doi:10.1371/journal.pmed.0050185. PMC 2531137. PMID 18788891. Unknown parameter
|coauthors=ignored (|author=suggested) (help) - Alberg AJ, Samet JM (2010). "Chapter 46". Murray & Nadel's Textbook of Respiratory Medicine (5th ed.). Saunders Elsevier. ISBN 978-1-4160-4710-0.
- Davies, RJO (2010). "18.19.3". Oxford (5th ed.). OUP Oxford. ISBN 978-0-19-920485-4. Unknown parameter
|coauthors=ignored (|author=suggested) (help) - Carmona, RH (27 June 2006). "The Health Consequences of Involuntary Exposure to Tobacco Smoke: A Report of the Surgeon General". U.S. Department of Health and Human Services. Archived from the original on 3 July 2006. Retrieved 22 April 2014.
Secondhand smoke exposure causes disease and premature death in children and adults who do not smoke.
- "Tobacco Smoke and Involuntary Smoking" (PDF). IARC Monographs on the Evaluation of Carcinogenic Risks to Humans. WHO International Agency for Research on Cancer. 83. 2002.
There is sufficient evidence that involuntary smoking (exposure to secondhand or 'environmental' tobacco smoke) causes lung cancer in humans. ... Involuntary smoking (exposure to secondhand or 'environmental' tobacco smoke) is carcinogenic to humans (Group 1).
- Lu, C (2010). "78: سرطان ریه". پزشکی سرطان هولند-فری (8th ed.). خانه نشر پزشکی مردم. ISBN 978-1-60795-014-1. Unknown parameter
|coauthors=ignored (|author=suggested) (help) - Chapman, S (2009). "Chapter 31". Oxford Handbook of Respiratory Medicine (2nd ed.). Oxford University Press. ISBN 978-0-19-954516-2. Unknown parameter
|coauthors=ignored (|author=suggested) (help) - Collins, LG (January 2007). "Lung cancer: diagnosis and management". American Family Physician. American Academy of Family Physicians. 75 (1): 56–63. PMID 17225705. Unknown parameter
|coauthors=ignored (|author=suggested) (help) - Ferlay, J (December 2010). "Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008". International Journal of Cancer. 127 (12): 2893–2917. doi:10.1002/ijc.25516. PMID 21351269. Unknown parameter
|coauthors=ignored (|author=suggested) (help) - Honnorat, J (May 2007). "Paraneoplastic neurological syndromes". Orphanet Journal of Rare Diseases. BioMed Central. 2 (1): 22. doi:10.1186/1750-1172-2-22. PMC 1868710. PMID 17480225. Unknown parameter
|coauthors=ignored (|author=suggested) (help) - Greene, Frederick L. (2002). AJCC cancer staging manual. Berlin: Springer-Verlag. ISBN 0-387-95271-3.
- Brown, KM (2010). "8". Holland-Frei Cancer Medicine (8th ed.). People's Medical Publishing House USA. ISBN 978-1-60795-014-1. Unknown parameter
|coauthors=ignored (|author=suggested) (help) - Biesalski, HK (1998). "European Consensus Statement on Lung Cancer: risk factors and prevention. Lung Cancer Panel". CA Cancer J Clin. Smoking is the major risk factor, accounting for about 90% of lung cancer incidence. 48 (3): 167–176, discussion 164–166. doi:10.3322/canjclin.48.3.167. PMID 9594919. Unknown parameter
|coauthors=ignored (|author=suggested) (help) - Hecht, S (October 2003). "Tobacco carcinogens, their biomarkers and tobacco-induced cancer". Nature Reviews Cancer. Nature Publishing Group. 3 (10): 733–744. doi:10.1038/nrc1190. PMID 14570033.
- Sopori, M (May 2002). "Effects of cigarette smoke on the immune system". Nature Reviews Immunology. 2 (5): 372–7. doi:10.1038/nri803. PMID 12033743.
- Peto, R (2006). Mortality from smoking in developed countries 1950–2000: Indirect estimates from National Vital Statistics. Oxford University Press. ISBN 0-19-262535-7. Unknown parameter
|coauthors=ignored (|author=suggested) (help) - افزایش چند برابری احتمال ابتلا به سرطان ریه در اثر دخانیات و آلودگی هوا . [خبرگزاری جمهوری اسلامی(ایرنا) http://www.irna.ir]
- California Environmental Protection Agency (1997). "Health effects of exposure to environmental tobacco smoke. California Environmental Protection Agency". Tobacco Control. 6 (4): 346–353. doi:10.1136/tc.6.4.346. PMC 1759599. PMID 9583639.
* CDC (2001). "State-specific prevalence of current cigarette smoking among adults, and policies and attitudes about secondhand smoke—United States, 2000". Morbidity and Mortality Weekly Report. Atlanta, Georgia: CDC. 50 (49): 1101–1106. PMID 11794619. Unknown parameter|month=ignored (help); More than one of|author1=and|last=specified (help) - Alberg, AJ (2007). "Epidemiology of lung cancer". Chest. American College of Chest Physicians. 132 (S3): 29S–55S. doi:10.1378/chest.07-1347. PMID 17873159. Unknown parameter
|month=ignored (help); Unknown parameter|coauthors=ignored (|author=suggested) (help) - Jaakkola, MS (2006). "Impact of smoke-free workplace legislation on exposures and health: possibilities for prevention". European Respiratory Journal. 28 (2): 397–408. doi:10.1183/09031936.06.00001306. PMID 16880370. Unknown parameter
|month=ignored (help); Unknown parameter|coauthors=ignored (|author=suggested) (help) - Parkin, DM (2011). "Tobacco—attributable cancer burden in the UK in 2010". British Journal of Cancer. 105 (Suppl. 2): S6–S13. doi:10.1038/bjc.2011.475. PMC 3252064. PMID 22158323. Unknown parameter
|month=ignored (help) - National Health and Medical Research Council (April 1994). "The health effects and regulation of passive smoking". Australian Government Publishing Service. Archived from the original on 29 September 2007. Retrieved 10 August 2007.
- Taylor, R (2007). "Meta-analysis of studies of passive smoking and lung cancer: effects of study type and continent". International Journal of Epidemiology. 36 (5): 1048–1059. doi:10.1093/ije/dym158. PMID 17690135. Unknown parameter
|month=ignored (help); Unknown parameter|coauthors=ignored (|author=suggested) (help) - "Frequently asked questions about second hand smoke". World Health Organization. Retrieved 25 July 2012.
- Schick, S (December 2005). "Philip Morris toxicological experiments with fresh sidestream smoke: more toxic than mainstream smoke". Tobacco Control. 14 (6): 396–404. doi:10.1136/tc.2005.011288. PMC 1748121. PMID 16319363. Unknown parameter
|coauthors=ignored (|author=suggested) (help) - Schmid K, Kuwert T, Drexler H (2010). "Radon in Indoor Spaces: An Underestimated Risk Factor for Lung Cancer in Environmental Medicine". Dtsch Arztebl Int. 107 (11): 181–6. doi:10.3238/arztebl.2010.0181. PMC 2853156. PMID 20386676. Unknown parameter
|month=ignored (help) - EPA (October 2006). "Radiation information: radon". EPA. Retrieved 11 August 2007.
- Chen, H (2008). "A systematic review of the relation between long-term exposure to ambient air pollution and chronic diseases". Reviews on Environmental Health. 23 (4): 243–297. PMID 19235364. Unknown parameter
|month=ignored (help); Unknown parameter|coauthors=ignored (|author=suggested) (help) - Clapp, RW (2008). "Environmental and Occupational Causes of Cancer New Evidence, 2005–2007". Reviews on Environmental Health. 23 (1): 1–37. PMC 2791455. PMID 18557596. Unknown parameter
|month=ignored (help); Unknown parameter|coauthors=ignored (|author=suggested) (help) - Lim, WY (2012 Jan). "Biomass fuels and lung cancer". Respirology (Carlton, Vic.). 17 (1): 20–31. PMID 22008241. Unknown parameter
|coauthors=ignored (|author=suggested) (help); Check date values in:|date=(help) - Sood, A (2012 Dec). "Indoor fuel exposure and the lung in both developing and developed countries: an update". Clinics in chest medicine. 33 (4): 649–65. PMID 23153607. Check date values in:
|date=(help) - Dudley, Joel (2013). Exploring Personal Genomics. Oxford University Press. p. 25. ISBN 978-0-19-964448-3.
- Kern JA, McLennan G (2008). Fishman's Pulmonary Diseases and Disorders (4th ed.). McGraw-Hill. p. 1802. ISBN 0-07-145739-9.
- Cogliano, VJ (2011 دسامبر 21). "معرضگذاریهای قابل پیشگیری مرتبط با سرطانهای انسانی" (PDF). ژورنال مؤسسه ملی سرطان. 103 (24): 1827–39. PMID 22158127. Archived from the original (PDF) on ۲۰ سپتامبر ۲۰۱۲. Retrieved ۲۲ آوریل ۲۰۱۴. Unknown parameter
|coauthors=ignored (|author=suggested) (help); Check date values in:|date=(help) - افزایش سه برابری خطر ابتلا به سرطان ریه با مصرف داروهای خوابآور . [خبرگزاری جمهوری اسلامی(ایرنا) http://www.irna.ir]
- Fong, KM (October 2003). "Lung cancer • 9: Molecular biology of lung cancer: clinical implications". Thorax. BMJ Publishing Group Ltd. 58 (10): 892–900. doi:10.1136/thorax.58.10.892. PMC 1746489. PMID 14514947. Unknown parameter
|coauthors=ignored (|author=suggested) (help) - Salgia, R (March 1998). "Molecular abnormalities in lung cancer". Journal of Clinical Oncology. 16 (3): 1207–1217. PMID 9508209. Unknown parameter
|coauthors=ignored (|author=suggested) (help) - Herbst, RS (September 2008). "Lung cancer". New England Journal of Medicine. 359 (13): 1367–1380. doi:10.1056/NEJMra0802714. PMID 18815398. Unknown parameter
|coauthors=ignored (|author=suggested) (help) - Aviel-Ronen, S (July 2006). "K-ras mutations in non-small-cell lung carcinoma: a review". Clinical Lung Cancer. Cancer Information Group. 8 (1): 30–38. doi:10.3816/CLC.2006.n.030. PMID 16870043. Unknown parameter
|coauthors=ignored (|author=suggested) (help) - Devereux, TR (March 1996). "Molecular mechanisms of lung cancer. Interaction of environmental and genetic factors". Chest. American College of Chest Physicians. 109 (Suppl 3): 14S–19S. doi:10.1378/chest.109.3_Supplement.14S. PMID 8598134. Unknown parameter
|coauthors=ignored (|author=suggested) (help) - Miller, WT (2008). بیماریها و اختلالات ریوی فیشمن (4th ed.). McGraw-Hill. p. 486. ISBN 0-07-145739-9.
- Kaiser, LR (2008). بیماریها و اختلالات ریوی فیشمن (4th ed.). McGraw-Hill. pp. 1815–1816. ISBN 0-07-145739-9.
- Maitra, A (2007). پاتولوژی پایه رابینز (8th ed.). Saunders Elsevier. pp. 528–529. ISBN 978-1-4160-2973-1. Unknown parameter
|coauthors=ignored (|author=suggested) (help) - Subramanian, J (2007). "سرطان ریه در غیرسیگاریها: یک بررسی". ژورنال انکولوژی بالینی. انجمن انکولوژی بالینی آمریکا. 25 (5): 561–570. doi:10.1200/JCO.2006.06.8015. PMID 17290066. Unknown parameter
|month=ignored (help); Unknown parameter|coauthors=ignored (|author=suggested) (help) - Raz, DJ (March 2006). "Bronchioloalveolar carcinoma: a review". Clinical Lung Cancer. 7 (5): 313–322. doi:10.3816/CLC.2006.n.012. PMID 16640802. Unknown parameter
|coauthors=ignored (|author=suggested) (help) - Rosti, G (March 2006). "Small cell lung cancer". Annals of Oncology. 17 (Suppl. 2): 5–10. doi:10.1093/annonc/mdj910. PMID 16608983. Unknown parameter
|coauthors=ignored (|author=suggested) (help) - Seo, JB (1 March 2001). "Atypical pulmonary metastases: spectrum of radiologic findings". Radiographics. 21 (2): 403–417. PMID 11259704. Unknown parameter
|coauthors=ignored (|author=suggested) (help) - Tan D, Zander DS (2008). "«شیمی ایمنی بافتی و سلولی» برای ارزیابی نئوپلاسمهای ریوی و پرده جنبی: یک بررسی و به روز رسانی". Int J Clin Exp Pathol. 1 (1): 19–31. PMC 2480532. PMID 18784820.
- Rami-Porta, R (2009). "سیستم ارزیابی مرحلهٔ پیشرفت TNM بازبینی شده برای سرطان ریه" (PDF). سالنامه جراحی قفسه سینه و جراحی قلبی عروقی. 15 (1): 4–9. PMID 19262443. Unknown parameter
|month=ignored (help); Unknown parameter|coauthors=ignored (|author=suggested) (help) - Goodman, GE (2002). "Lung cancer. 1: پیشگیری از سرطان ریه" (PDF). Thorax. 57 (11): 994–999. PMC 1746232. PMID 12403886. Unknown parameter
|month=ignored (help) - McNabola, A (2009). "کنترل دود تنباکوی محیطی: یک بررسی مقرراتی". ژورنال بینالمللی تحقیقات محیطی و بهداشت عمومی. 6 (2): 741–758. doi:10.3390/ijerph6020741. PMC 2672352. PMID 19440413. Unknown parameter
|month=ignored (help); Unknown parameter|coauthors=ignored (|author=suggested) (help) - Pandey, G (February 2005). "Bhutan's smokers face public ban". BBC. Retrieved 7 September 2007.
- Pandey, G (2 October 2008). "منع سیگار کشیدن در اماکن عمومی در هند". BBC. Retrieved 2012-04-25.
- "آژانس بهداشت سازمان ملل فراخوان منع کامل تبلیغ تنباکو به منظور محافظت از افراد جوان را صادر مینماید" (Press release). سرویس خبری سازمان ملل. 30 May 2008.
- Fabricius, P (2003). "Diet and lung cancer". Monaldi Archives for Chest Disease. 59 (3): 207–211. PMID 15065316. Unknown parameter
|month=ignored (help); Unknown parameter|coauthors=ignored (|author=suggested) (help) - Fritz, H (2011). "Vitamin A and Retinoid Derivatives for Lung Cancer: A Systematic Review and Meta Analysis". PLoS ONE. 6 (6): e21107. doi:10.1371/journal.pone.0021107. PMC 3124481. PMID 21738614. Unknown parameter
|coauthors=ignored (|author=suggested) (help) - Herr, C (2011). "The role of vitamin D in pulmonary disease: COPD, asthma, infection, and cancer". Respiratory Research. 12 (1): 31. doi:10.1186/1465-9921-12-31. PMC 3071319. PMID 21418564. Unknown parameter
|month=ignored (help); Unknown parameter|coauthors=ignored (|author=suggested) (help) - Key, TJ (2011). "Fruit and vegetables and cancer risk". British Journal of Cancer. 104 (1): 6–11. doi:10.1038/sj.bjc.6606032. PMC 3039795. PMID 21119663. Unknown parameter
|month=ignored (help) - Manser, RL (2004). "Screening for lung cancer". Cochrane Database of Systematic Reviews (1): CD001991. doi:10.1002/14651858.CD001991.pub2. PMID 14973979. Unknown parameter
|coauthors=ignored (|author=suggested) (help) - Jaklitsch, MT (2012). "The American Association for Thoracic Surgery guidelines for lung cancer screening using low-dose computed tomography scans for lung cancer survivors and other high-risk groups". Journal of Thoracic and Cardiovascular Surgery. 144 (1): 33&ndash, 38. doi:10.1016/j.jtcvs.2012.05.060. PMID 22710039. Unknown parameter
|month=ignored (help); Unknown parameter|coauthors=ignored (|author=suggested) (help) - Bach, PB (2012). "Benefits and harms of CT screening for lung cancer: a systematic review". JAMA: the Journal of the American Medical Association. 307 (22): 2418–2429. doi:10.1001/jama.2012.5521. PMID 22610500. Unknown parameter
|month=ignored (help); Unknown parameter|coauthors=ignored (|author=suggested) (help) - Boiselle, PM (2013 Mar 20). "Computed tomography screening for lung cancer". JAMA: the journal of the American Medical Association. 309 (11): 1163–70. PMID 23512063. Check date values in:
|date=(help) - Bach PB, Mirkin JN, Oliver TK, et al. (2012). "Benefits and harms of CT screening for lung cancer: a systematic review". JAMA. 307 (22): 2418–29. doi:10.1001/jama.2012.5521. PMID 22610500. Unknown parameter
|month=ignored (help) - Aberle, DR (2013 Mar 10). "Computed tomography screening for lung cancer: has it finally arrived? Implications of the national lung screening trial". Journal of clinical oncology: official journal of the American Society of Clinical Oncology. 31 (8): 1002–8. PMID 23401434. Unknown parameter
|coauthors=ignored (|author=suggested) (help); Check date values in:|date=(help) - Ferrell, B (2011). "Palliative care in lung cancer". Surgical Clinics of North America. 91 (2): 403–417. doi:10.1016/j.suc.2010.12.003. PMID 21419260. Unknown parameter
|month=ignored (help); Unknown parameter|coauthors=ignored (|author=suggested) (help) - Kaiser LR (2008). Fishman's Pulmonary Diseases and Disorders (4th ed.). McGraw-Hill. pp. 1853–1854. ISBN 0-07-145739-9.
- Kaiser LR (2008). Fishman's Pulmonary Diseases and Disorders (4th ed.). McGraw-Hill. pp. 1855–1856. ISBN 0-07-145739-9.
- Odell, DD (2010). "Sublobar resection with brachytherapy mesh for stage I non-small cell lung cancer". Seminars in Thoracic and Cardiovascular Surgery. 22 (1): 32–37. doi:10.1053/j.semtcvs.2010.04.003. PMID 20813314. Unknown parameter
|month=ignored (help); Unknown parameter|coauthors=ignored (|author=suggested) (help) - Alam, N (2007). "Video-assisted thoracic surgery (VATS) lobectomy: the evidence base". Journal of the Society of Laparoendoscopic Surgeons. 11 (3): 368–374. PMC 3015831. PMID 17931521. Unknown parameter
|month=ignored (help); Unknown parameter|coauthors=ignored (|author=suggested) (help) - Rueth, NM (2010). "Is VATS lobectomy better: perioperatively, biologically and oncologically?". Annals of Thoracic Surgery. 89 (6): S2107–S2111. doi:10.1016/j.athoracsur.2010.03.020. PMID 20493991. Unknown parameter
|month=ignored (help); Unknown parameter|coauthors=ignored (|author=suggested) (help) - Simon GR, Turrisi A (2007). "Management of small cell lung cancer: ACCP evidence-based clinical practice guidelines (2nd edition)". Chest. 132 (3 Suppl): 324S–339S. doi:10.1378/chest.07-1385. PMID 17873178. Unknown parameter
|month=ignored (help) - Goldstein, SD (2011). "Role of surgery in small cell lung cancer". Surgical Oncology Clinics of North America. 20 (4): 769–777. doi:10.1016/j.soc.2011.08.001. PMID 21986271. Unknown parameter
|month=ignored (help); Unknown parameter|coauthors=ignored (|author=suggested) (help) - Arriagada, R (2002). Oxford Textbook of Oncology (2nd ed.). Oxford University Press. p. 2094. ISBN 0-19-262926-3. Unknown parameter
|coauthors=ignored (|author=suggested) (help) - Hatton, MQ (2010). "Continuous hyperfractionated accelerated radiotherapy (CHART) and non-conventionally fractionated radiotherapy in the treatment of non-small cell lung cancer: a review and consideration of future directions". Clinical Oncology (Royal College of Radiologists). 22 (5): 356–364. doi:10.1016/j.clon.2010.03.010. PMID 20399629. Unknown parameter
|month=ignored (help); Unknown parameter|coauthors=ignored (|author=suggested) (help) - PORT Meta-analysis Trialists Group (2005). Rydzewska, Larysa, ed. "Postoperative radiotherapy for non-small cell lung cancer". Cochrane Database of Systematic Reviews (2): CD002142. doi:10.1002/14651858.CD002142.pub2. PMID 15846628.
- Le Péchoux, C (2011). "Role of postoperative radiotherapy in resected non-small cell lung cancer: a reassessment based on new data". Oncologist. 16 (5): 672–681. doi:10.1634/theoncologist.2010-0150. PMC 3228187. PMID 21378080.
- Cardona, AF (2008). "Palliative endobronchial brachytherapy for non-small cell lung cancer". Cochrane Database of Systematic Reviews (2): CD004284. doi:10.1002/14651858.CD004284.pub2. PMID 18425900. Unknown parameter
|coauthors=ignored (|author=suggested) (help); Unknown parameter|month=ignored (help) - Ikushima, H (2010). "Radiation therapy: state of the art and the future". Journal of Medical Investigation. 57 (1–2): 1–11. PMID 20299738. Unknown parameter
|month=ignored (help) - Paumier, A (2011). "Prophylactic cranial irradiation in lung cancer". Cancer Treatment Reviews. 37 (4): 261–265. doi:10.1016/j.ctrv.2010.08.009. PMID 20934256. Unknown parameter
|month=ignored (help); Unknown parameter|coauthors=ignored (|author=suggested) (help) - Girard, N (2011). "Stereotactic radiotherapy for non-small cell lung cancer: From concept to clinical reality. 2011 update". Cancer Radiothérapie. 15 (6–7): 522–526. doi:10.1016/j.canrad.2011.07.241. PMID 21889901. Unknown parameter
|month=ignored (help); Unknown parameter|coauthors=ignored (|author=suggested) (help) - Fairchild, A (2008). "Palliative thoracic radiotherapy for lung cancer: a systematic review". Journal of Clinical Oncology. 26 (24): 4001–4011. doi:10.1200/JCO.2007.15.3312. PMID 18711191. Unknown parameter
|month=ignored (help); Unknown parameter|coauthors=ignored (|author=suggested) (help) - [�www.ncbi.nlm.nih.gov/pmc/articles/PMC6171098/ "Disruption of chromosomal architecture of cox2 locus sensitizes lung cancer cell to radiotherapy"] Check
|url=value (help). Molecular therapy. 26 (10): 2456–2465. 2018. doi:10.1016/j.ymthe.2018.08.002. PMID 30131302. Unknown parameter|month=ignored (help); Unknown parameter|coauthors=ignored (|author=suggested) (help); replacement character in|url=at position 1 (help) - Azim, HA (March 2007). "Treatment options for relapsed small-cell lung cancer". Anticancer drugs. 18 (3): 255–261. doi:10.1097/CAD.0b013e328011a547. PMID 17264756. Unknown parameter
|coauthors=ignored (|author=suggested) (help) - MacCallum, C (July 2006). "Second-line treatment of small-cell lung cancer". Current Oncology Reports. 8 (4): 258–264. doi:10.1007/s11912-006-0030-8. PMID 17254525. Unknown parameter
|coauthors=ignored (|author=suggested) (help) - NSCLC Meta-Analyses Collaborative Group (2008). "Chemotherapy in Addition to Supportive Care Improves Survival in Advanced Non–Small-Cell Lung Cancer: A Systematic Review and Meta-Analysis of Individual Patient Data From 16 Randomized Controlled Trials". J. Clin. Oncol. 26 (28): 4617–25. doi:10.1200/JCO.2008.17.7162. PMC 2653127. PMID 18678835. Unknown parameter
|month=ignored (help) - Mehra R, Treat J (2008). Fishman's Pulmonary Diseases and Disorders (4th ed.). McGraw-Hill. p. 1876. ISBN 0-07-145739-9.
- Clegg, A (January 2002). "Clinical and cost effectiveness of paclitaxel, docetaxel, gemcitabine, and vinorelbine in non-small cell lung cancer: a systematic review". Thorax. BMJ Publishing Group. 57 (1): 20–28. doi:10.1136/thorax.57.1.20. PMC 1746188. PMID 11809985. Unknown parameter
|coauthors=ignored (|author=suggested) (help) - Fuld AD, Dragnev KH, Rigas JR (2010). "Pemetrexed in advanced non-small-cell lung cancer". Expert Opin Pharmacother. 11 (8): 1387–402. doi:10.1517/14656566.2010.482560. PMID 20446853. Unknown parameter
|month=ignored (help) - Carbone, DP (2011). "Adjuvant therapy in non-small cell lung cancer: future treatment prospects and paradigms". Clinical Lung Cancer. 12 (5): 261–271. doi:10.1016/j.cllc.2011.06.002. PMID 21831720. Unknown parameter
|month=ignored (help); Unknown parameter|coauthors=ignored (|author=suggested) (help) - Le Chevalier, T (2010). "Adjuvant chemotherapy for resectable non-small-cell lung cancer: where is it going?". Annals of Oncology. 21 (Suppl. 7): vii196–198. doi:10.1093/annonc/mdq376. PMID 20943614. Unknown parameter
|month=ignored (help) - Horn, L (May 2007). "The rationale for adjuvant chemotherapy in stage I non-small cell lung cancer". Journal of Thoracic Oncology. 2 (5): 377–383. doi:10.1097/01.JTO.0000268669.64625.bb. PMID 17473651. Unknown parameter
|coauthors=ignored (|author=suggested) (help) - Wakelee, HA (July 2006). "Current status of adjuvant chemotherapy for stage IB non-small-cell lung cancer: implications for the New Intergroup Trial". Clinical Lung Cancer. Cancer Information Group. 8 (1): 18–21. doi:10.3816/CLC.2006.n.028. PMID 16870041. Unknown parameter
|coauthors=ignored (|author=suggested) (help) - BMJ (December 2005). Clinical evidence concise: the international resource of the best available evidence for effective health care. London: BMJ Publishing Group. pp. 486–488. ISBN 1-905545-00-2. ISSN 1475-9225.
- Kelley AS, Meier DE (2010). "Palliative care—a shifting paradigm". New England Journal of Medicine. 363 (8): 781–2. doi:10.1056/NEJMe1004139. PMID 20818881. Unknown parameter
|month=ignored (help) - Prince-Paul M (2009). "When hospice is the best option: an opportunity to redefine goals". Oncology (Williston Park, N.Y.). 23 (4 Suppl Nurse Ed): 13–7. PMID 19856592. Unknown parameter
|month=ignored (help) - Souquet PJ, Chauvin F, Boissel JP, Bernard JP (1995). "Meta-analysis of randomised trials of systemic chemotherapy versus supportive treatment in non-resectable non-small cell lung cancer". Lung Cancer. 12 Suppl 1: S147–54. doi:10.1016/0169-5002(95)00430-9. PMID 7551923. Unknown parameter
|month=ignored (help) - Sörenson S, Glimelius B, Nygren P (2001). "A systematic overview of chemotherapy effects in non-small cell lung cancer". Acta Oncol. 40 (2–3): 327–39. PMID 11441939.
- Clegg A, Scott DA, Sidhu M, Hewitson P, Waugh N (2001). "A rapid and systematic review of the clinical effectiveness and cost-effectiveness of paclitaxel, docetaxel, gemcitabine and vinorelbine in non-small-cell lung cancer". Health Technol Assess. 5 (32): 1–195. PMID 12065068.
- Non-Small Cell Lung Cancer Collaborative Group (2010). "Chemotherapy and supportive care versus supportive care alone for advanced non-small cell lung cancer". Cochrane Database of Systematic Reviews (5): CD007309 (2nd rev.). DOI:10.1002/14651858.CD007309.pub2. PMID 20464750.
- "Non-Small Cell Lung Cancer Treatment". PDQ for Health Professionals. National Cancer Institute. Retrieved 2008-11-22.
- "Small Cell Lung Cancer Treatment". PDQ for Health Professionals. National Cancer Institute. 2012. Retrieved 16 May 2012.
- Spiro, SG (2010). "18.19.1". Oxford Textbook Medicine (5th ed.). OUP Oxford. ISBN 978-0-19-920485-4.
- SEER data (SEER.cancer.gov)Median Age of Cancer Patients at Diagnosis 2002-2003
- SEER data (SEER.cancer.gov)Median Age of Cancer Patients at Death 2002-2006
- Slatore, CG (November 2010). "An official American Thoracic Society systematic review: insurance status and disparities in lung cancer practices and outcomes". American Journal of Respiratory and Critical Care Medicine. 182 (9): 1195–1205. doi:10.1164/rccm.2009-038ST. PMID 21041563. Unknown parameter
|coauthors=ignored (|author=suggested) (help) - "WHO Disease and injury country estimates". World Health Organization. 2009. Retrieved 11 November 2009.
- Jemal A, Tiwari RC, Murray T; et al. (2004). "Cancer statistics, 2004". CA: a Cancer Journal for Clinicians. 54 (1): 8–29. doi:10.3322/canjclin.54.1.8. PMID 14974761.
- Proctor, RN (2012). "The history of the discovery of the cigarette-lung cancer link: evidentiary traditions, corporate denial, global toll". Tobacco Control. 21 (2): 87–91. doi:10.1136/tobaccocontrol-2011-050338. PMID 22345227. Unknown parameter
|month=ignored (help) - Lum, KL (October 2008). "Signed, sealed and delivered: "big tobacco" in Hollywood, 1927–1951". Tobacco Control. 17 (5): 313–323. doi:10.1136/tc.2008.025445. PMC 2602591. PMID 18818225. Unknown parameter
|coauthors=ignored (|author=suggested) (help) - Lovato, C (October 2011). "Impact of tobacco advertising and promotion on increasing adolescent smoking behaviours". Cochrane Database of Systematic Reviews (10): CD003439. doi:10.1002/14651858.CD003439.pub2. PMID 21975739. Unknown parameter
|coauthors=ignored (|author=suggested) (help) - Kemp, FB (2009). "Smoke free policies in Europe. An overview". Pneumologia. 58 (3): 155–158. PMID 19817310. Unknown parameter
|month=ignored (help) - National Cancer Institute; SEER stat fact sheets: Lung and Bronchus. Surveillance Epidemiology and End Results. 2010
- "Gender in lung cancer and smoking research" (PDF). World Health Organization. 2004. Retrieved 26 May 2007.
- Zhang, J (November 2011). "Tobacco smoking in China: prevalence, disease burden, challenges and future strategies". Respirology. 16 (8): 1165–1172. doi:10.1111/j.1440-1843.2011.02062.x. PMID 21910781. Unknown parameter
|coauthors=ignored (|author=suggested) (help) - Charloux, A (February 1997). "The increasing incidence of lung adenocarcinoma: reality or artefact? A review of the epidemiology of lung adenocarcinoma". International Journal of Epidemiology. 26 (1): 14–23. doi:10.1093/ije/26.1.14. PMID 9126499. Unknown parameter
|coauthors=ignored (|author=suggested) (help) - Kadara, H (2012). "Pulmonary adenocarcinoma: a renewed entity in 2011". Respirology. 17 (1): 50–65. doi:10.1111/j.1440-1843.2011.02095.x. PMID 22040022. Unknown parameter
|month=ignored (help); Unknown parameter|coauthors=ignored (|author=suggested) (help) - Morgagni, Giovanni Battista (1761). De sedibus et causis morborum per anatomen indagatis. OL 24830495M.
- Bayle, Gaspard-Laurent (1810). Recherches sur la phthisie pulmonaire (به French). Paris. OL 15355651W.
- Witschi, H (November 2001). "A short history of lung cancer". Toxicological Sciences. 64 (1): 4–6. doi:10.1093/toxsci/64.1.4. PMID 11606795.
- Adler, I (1912). Primary Malignant Growths of the Lungs and Bronchi. New York: Longmans, Green, and Company. OCLC 14783544. OL 24396062M., cited in Spiro SG, Silvestri GA (2005). "One hundred years of lung cancer". American Journal of Respiratory and Critical Care Medicine. 172 (5): 523–529. doi:10.1164/rccm.200504-531OE. PMID 15961694.
- Grannis, FW. "History of cigarette smoking and lung cancer". smokinglungs.com. Archived from the original on 18 July 2007. Retrieved 6 August 2007.
- Proctor, R (2000). The Nazi War on Cancer. Princeton University Press. pp. 173–246. ISBN 0-691-00196-0.
- Doll, R (November 1956). "Lung Cancer and Other Causes of Death in Relation to Smoking". British Medical Journal. 2 (5001): 1071–1081. doi:10.1136/bmj.2.5001.1071. PMC 2035864. PMID 13364389. Unknown parameter
|coauthors=ignored (|author=suggested) (help) - US Department of Health Education and Welfare (1964). "Smoking and health: report of the advisory committee to the Surgeon General of the Public Health Service" (PDF). Washington, DC: US Government Printing Office.
- Greaves, M (2000). Cancer: the Evolutionary Legacy. Oxford University Press. pp. 196–197. ISBN 0-19-262835-6.
- Greenberg, M (1993). "Lung cancer in the Schneeberg mines: a reappraisal of the data reported by Harting and Hesse in 1879". Annals of Occupational Hygiene. 37 (1): 5–14. PMID 8460878. Unknown parameter
|month=ignored (help); Unknown parameter|coauthors=ignored (|author=suggested) (help) - Samet, JM (2011). "Radiation and cancer risk: a continuing challenge for epidemiologists". Environmental Health. 10 (Suppl. 1): S4. doi:10.1186/1476-069X-10-S1-S4. PMC 3073196. PMID 21489214. Unknown parameter
|month=ignored (help) - Horn, L (July 2008). "Evarts A. Graham and the first pneumonectomy for lung cancer". Journal of Clinical Oncology. 26 (19): 3268–3275. doi:10.1200/JCO.2008.16.8260. PMID 18591561. Unknown parameter
|coauthors=ignored (|author=suggested) (help) - Edwards, AT (1946). "Carcinoma of the Bronchus". Thorax. 1 (1): 1–25. doi:10.1136/thx.1.1.1. PMC 1018207. PMID 20986395.
- Kabela, M (1956). "Erfahrungen mit der radikalen Röntgenbestrahlung des Bronchienkrebses". Ceskoslovenská Onkológia (به German). 3 (2): 109–115. PMID 13383622. Unknown parameter
|trans_title=ignored (help) - Saunders, M (July 1997). "Continuous hyperfractionated accelerated radiotherapy (CHART) versus conventional radiotherapy in non-small-cell lung cancer: a randomised multicentre trial". Lancet. Elsevier. 350 (9072): 161–165. doi:10.1016/S0140-6736(97)06305-8. PMID 9250182. Unknown parameter
|coauthors=ignored (|author=suggested) (help) - Lennox, SC (November 1968). "Results of resection for oat-cell carcinoma of the lung". Lancet. Elsevier. 2 (7575): 925–927. doi:10.1016/S0140-6736(68)91163-X. PMID 4176258. Unknown parameter
|coauthors=ignored (|author=suggested) (help) - Miller, AB (September 1969). "Five-year follow-up of the Medical Research Council comparative trial of surgery and radiotherapy for the primary treatment of small-celled or oat-celled carcinoma of the bronchus". Lancet. Elsevier. 2 (7619): 501–505. doi:10.1016/S0140-6736(69)90212-8. PMID 4184834. Unknown parameter
|coauthors=ignored (|author=suggested) (help) - Cohen, M (1977). "Intensive chemotherapy of small cell bronchogenic carcinoma". Cancer Treatment Reports. 61 (3): 349–354. PMID 194691. Unknown parameter
|coauthors=ignored (|author=suggested) (help) - Murray, N (March 2006). "A review of first-line treatment for small-cell lung cancer". Journal of Thoracic Oncology. 1 (3): 270–278. PMID 17409868. Unknown parameter
|coauthors=ignored (|author=suggested) (help) - Behera, D (2004). "Lung cancer in India" (PDF). Indian Journal of Chest Diseases and Allied Sciences. 46 (4): 269–281. PMID 15515828. Unknown parameter
|coauthors=ignored (|author=suggested) (help)
