طیفسنجی جرمی
طیفسنجی جرمی (به انگلیسی: Mass Spectrometry، MS) spectrometry تشکیل شده از spectro به معنی طیف و metry به معنی متر کنندگی ، یکی از روشهای طیفسنجی است که شامل جداسازی یونهای یک یا چند اتمی بر پایهٔ تابعی از نسبت جرم به بار (m/z) است و اندازهگیری m/z و فراوانی یونها در فاز گازی ، از آنجا حرکت مولکول ها ی یونیزه در میدان های الکترومغناطیسی تابعی از m/z است و با استفاده از تحلیل پیک های موجود در گراف خروجی دستگاه می توان اطلاعات خوبی از مولکول بدست آورد، بسیار در شیمی پر کاربرد است.[1] به عبارت دقیقتر طیفسنجی جرمی به بررسی نسبت جرم به بار مولکولها با استفاده از میدانهای الکتریکی و مغناطیسی میپردازد
منابع یونش
عمده روشهای مورد استفاده در طیفسنجی جرمی برپایهٔ یونیزاسیون عبارتند از:
- یونش الکترونی (EI):
- یونش شیمیایی (CI):
- یونش الکتروافشانه (ESI):
- یونش شیمیایی تحت فشار اتمسفری (APCI):
- واجذب-یونش لیزری به کمک ماتریس (MALDI):
در این روش نمونه به نسبت خاصی در بافت (ماتریکس) رقیق میشود. به بافت حلال هم افزوده میشود. خاصیت بافت جذب قوی نور لیزر در منطقه فرابنفش یا فروسرخ است. تابش لیزر در طول موجهای خاصی به حلال حاوری نمونه و بافت تابیده میشود و در نهایت یونها در بالای سطح حلال تشکیل میشوند و با اعمال ولتاژ وارد دستگاه طیفسنج زمان پرواز میشوند.
- بمباران سریع اتمی (FAB):
- Field ionization (FI):
- Field desorption (FD):
- Plasma desorption (PD):
تجزیهگر جرمی

- تجزیهگر چهارقطبی:
- تجزیهگر جرمی قطاع مغناطیسی:
- تجزیهگر جرمی تله یونی:
- تجزیهگر جرمی زمان پرواز:
- تجزیهگر جرمی تبدیل فوریه:
- تجزیهگر جرمی اوربیترپ:
آشکارساز
- تکثیرگر الکترون: اجزاء ورودی به یک سطح فلزی برخورد میکنند. میان این سطح فلزی و سطح فلزی دیگر (دیانود) پتانسیل اعمال شدهاست بگونهای که تابع کار آن فلز تأمین گردد و با برخورد جز باردار پر انرژی تعدادی الکترون به سمت دیانود دیگر نشر گردد. دیانود سوم نسبت به دایانود دوم پتانسیل مثبت تری دارد و با برخورد این الکترونها، تعداد بیشتری الکترون نشر میگردد. این فرایند ادامه مییابد. یک چندگانه گر الکترون، دارای چندین دایانود است بگونهای که از یک ذره باردار ۱۰^۷ الکترون تولید میشود. جریان حاصل توسط آمپلی فایر تقویت میشود.
- فنجان فارادی: فنجان فارادی (Faraday Cup) نیز مشابه تکثیر کننده الکترونی است که از یک فلز منحنی شکل از جنس اکسید برلیم (BeO) یا گالیم فسفید (GaP) تشکیل شدهاست که با برخورد یون الکترون تولید میشود. سادگی مقاومت و کارکردن در هر فشاری از مزیتهای این آشکارساز است. این آشکارساز به دلیل حساسیت کمی که دارد استفاده محدودی دارد.
- صفحه چند کاناله:
- جریان تصویری:
- یون به فوتون:
روشها
طیفسنجی جرمی متوالی (Tandem MS)
طیفسنجی جرمی یون ثانویه (SIMS)

یک تکنیک مورد استفاده در بررسی مواد حالت جامد میباشد. SIMS تکنیک تجزیه و تحلیل ترکیب سطوح جامد و لایههای نازک، توسط کندوپاش سطح نمونه با پرتو یون متمرکز اولیه و جمعآوری و تجزیه و تحلیل یونهای خارج ثانویهاست. این یون ثانویه همراه با طیفسنج جرمی اندازهگیری میشود و برای تعیین ترکیب عنصری، ایزوتوپی یا مولکولی سطح کاربرد دارد. سیمس حساسترین تکنیک تجزیه و تحلیل سطح است که قادر به تشخیص عناصر موجود در محدوده یک در میلیارد میباشد.
کروماتوگرافی مایع-طیفسنج جرمی (LC-MS)
کروماتوگرافی گازی-طیفسنج جرمی (GC-MS)
طیفسنجی جرمی پلاسمای جفتشده القایی (ICP-MS)

نوعی طیفسنجی جرمی است که برای ارزیابی و شناسایی فلزها و برخی نافلزها تا غلظتهایی به اندکی بخش در ۱۰۱۵ کارایی دارد. این تکنیک در مقایسه با طیفبینی جذب اتمی، دارای دقت، حساسیت و سرعت بیشتری است.
طیفسنجی جرمی شتابنده (AMS)
طرز کار
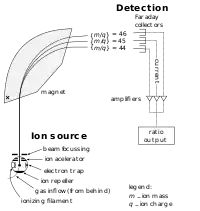
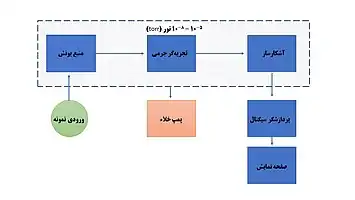
اجزای اصلی طیفسنج جرمی شامل ورودی نمونه، منبع یون، سیستم اندازهگیری و آشکارساز یونی تحت خلاء است.
نمونههای فرار را میتوان مستقیماً وارد جانمونه کرد اما نمونههایی که فراریت کمتری دارند، بایستی وارد اتاقک یونیزاسیون شوند. یونیزاسیون برخورد الکترونی توسط الکترونهای با انرژی بالا در حدود 70eV انجام میشود. کاتیونهای حاصل توسط پتانسیلی در حدود keV 4-8 شتاب گرفته و از میدان مغناطیسی قدرتمندی با زاویهٔ ۹۰ درجه نسبت به پرتو عبور میکنند. یونها بر اساس نسبت جرم/بارشان از مسیر خود منحرف شده و بر روی یک آشکارساز متمرکز میشوند.[2]
به بیان ساده، طیفسنج جرمی سه عمل اساسی را انجام میدهد:
- مولکولها توسط جرایاناتی از الکترونهای پرانرژی بمباران شده و بعضی از مولکولها به یونهای مربوطه تبدیل میگردند. سپس یونها در یک میدان الکتریکی شتاب داده میشوند.
- یونهای شتاب داده شده بسته به نسبت بار/جرم آنها در یک میدان مغناطیسی یا الکتریکی جدا میگردند.
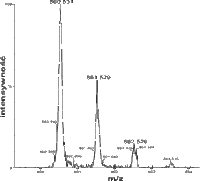
- یونهای دارای نسبت بار/جرم مشخص و معین توسط بخشی از دستگاه که در اثر برخورد یونها به آن، قادر به شمارش آنها است، آشکار میگردند. نتایج داده شده خروجی توسط آشکارکننده بزرگ شده و به ثبات داده میشوند. علامت یا نقشی که از ثبات حاصل میگردد یک طیف جرمی است، نموداری از تعداد ذرات آشکار شده بر حسب تابعی از نسبت بار/جرم (m/e).
روش طیفسنجی جرمی تا همین اواخر که دستگاههای دقیق ارزانی در دسترس قرار گرفتند، هنوز مورد استفاده چندانی نداشت. این تکنیک با پیدایش دستگاههای تجاری که به سادگی تعمیر و نگهداری میشوند و با توجه به مناسب بودن قیمت آنها برای بیشتر آزمایشگاههای صنعتی و آموزشی و نیز بالا بودن قدرت تجزیه و تفکیک، در مطالعه تعیین ساختمان ترکیبات از اهمیت بسیاری برخوردار گشتهاست. امروزه با طیفهای سریع و مطمئن میتوان فرمول تجربی قطعات یونی را تعیین کرده و با تجهیزات اضافی یونهای شبه پایدار را اندازهگیری و طیفهای فعالسازی تصادفی (Collision Activation Spectra) را ثبت نمود. امتیاز این روش به دلیل دو عامل مهم است:
- امکان تعیین جرم مولکولی نسبی و تعیین نسبت اجزا ی سازنده عنصری یک ترکیب شیمیایی با استفاده از کمترین مقدار ماده.
- الگوی جزء به جزء شدن (تجزیه یک ماده تحت تأثیر بمباران الکترونی یا سایر روشها به منظور تشکیل یون) که در یک طیف جرمی، تشخیص ساختار ترکیب مورد نظر را امکانپذیر میسازد.
هنگامی که یک مولکول توسط الکترونهای پرانرژی در محفظه یونیزاسیون یک طیفسنج جرمی بمباران شد، علاوه بر از دست دادن یک الکترون و تشکیل یک یون آن مولکول همچنین مقداری از انرژی انتقال داده شده در اثر برخورد بین خود و الکترونهای ورودی را جذب میکند. این انرژی اضافی یون مولکول را در یک حالت برانگیخته ارتعاشی قرار میدهد. ممکن است این یون مولکولی برانگیخته ناپایدار بوده و مقداری از این انرژی اضافی را در اثر جز به جزء شدن از دست بدهد. اگر طول عمر یون مولکولی کمتر از 5-10 ثانیه باشد، قبل از آنکه در محفظه یونیزاسیون، شتاب داده شود جزء به جزء میشود. در چنین مواردی قلل مربوط به نسبتهای m/e این قطعات در طیف دیده میشوند. برای این ترکیب مشخص تمام یونهای مولکولی تشکیل شده به وسیله یونیزاسیون، دقیقاً طول عمر یکسانی را ندارند بلکه یونها دارای طول عمر متفاوتی هستند، بعضی از یونها طول عمر کمتری از دیگران دارند در نتیجه قلل مربوط به یون مولکولی و قطعات در طیف مشاهده میشود. برای اکثر ترکیباتی که در یک طبقه قرار دارند، طریقه جزء به جزء شدن تا حدودی وجه مشخص شده آن طبقه است و میتوان پیشبینی کرد که یک مولکول چگونه جزء به جز میشود. قبل از بحث در مورد جزء به جزء شدن هر طبقه از ترکیبات توضیح اصول فرایند جزء به جزء شدن مفید خواهد بود.
در آغاز یونیزاسیون مولکول نمونه مورد آزمایش تولید یک یون ملکولی کرده که نه تنها حامل یک بار مثبت است بلکه دارای یک الکترون جفت نشده نیز هست. پس در واقع یون ملکولی یک کاتیون – رادیکال بوده و شامل تعداد فردی از الکترونها است. قطعات یونی تشکیل شده در طیفسنج جرمی تقریباً همیشه تحت فرایندهای تک ملکولی ایجاد میگردند. فشار وارده بر نمونه در محفظه یونیزاسیون به حدی پایین بوده که اجازه برخوردهای دو ملکولی زیادی را نمیدهد. آن فرایندهای تک ملکولی که مقدار انرژی کافی دارند فراوانترین قطعات یونی را تولید میکنند. قطعات یونی تولید شده کاتیون هستند. شیمی این قطعات یونی را میتوان به میزان زیاد به صورت آنچه که در مورد یونهای کربونیم در محلول میدانیم بیان کرد.
برای مثال استخلاف آلکیل قطعات یونی را پایدار ساخته (و تشکیل آنان را سرعت میبخشد)، که شبیه به آن چیزی که در مورد یونهای کربونیم اتفاق میافتد. آن دسته از فرایندهای جزء به جزء شدن که منجر به تشکیل یونهای کم پایدار میشوند، مورد توجه هستند. اغلب، جزء به جزء شدن مستلزم از دست رفتن یک قطعه خنثی (بدون بار) است این قطعه خنثی در طیف جرمی ظاهر نشده ولی میتوان از روی اختلاف بین اجرام قطعه یونی و یون ملکولی اولیه، به وجود آن پیبرد. مجدداً فرایندهایی که منجر به تشکیل یک قطعه خنثی پایدار میگردند، بر فرایندهایی که منجر به تشکیل قطعات خنثی کم پایدار میشوند، ارجحیت دارند. اغلب اوقات جزء به جزء شدن با شکستن یک اتصال همراه است. در این فرایند، یون ملکولی که محتوی تعداد الکترونهای فرد و یک قطعه یونی با تعداد الکترون زوج ایجاد میکند. آن قطعه جدا شدهی خنثی یک رادیکال بوده در حالی که قطعه یونی از نوع یون کربونیم است. شکستن پیوندهایی که منجر به تشکیل یونهای کربونیم پایدارتر شوند مساعدتر هستند. یکی دیگر از مهمترین انواع جزء به شدن جزء مستلزم شکستن دو پیوند است. در این فرایند یون ملکولی حاوی الکترون فرد، یک قطعه یونی با الکترون فرد و یک قطعه خنثی با الکترون زوج (که معمولاً به صورت یک مولکول کوچک است) ایجاد میکند. بدین ترتیب جرم یونها را میتوان در فاز گازی تعیین کرد. تعیین جرم یونها و تبدیل مولکولهای خنثی به اجزای دارای بار به وسیلهی فرایندهای یونش اساس کار طیفسنجی جرمی است. پس از برخورد الکترون با مولکول، مولکول مورد نظر کاتیون رادیکال تشکیل میدهد که جرم مولکولی این کاتیون رادیکال با جرم مولکولی مولکول اولیه برابر است. کاتیون رادیکال تشکیل شده یک یون مولکولی است. پس از تشکیل یون مولکولی و شکستن یون مولکولی به گونههای کوچکتر، میتوان با استفاده از طیف بدست آمده، ساختار ترکیب را حدس زد. پس از تشکیل یونها، این یونها شتاب داده میشوند و بسته به نسبت بار/جرم (m/e) آنها با استفاده از میدانهای الکتریکی و مغناطیسی جدا میشوند. فراوانترین یون تشکیل شده در محفظهی یونیزاسیون، بلندترین قله را در طیف جرمی میدهد. این قله را قله مادر مینامند. البته محدودیتهای نیز برای تعیین جرم مولکولی یک نمونه با این روش وجود دارد:
- قطبیت یک ماده نسبت عکس با فراریت آن دارد.
- هر قدر جرم مولکولی نسبی بزرگتر باشد تعداد گروه عاملی هم بیشتر بوده پس خطر تجزیه حرارتی ان در اثر تبخیر بیشتر است.
تعیین وزن مولکولی
در عمل، تعیین وزن مولکولی، کاملاً به سادگی آن چیزی که در قبلاً اشاره شد، نیست. اول باید دانست که مقدار جرم هر یون شتاب داده شده در یک طیفسنج جرمی، جرم حقیقی آن است و نه وزن مولکولی آن که اوزان اتمی شیمیایی را بکار میبرد. مقیاس شیمیایی اوزان اتمی بر پایه میانگین اوزان تمامی ایزوتوپهای یک عنصر است. طیفسنج جرمی، توانایی تشخیص بین جرم ذرات حامل معمولترین ایزوتوپهای عناصر و ذرات حاصل ایزوتوپهای سنگینتر را دارد. در نتیجه، اجرامی که برای یونهای مولکولی مشاهده میشوند، اجرام مولکولهایی هستند که در آنها هر اتم بهصورت معمولترین (فراوانترین) ایزوتوپ خود وجود دارد.
دوم اینکه ممکن است مولکولهایی که توسط الکترونها بمباران میشوند، شکسته شده و به قطعات یونی مبدل گردند. در اثر این جزء به جزء شدن، طیفهای جرمی پیچیده شده و قلل موجود در نسبتهای (m/e) گوناگونی ظاهر میشوند. باید کاملاً دقیق و مطمئن بود که قله مشکوک واقعاً قله یون مولکولی است و نه مربوط به قطعه یونی. این مسئله، بخصوص هنگامی بحرانی میشود که درصد فراوانی یون مولکولی کم باشد، همانگونه که در یونهای مولکولی نسبتاً ناپایدار که به سادگی جزء به جزء میشوند، اتفاق میافتد.
مهمترین مسئله که باید بررسی کرد، آن است که اجرام یونهای آشکار شده در طیف جرمی را باید بهطور دقیق اندازهگیری نمود. خطایی به میزان فقط یک واحد جرمی تعیین ساختمان جسم را غیرممکن میسازد. طیف جرمی به صورت نموداری از درصد فراوانی یون بر حسب (m/e) است. همانگون که اشاره شد، فراوانترین یون تشکیل شده در محفظه یونیزاسیون بلندترین قله را در طیف جرمی دارد این پیک را پیک مادر میگویند. پیک دیگری که در طیف جرمی حائز اهمیت است پیک یون مولکول است یون مولکول ی یونیزه شده ترکیب خنثی است که در ی یونیزاسیون به وجود میآید و وزنی معادل وزن مولکول اولیه را دارد. برای اینکه یک مقدار ویژه (m/e) مربوط به یون مولکول باشد باید دارای سه معیار باشد:
- بدون در نظر گرفتن ایزوتوپها، یون مولکول باید نشان دهندهی بیشترین جرم یونی در طیف باشد. تعیین
- تعداد الکترونهای یون باید فرد باشد.
- ترکیب نماینده یون مولکول باید قادر به تولید یونهای مهم در ناحیه جرم بالای طیف باشد به عبارتی باید توانایی تشکیل قطعات یونی را در طیف جرمی داشته باشد.
گاهی برای تأیید قله یون مولکول از قاعده نیتروژن استفاده میشود. طبق این قاعده اگر در ترکیبی تعداد زوجی از اتمهای نیتروژن داشته باشیم یا اصلاً نداشته باشیم یون مولکول آن در (m/e) زوج ظاهر میشود از طرفی مولکولهای که تعداد نیتروژن فرد داشته باشند ایجاد یون مولکول فرد میکنند. این قاعده برای تمام ترکیباتی که دارای کربن، هیدروژن، اکسیژن، نیتروژن، گوگرد، هالوژن و همچنین بعضی از اتمهای کمتر معمولی مانند فسفر، برم، سیلیکون، آرسنیک و فلزات قلیایی خاکی میباشند صادق است.
اغلب مولکولها به صورت مخلوطی از ایزوتوپها وجود دارند و پیکهایی که به وسیلهی یونهای حامل این ایزوتوپهای سنگین به وجود میآیند و در طیف جرمی وجود دارند در تعیین فرمول مولکولی کاربرد دارد. ایزوتوپهای سنگینتر پیکهایی ایجاد میکنند که شدت آنها نسبت به پیک اصلی کوچکتر است. این پیکها به صورت M+1 و M+2 در طیف جرمی ترکیبها دیده میشوند که جرم آنها نسبت به جرم یون مولکول به ترتیب ۱ و۲ واحد بیشتر است. بهطور مثال برای اتم برم (Br) ارتفاع پیکهای M+ و M+2 تقریباً برابر است یا برای اتم کلر ارتفاع پیک M+ تقریباً یه برابر پیک M+2 است.
برای آلکانهای زنجیری خطی یا نرمال، قله یون ملکولی را میتوان مشاهده کرد، هر قدر اسکلت کربن شاخهایتر شود، شدت قله یون ملکولی نیز کاهش مییابد. میتوان این اثر را هنگام مقایسه طیف جرمی بوتان و ایزوبوتان به خوبی مشاهده کرد. در ایزوبوتان قله یون ملکولی به مراتب ضعیفتر از قله یون مولکولی بوتان است.
یک قطعهی مهم در طیف جرمی آلکانها در ۴۱= m/eایجاد میشود. این قطعه، یون کربونیم آلیل است.
دادهها
دادههای بسیاری را میتوان از طیفسنجی جرمی بدست آورده که معمولترین آنها طیف جرمی است. این طیف نمودار فراوانی نسبی یونها بر حسب نسبت m/z است. پیک مبنا فراوانترین یون مشاهدهشدهاست که به عنوان فراوانی نسبی ۱۰۰٪ در نظر گرفته میشود.
نشریات مرتبط
فهرست مجلات عملی مرتبط با طیفسنجی جرمی که در ردهبندی مجلات در زمینه طیفسنجی جزو ۱۰ مجله برتر جهان در سال ۲۰۰۵ بودند، در زیر آمدهاست.[3]
- Mass Spectrometry Reviews - انتشارات وایلی - دسترسی آنلاین
- Journal of the American Society for Mass Spectrometry - انتشارات الزویر - دسترسی آنلاین
- Journal of Mass Spectrometry - انتشارات وایلی - دسترسی آنلاین
- Rapid Communications in Mass Spectrometry - انتشارات وایلی - دسترسی آنلاین
منابع
- *Physical and Biophysical Chemistry Division Commission on Molecular Structure and Spectroscopy, Recommendations for nomenclature and symbolism for mass spectroscopy (including an appendix of terms used in vacuum technology). (Recommendations 1991), Pure and Applied Chemistry, 1991, Vol. 63, No. 10, pp. 1541-1566 doi:10.1351/pac199163101541
- *E. De Hoffmann and V. Stroobant, Mass Spectrometry: Principles and Applications, 2nd edn, John Wiley & Sons Ltd, Chichester (2001).
-
- "Journals Ranked by Impact: Spectroscopy". The Thomson Corporation. December 2006. Archived from the original on 9 October 2008. Retrieved 26 December 2008.
پیوند به بیرون
| منابع کتابخانهای دربارۀ طیفسنجی جرمی |
| در ویکیانبار پروندههایی دربارهٔ طیفسنجی جرمی موجود است. |
| معنای طیفسنجی جرمی را در ویکیواژه، واژهنامهٔ آزاد، ببینید. |
- Mass Spectrometry در کرلی
- Interactive tutorial on mass spectra National High Magnetic Field Laboratory
- Mass spectrometer simulation An interactive application simulating the console of a mass spectrometer
- Realtime Mass Spectra simulation Tool to simulate mass spectra in the browser