رژیم غذایی کتوژنیک
رژیم غذایی کتوژنیک[persian-alpha 1] یا رژیم کتونزا[1] یا رژیم پُرچربی یک گونه رژیم غذایی است با چربی زیاد، اندازهٔ کافیِ پروتئین و قندِ اندک، که بدن را وادار میکند تا بهجای قند، از چربی برای تأمین انرژی استفاده کند. از این رژیم برای درمان صرعهای مقاوم به درمان در کودکان استفاده میشود.
| رژیم غذایی کتوژنیک | |
|---|---|
 سنجش میزان کتون ادرار | |
| سرعنوانهای موضوعی پزشکی | D055423 |
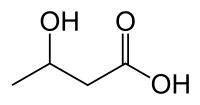
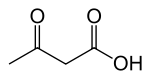
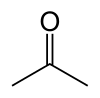
در حالت عادی، قندهای موجود در غذا در بدن انسان به گلوکز مبدل شده و در سرتاسر بدن — بهویژه مغز — پخش میشود تا به عنوان منبع انرژی، سوزانده شود. حال اگر در رژیم غذایی، مقدار قند کم باشد، کبد، چربی را به اسید چرب و اجسام کتونی مبدل میکند. این اجسام کتونی به مغز رفته و جایگزین گلوکز میشود. هرگاه سطح اجسام کتونی در خون (و مغز) بالا برود و کتوزیس ایجاد شود، شمار حملات صرعی کاهش مییابد.[2]
تقریباً نیمی از کودکان و جوانان مبتلا به صرع که یکی از اینگونه رژیمها را آزمودهاند، شاهد کاهش شمار حملات صرعیشان به نصف بودهاند و این اثرِ مطلوب، حتی پس از قطع کردن رژیم ادامه داشتهاست.[3] شواهدی در دست است که نشان میدهد بزرگسالان مبتلا به صرع هم ممکن است از این رژیم غذایی سود ببرند و یک رژیم نهچندان سفتوسخت نظیر «رژیم غذائی اتکینز تعدیلشده»[persian-alpha 2] نیز به همان اندازه مؤثر است.[2]برخی از عوارض جانبی رژیم کتوژنیک عبارتند از یبوست، بالا رفتن کلسترول، کاهش سرعت رشد و سنگهای کلیوی.[4]
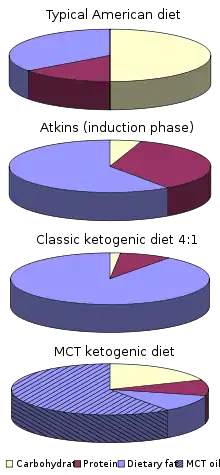
رژیم اولیه درمانی که در صرع کودکان بکار میرود، فقط آن اندازهای پروتئین دارد که برای رشد و ترمیم بدن و تأمین کالری[persian-alpha 3] لازم برای تناسب قد و وزن در آن سن، کافی باشد. رژیم کتوژنیکِ درمانیِ کلاسیک در دههٔ ۱۹۲۰ میلادی گسترش یافت و یک دهه بعد نیز همچنان رایج بود، ولی با ساخت داروهای ضد صرع، کمکمرو به فراموشی رفت. در این رژیم کلاسیک، نسبتِ وزنی چربی به پروتئینهای ترکیبی و کربوهیدرات ۴ به ۱ است که برای به دست آوردنش میبایست از خوراکیهایی که محتوای کربوهیدراتشان بالاست (مثلاً میوهها و سبزیجات نشاستهای، نان، پاستا، غلات و شکر) اجتناب کرد و در عوض مصرف غذاهای حاوی چربی، همچون مغزدانهها، خامه و کره را افزایش داد.[2] اغلب چربیهای غذایی، از ملکولهایی به نام «تریگلیسرید با زنجیره بلند» تشکیل شدهاند؛ ولی تریگلیسریدها با زنجیره متوسط (امسیتی)[persian-alpha 4] که از اسیدهای چرب با زنجیرههای کربنی کوتاهتر ساخته شدهاند، ویژگی کتوژنیک بیشتری دارند. یک نمونه از رژیم کلاسیکِ کتوژنیک موسوم به «رژیم کتوژنیک امسیتی» از گونهای روغن نارگیل بهره میبرد که غنی از تریگلیسریدهای زنجیره متوسط است و نیمی از کالری مورد نیاز را فراهم میکند. از آنجایی که در این نوع رژیم، چربی کمتری بکار میرود، میزان بیشتری از پروتئین و کربوهیدرات را میتوان به آن افزود و در نتیجه بیمار، گوناگونی غذایی و حق انتخاب بیشتری دارد.[5][6]
در میانهٔ دههٔ ۹۰ میلادی، جیم آبراهامز که پسرش از صرع شدید و مقاومبهدرمان رنج میبرد و با این روش به خوبی درمان شده بود، با تأسیس «بنیاد چارلی» ،[persian-alpha 5] به ترویج دوباره آن پرداخت. از جمله کارهای تبلیغاتی وی حضور در برنامهٔ تلویزیونی دیتلاین انبیسی و کارگردانی و تهیهٔ تلهفیلم ...اول، آسیب نرسان با هنرنمایی مریل استریپ بود. این بنیاد همچنین، پشتیبانی مالی از یک مطالعهٔ پژوهشی در چندین مرکز را بهعهده گرفت که نتایجش در ۱۹۹۶ میلادی منتشر شد و آغازی برای توجه علمی دوباره به این رژیم غذایی درمانی بود.[2] بهغیر از صرع، چندین استفادهٔ درمانی احتمالی دیگر برای این رژیم وجود دارد که در دست پژوهش و بررسی است و برخی از آنها عبارتند از: درمان بیماری آلزایمر، اسکلروز جانبی آمیوتروفیک، اوتیسم، تومور مغزی، سردرد، آسیب مغزی، درد، بیماری پارکینسون و اختلالات خواب.
صرع
صرع پس از سکته مغزی یکی از شایعترین اختلالات مغزی-عصبی است و در حدود ۵۰ میلیون نفر در سرتاسر جهان، از آن رنج میبرند.[7] صرع با وقوع تشنجهای مکرر و بیجهت در افراد تشخیص داده میشود؛ تشنج زمانی رخ میدهد که رشتههای عصبی در قشر مغز بهطور همزمان و غیرقابل کنترلی، پالسهای الکتریکی «شلیک» کنند که موجب درهمریختگی عملکرد طبیعی مغز شود. بهعنوان مثال این واقعه میتواند ماهیچهها، حواس پنجگانه، هوشیاری یا ترکیبی از همگی را مختل کند. تشنجها یا «موضعی» هستند (محدود به یک نقطهٔ خاص از مغز) یا «فراگیر و منتشر» (که در سرتاسر مغز منتشر شده و منجر به کاهش سطح هوشیاری میشود). دلایل بروز صرع گوناگون است، برخی از آنها در دستهٔ سندرمهای صرعی جای دارند که اغلب در دوران کودکی آغاز میشوند. اگر صرعی با تجویز دو یا سه داروی ضدتشنج کنترل و درمان نشود به آن «مقاومبهدرمان» میگویند. حدود ۶۰٪ از بیماران با تجویز نخستین داروی ضد صرع، تشنجهایشان کنترل میشود؛ از سوی دیگر، در نزدیک به ۳۰٪ بیماران صرع با تجویز دارو کنترل و مهار نمیشود. اگر دارودرمانی بینتیجه باشد، آنگاه گزینههای دیگری همچون «جراحی صرع»، «تحریک عصب واگ» و «رژیم کتوژنیک» مطرح میشود.[8]
تاریخچه
رژیم کتوژنیک اصلیترین قسمت تغذیهدرمانی است که علت بهوجود آمدنش، بازآفرینی موفقیتهای بهدستآمده در روشهای درمانی نامتداولی چون «گرسنگی طولانیمدت»[persian-alpha 6] در درمان صرع و رفع محدودیتهای آنها بود.[persian-alpha 7] گرچه این رژیم در دهههای ۲۰ و ۳۰ میلادی بسیار رایج بود، اما به سبب کشف و تولید داروهای جدید ضد تشنج رها شد.[2] بسیاری از افراد میتوانند تشنجهایشان را با مصرف دارو و با موفقیت کامل، کنترل کنند. با این وجود، ۲۰–۳۰٪ از این درمانهای دارویی، علیرغم استفاده از داروهای گوناگون، با شکست مواجه میشوند.[9] از همین رو در چنین بیمارانی و بهخصوص در کودکان، رژیم کتوژنیک مجدداً دارای اهمیت و نقش درمانی شدهاست.[2][10]
پرهیز از غذا

طبیبان یونان باستان برخی بیماریها و از جمله صرع را با تغییر در رژیم غذایی بیماران درمان میکردند. یک رسالهٔ قدیمی در «مجموعهنوشتههای بقراطی»[persian-alpha 8] با عنوان «دربارهٔ بیماری مقدس»[persian-alpha 9] به بیماری صرع میپردازد و زمان نگارش آن به حوالی سال ۴۰۰ پیش از میلاد مسیح بازمیگردد. نویسندهٔ این رساله استدلالهایی علیه این باور عمومی و غالب میآورد که بیماری صرع و درمانش، منشأ آسمانی و فراطبیعی دارند و رژیمدرمانی را بر پایهٔ دلایل منطقی و طبیعی پیشنهاد میکند.[11] در همین مجموعه، نویسندهٔ رسالهٔ «بیماریهای همهگیر»[persian-alpha 10] مردی را شرح میدهد که صرعاش با پرهیز کامل از خوردن و آشامیدن، با همان سرعتی که ایجاد شده بود برطرف شد.[12] اراسیستراتوس، پزشک سلطنتی سلوکوس یکم، اظهار داشت «فرد مبتلا به صرع را باید بدون ترحم از خوردن و آشامیدن منع کرد و غذایش را در جیرههایی با اندازه کم به او داد.»[13] جالینوس اعتقاد داشت «تقلیل و کاهش خورد و خوراک»[14] ممکن است منجر به درمان قطعی موارد خفیف بیماری شده و در سایر موارد نیز مفید باشد.[15]
نخستین پژوهش معاصر در زمینهٔ اثرات پرهیز غذایی در درمان صرع، در ۱۹۱۱ میلادی در فرانسه انجام شد.[16] بیست بیمار صرعی از تمامی گروههای سنی را با استفاده از یک رژیم گیاهخواری کمکالری در کنار گرسنگی طولانیمدت و تصفیهٔ مزاج، «سمزُدایی»[persian-alpha 11] کردند. از این روش درمانی، دو بیمار بهشدت سود بردند اما بیشترشان نتوانستند به محدودیتهای اعمالشده، پایبند بمانند. در ضمن این رژیم، تواناییهای ذهنی بیماران را در مقایسه با دارویشان پتاسیم برمید که ذهن را کُند و مغشوش میکرد، بهبود بخشید.[17]
در همین هنگام، برنار مکفدن، یکی از چهرههای شاخص جنبش تناسب اندام در آمریکا، پرهیز غذایی را در جامعهٔ آمریکا، بهعنوان وسیلهای برای دستیابی به سلامتی جسمانی ترویج نموده و مورد توجه عامهٔ مردم قرار داد. یکی از شاگردان او که یک پزشک استیوپاتی به نام «هیو کانکلین»[persian-alpha 12] از اهالی بتلکریک، میشیگان بود، بیماران صرعی خود را با توصیه به تحمل گرسنگی و پرهیز غذایی درمان نمود. کانکلین گمان داشت که تشنجهای صرعی به سبب نوعی سم ایجاد میشود که از پلاکهای پییر در روده ترشح شده و به خون میریزند. او به بیمارانش توصیه میکرد که به مدت ۱۸ الی ۲۵ روز، پرهیز شدید از غذا داشته باشند تا این سم از خون پاک شود. کانکلین شاید صدها بیمار صرعی خود را با «رژیم آب»[persian-alpha 13] درمان نمود و میزان موفقیتش در درمان قطعی کودکان و بزرگسالان، به ترتیب ۹۰ و ۵۰ درصد بود. بررسیهای بعدی نشان داد که ۲۰٪ از بیماران صرعی وی تا آخر عمر دچار تشنج نشدند و ۵۰٪ آنان هم بهبود نسبی پیدا کردند.[10]
روش رژیمدرمانی کانکلین از سوی متخصصان مغز و اعصاب مورد پذیرش واقع شد و در درمان رایج صرع، فراگیر شد. در ۱۹۱۶ میلادی، دکتر مکمورای[persian-alpha 14] گزارشی برای «ژورنال پزشکی نیویورک» نوشت و مدعی شد که بیماران مبتلا به صرع خود را، از سال ۱۹۱۲ با موفقیت کامل با استفاده از همین پرهیز غذایی و سپس یک رژیم فاقد نشاسته و قند درمان نمودهاست. در سال ۱۹۲۱، متخصص برجستهٔ غدد درونریز «اچ. رال گایلین» تجربیات خود را در گردهمایی انجمن پزشکی آمریکا گزارش نمود. او مستقیماً شاهد موفقیتهای کانکلین بود و تلاش کرده بود همان نتایج را در ۳۶ بیمار خود بدست آورد. وی نتایج مشابهی در بیماران خود بهدستآورد اما بیمارانش را تنها به مدت کوتاهی پیگیری نمود. بررسیهای بعدی نشان داد که تشنجهای بیماران پس از قطع رژیم غذایی، دوباره بازگشته بودند. چارلز هاولند،[persian-alpha 15] پدر یکی از کودکان معالجهشده توسط کانکلین و یک وکیل ثروتمند نیویورکی، به برادرش جان هاولند که متخصص اطفال و استاد بیمارستان جانز هاپکینز بود، ۵٬۰۰۰ دلار هدیه کرد تا دربارهٔ «کتوز ناشی از گرسنگی»[persian-alpha 16] تحقیقاتی کند. جان هاولند نیز این پول را صرف پژوهشی نمود که توسط استنلی کاب و ویلیام گوردون لنوکس انجام شد.[10]
رژیم غذایی
در سال ۱۹۲۱ میلادی، «رولین وودیات»[persian-alpha 17] مطالعه و مروری بر روی پژوهشهای مرتبط با رژیم غذایی و دیابت انجام داد. او گزارش کرد سه مادهٔ محلول در آب به نامهای بتا-هیدروکسیبوتیریک اسید، اسید استواستیک و استون (که در مجموع و با هم اجسام کتونی نامیده میشوند) در کبد افراد سالم، هنگامی که گرسنه بمانند یا رژیم غذایی کمکربوهیدرات و پُرچرب داشته باشند، تولید میشوند. راسل وایلدر[persian-alpha 18] در مایو کلینیک بر پایهٔ همین پژوهش، اصطلاح «رژیم کتوژنیک» را ابداع کرد تا اشارهای به تولید سطوح بالای اجسام کتونی در خون در اثر مصرف فراوان چربی و مصرف اندک کربوهیدرات داشته باشد. او امیدوار بود که سودمندی غذا نخوردن و گرسنگی در اینگونه رژیمهای غذایی، پایدار و دائمی باشد. کارآزماییهای بالینی وی بر روی چند بیمار مبتلا به صرع در ۱۹۲۱ میلادی، نخستین کاربرد رژیم کتوژنیک در درمان صرع محسوب میشود.[10]
یکی از همکاران وایلدر که متخصص اطفالی به نام «مینی پیترمن»[persian-alpha 19] بود، رژیم کلاسیک کتوژنیک را فرمولبندی و تنظیم کرد. مطابق فرمول او، پروتئین مصرفی میبایست ۱ گرم به ازای هر کیلوگرم وزن بدن کودکان به همراهِ ۱۰ تا ۱۵ گرم کربوهیدرات در روز باشد و مابقی کالری مورد نیاز از چربی بدست آید. کارهای پیترمن در دهههای ۲۰ میلادی روشهای «القا»[persian-alpha 20] و «نگهدارنده»[persian-alpha 21] این رژیم را تبیین نمود. پیترمن اثرات مثبت (بهبود هوشیاری، رفتاری و خواب) و عوارض جانبی (تهوع و استفراغ ناشی از کتوزیس زیاد) را ثبت کرد. کاربرد این رژیم در کودکان مبتلا، بسیار موفق بود. پیترمن در ۱۹۲۵ میلادی گزارش کرد که ۹۵٪ از ۳۷ بیمار جوان او، کنترل موفقیتآمیزی در تشنجهایشان داشتهاند و ۶۰٪ شان از بند این بیماری رهایی یافتهاند. تا ۱۹۳۰ میلادی، این رژیم در ۱۰۰ نوجوان و بزرگسال مورد آزمایش واقع شد. «کلیفورد باربورکا»[persian-alpha 22] از مایو کلینیک گزارش نمود که ۵۶٪ بیماران بزرگسال، تشنجهایشان کمتر شد و ۱۲٪ عاری از هرگونه تشنج شدند. با آنکه نتایج بدستآمده در بزرگسالان با مطالعات معاصر همخوانی دارد، باربورکا نتیجه گرفت بزرگسالان از این نوع رژیم درمانی چندان بهره نمیگیرند و رژیم کتوژنیک از آن زمان تا ۱۹۹۹ میلادی، دیگر در بزرگسالان بررسی نشد.[10][18]
ضد صرعها و افول
در دهههای ۱۹۲۰ و ۱۹۳۰ میلادی، هنگامی که تنها داروهای ضد صرع موجود، برمیدها (کشفشده در ۱۸۵۷) و فنوباربیتال (۱۹۱۲) بودند، رژیم کتوژنیک بهطور گستردهای مورد استفاده و پژوهش بود. این روند در ۱۹۳۸ میلادی تغییر کرد. در آن سال، اچ. هیوستون مریت و تریسی پوتنام داروی فنیتوئین (با نام تجاری «دیلانتین») را کشف کردند و تمرکز پژوهشها به سمت کشف داروهای جدیدتر رفت. با معرفی والپروات سدیم در دههٔ ۱۹۷۰ میلادی، دیگر داروهای مؤثر کافی برای درمان طیف وسیعی از سندرمهای تشنجی در اختیار بود و استفاده از رژیم کتوژنیک، تنها محدود به سندرم لنوکس-گستو گشت و بیشازپیش رو به افول نهاد.[10]
رژیم امسیتی

در دههٔ ۱۹۶۰ میلادی، کشف شد که تریگلیسریدهای با زنجیره متوسط (امسیتیها) بهنسبت چربیهای رایج در رژیم عادی غذایی (که بیشتر حاوی تریگلیسریدهای با زنجیرهٔ بلند هستند)،[19] اجسام کتونی بیشتری در هر واحد غذایی یکسان ایجاد میکنند. امسیتیها جذب بهتری دارند و بهسرعت از طریق سیستم پورتال کبدی به کبد حمل میشوند (چربیهای عادی غذاها، از طریق دستگاه لنفاوی حمل میشوند).[20] از آنجایی که در رژیم کلاسیک کتوژنیک میزان قند بسیار اندک است، والدین نمیتوانستند غذاهای خوشطعم و دلپذیر برای کودکانشان درست کنند. در ۱۹۷۱ میلادی، پیتر هوتنلوخر نوعی رژیم کتوژنیک ابداع کرد که ۶۰٪ کالری آن از روغن امسیتی بهدست میآمد. این موضوع اجازه میداد که پروتئین بیشتری در رژیم غذایی بکار گرفته شود و میزان قند آن نیز سه برابر رژیم کلاسیک باشد. روغن امسیتی را با دستکم دو برابر حجمش از شیر رقیق (شیر خامهگرفته) مخلوط و سپس سرد میکردند و هنگام غذا به کودکان میخوراندند یا با غذایشان قاطی میکردند. هوتنلوخر این رژیم را بر روی ۱۲ کودک و نوجوان مبتلا به صرع مقاوم آزمود. بیشتر کودکان هم از لحاظ تشنجها و هم از لحاظ سطح هوشیاری بهبود قابل ملاحظه یافتند و نتایج مشابهی با مصرف رژیم کلاسیک قدیمی بهدست آمد. گرچه ناراحتیهای گوارشی، یکی از عوارض این رژیم بود و یکی از بیماران بههمین دلیل از مصرف آن منصرف شد، اما تهیهٔ غذاهای قابل تحمل و خوشطعم برای کودکان آسانتر بود.[19] رژیم امسیتی در بسیاری از بیمارستانها جایگزین رژیم کلاسیک قبلی شد، اما برخی مراکز هم رژیمهایی ابداع کردند که ترکیبی از هر دو بود.[10]
بازگشت
رژیم کتوژنیک بار دیگر در اکتبر ۱۹۹۴ میلادی و پس از نمایش گزارشی در برنامهٔ تلویزیونی دِیتلاین دربارهٔ بیماری چارلی آبراهامز، فرزندِ تهیهکنندهٔ هالیوود جیم آبراهامز، مورد توجه عمومی رسانهای در سراسر آمریکا قرار گرفت. این کودک دو ساله، از یک صرع مقاومبهدرمان رنج میبُرد که به داروهای رایج پاسخ نمیداد. پدرش پس از خواندن مطلبی دربارهٔ رژیم کتوژنیک در یک کتابچهٔ راهنمای بیماران، پسرش را نزد جان فریمن در بیمارستان جانز هاپکینز برد که هنوز از این روش قدیمی برای درمان صرع استفاده میکرد. با بهکارگیری این رژیم، صرع چارلی بهسرعت تحت کنترل درآمد و شاخصههای رشد و تکامل به حالت عادی برگشت. این موضوع سبب شد تا جیم آبراهامز، «بنیاد چارلی» را پایهگذاری کند تا علاوه بر ترویج این روش درمانی، برای پژوهشهای آتی نیز پول تهیه کند.[10] بدین ترتیب یک پژوهش آیندهنگر چندمرکزی در سال ۱۹۹۴ آغاز شد و نتایج آن در ۱۹۹۶ منتشر شده[21] و به «انجمن صرع آمریکا» ارائه شد. در سال ۱۹۹۸، موج عظیمی از علاقمندی علمی به این رژیم درمانی پدیدار گشت. در ۱۹۹۷ میلادی، آبراهامز تهیهکنندگی فیلمی را به نام ...اول، آسیب نرسان با بازی مریل استریپ به عهده گرفت که در آن صرع شدید یک کودک با استفاده از رژیم کتوژنیک با موفقیت درمان میشود.[2]
تا ۲۰۰۷ میلادی، این رژیم در ۷۵ مرکز در ۴۵ کشور جهان در دسترس بود و انواعی از آن همچون رژیم تعدیلشدهٔ اتکینز که محدودیت کمتری داشتند هم بهویژه در نوجوانان و بزرگسالان مورد استفاده قرار گرفت. پژوهشهای دیگری نیز جهت استفاده از این رژیم برای درمان بیماریهای دیگری بجز صرع به جریان افتاد.[2]
اثربخشی
رژیم کتوژنیک، تعداد تشنجها را در بیش از نیمی از مصرفکنندگان به میزان ۵۰٪ و در یک سوم بیماران به میزانِ بیش از ۹۰٪ کاهش میدهد.[4] پاسخدهی درمانی در سه چهارم کودکان ظرف ۲ هفتهٔ اول پدیدار میشود، اما متخصصان میگویند این رژیم باید دستکم ۳ ماه ادامه یابد تا بتوان گفت اثربخش نیست.[9] انتظار بیشتری میرود که کودکان مبتلا به صرعهای مقاومبهدرمان، در مقایسه با مصرف یک داروی ضد صرع دیگر، از رژیم غذایی بهرهٔ بهتری بگیرند.[2] شواهدی موجود است که نشان میدهد نوجوانان و بزرگسالان نیز میتوانند از این رژیم غذایی بهرهمند شوند.[9]
طرح مطالعه
بررسیهای پیشین موفقیت این روش را بالا گزارش نموده بود. در یک مطالعه که در سال ۱۹۲۵ میلادی صورت گرفت نشان داده شد ۶۰٪ بیماران از تشنج رهایی یافتند و ۳۵٪ از آنان، کاهش پنجاه درصدی در تعداد تشنجها را تجربه کردند. در اینگونه مطالعات (که به آن «مطالعهٔ همگروهی گذشتهنگر» میگویند) اغلب یک گروه از بیماران که اخیراً توسط پزشک درمان شدهاند را با گروه دیگری از بیماران مشابه که تنها رژیم غذایی را بهدرستی رعایت کردهاند مورد مقایسه قرار میدهند. اما این مطالعات قدیمی را به سختی میتوان با مطالعات امروزی مقایسه کرد؛ مطالعات قدیمی اغلب دچار سوگیری گزینش بودند، چرا که بیمارانی را که قادر به آغاز یا ادامهٔ این رژیم نبودند از مطالعه حذف میکردند و در نتیجه فقط افرادی در مطالعه لحاظ میشدند که میتوانستند نتایج نهایی آن را بهبود بخشند. بهمنظور رفع این نقیصه، پژوهشهای امروزی از روش «مطالعهٔ همگروهی آیندهنگر» استفاده میکنند که در آن تمام بیماران قبل از شروع پژوهش، انتخاب میشوند و تا انتهای پژوهش دنبال میشوند. در این روش نتایج نهایی، تمامی بیماران را فارغ از اینکه توانستند درمان مورد نظر را آغاز یا تکمیل کنند در بر میگیرد و به آن اصطلاحاً «تحلیل با قصد درمان»[persian-alpha 23] میگویند.[22]
یک تفاوت دیگر میان پژوهشهای قدیمی و جدیدتر نوع بیمارانی است که با این رژیم درمان شدهاند. در مطالعات قدیمی رژیم کتوژنیک برای درمان کودکان، آخرین چاره محسوب نمیشد ولی در مطالعات جدید، کودکان مبتلا اغلب از پیش چندین داروی ضد صرع را مصرف کردهاند و پاسخی دریافت نکردهاند و تشنجشان از نوع مقاومبهدرمان تلقی شدهاست. مطالعات اولیه و معاصر همچنین در پروتکلهای درمانی هم متفاوت هستند. در پروتکلهای قدیمی، درمان به صورت یک گرسنگی طولانیمدت آغاز میشد تا بیمار محدودیت شدید دریافت کالری داشت ۵–۱۰٪ وزن بدنش را از دست بدهد، اما نگرانیهایی که بر سرِ سلامتی و رشد کودک وجود داشت سبب شد تا در پروتکلهای جدید محدودیتهای رژیمی کمتر شود.[22] محدودیت دریافت مایعات در گذشته یکی از ویژگیهای این رژیم درمانی بود، اما چون موجب یبوست و سنگ کلیه میشد، دیگر آن را مفید نمیدانند.[4]
نتایج مطالعات
مطالعهای در بیمارستان جانز هاپکینز[23] با روش «تحلیل با قصد درمان» طراحی شد و نتایجش در ۱۹۹۸ میلادی منتشر گشت و سپس با یک گزارش دیگر در سال ۲۰۰۱ پیگیری شد.[24] همچون اغلب اینگونه مطالعات، هیچگونه «گروه شاهد» (بیمارانی که درمان مورد نظر را دریافت نکردند) برای مقایسه وجود نداشت. ۱۵۰ کودک در این بررسی حضور داشتند که پس از سه ماه، ۸۳٪ توانستند به این رژیم ادامه دهند و از آن میان، ۲۶٪ کاهش خوب در تشنجها، ۳۱٪ کاهش عالی در تشنجها و ۳٪ رهایی کامل از بند تشنجها داشتند.[persian-alpha 24] ظرف ۱۲ ماه، ۵۵٪ همچنان به رژیم اِعمالشده پایبند ماندند، ۲۳٪ کاهش خوب در تشنجها، ۲۰٪ کاهش عالی در تشنجها و ۷٪ رهایی کامل از بند تشنجها داشتند. بیمارانی که تا این مرحله، رژیم را رها کرده بودند آنهایی بودند که یا هیچ تأثیری از آن ندیدند، یا نوع رژیم غذایی برایشان بیشازحد محدودکننده بود، یا دچار بیماری دیگری شدند. بیشتر کودکانی که توانستند به رژیم پایبند باشند، از آن سود بردند. درصد آنهایی که توانستند رژیم کتوژنیک را بهمدت دو، سه و چهار سال ادامه دهند به ترتیب، ۳۹٪، ۲۰٪ و ۱۲٪ بود. طی این مدت، شایعترین دلیل قطع رژیم آن بود که یا کودک بهکلی از تشنجها رهایی یافت یا آن که بهبود قابلملاحظهای یافت. طی چهار سال، ۱۶٪ از ۱۵۰ بیمار اولیه، کاهش قابلملاحظه، ۱۴٪ کاهش عالی و ۱۳٪ رهایی کامل از تشنجها را داشتند که البته این آمار، آنهایی را هم که قادر به ادامهٔ رژیم نبودند، در بر میگیرد. آنهایی که پس از این مدت همچنان رژیم را ادامه دادند، بیمارانی بودند که تشنجهایشان بکلی قطع نشد، اما کاهش عالی در تعداد آنها داشتند.[24][25] همچنین چندین فراتحلیل (متا-آنالیز) نتایج بهدست آمده از چند مطالعه کوچک را با هم آمیختهاند تا نتیجهای بهدست آید که معمولاً بهلحاظ آماری قویتر از هر یک از آنها بهتنهایی است؛ یکی از آنها که در ۲۰۰۶ میلادی انجام شد ۱۹ پژوهش را با تعداد کلی ۱٬۰۸۴ بیمار تحلیل کرد،[26] و نتیجه گرفت که یکسوم از این بیماران کاهش عالی در تعداد تشنجها و نیمی از آنها کاهش قابلقبول و خوبی در آنها داشتند.[4]
یک مرور سیستماتیک در ۲۰۱۶ میلادی، ۷ کارآزمایی بالینی تصادفی کنترلشده از بهکارگیری رژیم کتوژنیک را در کودکان و نوجوانان دچار صرع مورد بررسی قرار داد.[3] این کارآزماییهای بالینی در کودکانی انجام شده بود که به داروهای رایج ضد تشنج پاسخی نداده بودند و تنها در یکی از این کارآزماییهای بالینی، یک گروه اختصاصدادهشده به رژیم کتوژنیک را با یک گروه دیگر که این رژیم را دریافت نکرده بودند (گروه شاهد) مقایسه کرده بودند.[20] کارآزماییهای دیگر، نوع خاصی از رژیم یا روشهای القای آن را استفاده کردند بودند که برای کودکان قابل تحمل باشد.[3] حدود ۴۰٪ از کودکان و نوجوانان مبتلا، در مقایسه با گروه شاهد کاهش پنجاهدرصدی یا کمتر در تعداد تشنجها داشتند. ۱۰٪ آنها پس از چند سال، همچنان رژیم را ادامه دادند.[3] عوارض جانبی همچون گرسنگی و از دست دادن انرژی شایع بود و ۳۰٪ نیز دچار یبوست شدند.[20]
یک مرور سیستماتیک در ۲۰۱۸ میلادی، ۱۶ پژوهش دربارهٔ رژیم کتوژنیک را در بالغین بررسی کرد و نتیجه گرفت که این روش، روزبهروز فراگیرتر میشود و نتایج آن مشابه کودکان است و عوارض خفیفتری نیز دارد. با این حال، بسیاری از بیماران، این رژیم را بنا به دلایل گوناگون رها کردند و کیفیت شواهد علمی نیز در مقایسه با کودکان پائینتر بود. مشکلات پیشآمده شاملِ الدیال بالا، کلسترول تام بالا و کاهش وزن بود.[27]
موارد مصرف و منع مصرف
رژیم کتوژنیک به عنوان یک درمانِ همراه (مکمل) در کودکان و نوجوانان مبتلا به صرعمقاومبهدارو، کاربرد دارد.[29][30] در اسکاتلند،[30] انگلستان و ولز،[29] این روش، مطابق بر «دستورالعملهای بالینی کشوری» است و در ایالات متحده آمریکا، تقریباً تمامی شرکتهای بیمه آن را تحت پوشش خود قرار دادهاند.[31] کودکانی که ضایعهٔ فوکال مغزی دارند (یعنی یک نقطهٔ خاص در مغزشان شروعکننده تشنج است) و نامزد انجام جراحی هستند با احتمال بیشتری پس از جراحی و آغاز این رژیم، بهبود کامل (عاری از تشنج) خواهند یافت.[9][32] حدود یک سوم از مراکزی که رژیم کتوژنیک را به کودکان ارائه میکنند رژیمهای مشابهی هم برای بالغین مبتلا دارند.[9] برخی پزشکان، دو گونهٔ کمتر محدودکننده از این رژیم غذایی — «درمان با شاخص گلوکز پائین»[persian-alpha 25] و «رژیم تعدیلشدهٔ اَتکینز» — را برای نوجوانان و بالغین مفیدتر میدانند. نوع مایع این رژیم، در شیرخواران و کودکانی که با لوله تغذیه میشوند، آسانتر آماده و بهتر تحمل میگردد.[6][33]
طرفداران این رژیم میگویند هرگاه بیماری به دو داروی ضد تشنج پاسخ نداد، این رژیم را باید جداً مد نظر داشت چرا که احتمال پاسخ به سایر داروها در چنین بیمارانی تنها ۱۰٪ است.[9][34][35] ثابت شده که رژیم کتوژنیک در برخی سندرمهای تشنجی، فایده و تأثیرگذاری خاصی دارد و باید زودتر آغاز شود. برخی از این سندرمها عبارتند از: سندرم دراوه، اسپاسمهای صرعی، صرع میوکلونیک آستاتیک، و سندرم توبروز اسکلروزیس.[9][36]
در ۲۰۰۵ میلادی در یک نظرسنجی از ۸۸ متخصص مغز و اعصاب اطفال در آمریکا، مشخص شد که تنها ۳۶٪ آنها پس از شکست درمان با دو دارو، رژیم کتوژنیک را تجویز میکنند، ۲۴٪ بهطور گاهبهگاه از این رژیم بهعنوان آخرین چاره بهره بردند و ۲۴٪ بهندرت و تنها در چند مورد، آن را به کار بسته بودند و ۱۶٪ نیز بههیچوجه آن را تجویز نکرده بودند. چندین توضیح برای چنین شکافی مابین «شواهد علمی» و «تجویز بالینی» وجود دارد.[37] یکی از آنها شاید، فقدان حضور متخصصان تغذیهای باشد که در این زمینه آموزشهای کافی دیدهاند و وجودشان برای انجام این درمان لازم است.[34]
از آنجایی که این رژیم غذایی، متابولیسم بدن را تغییر میدهد، رژیم کتوژنیک، درمانِ خطِ اول در کودکانی است که دچار برخی «خطاهای ارثی متابولیسم» همچون کمبود پیرووات دهیدروژناز و کمبود Glut1 هستند[38] و در آنها، بدن اجازه نمییابد تا از کربوهیدرات به عنوان سوخت استفاده کند و به همین سبب وابسته به اجسام کتونی است. رژیم کتوژنیک در درمان تشنجها و برخی از علائم دیگر اینگونه بیماریها سودمند است و از موارد مطلقاً ضروری تجویز آن است.[39] از طرفی، این رژیم در بیماران مبتلا به کمبود پیرووات کربوکسیلاز، پورفیری و سایر خطاهای ارثی نادر در متابولیسم چربی منع مصرف مطلق دارد.[9] افرادی که دچار اختلال در اکسیداسیون اسید چرب هستند، قادر به سوختوساز اسیدهای چرب موجود در این رژیم (که جایگزین کربوهیدرات برای تأمین انرژی شده) نیستند. با رژیم کتوژنیک، بدن ایشان شروع به مصرف ذخایر پروتئینی خود کرده و کتواسیدوز و در نهایت کما و مرگ حادث میشود.[40]
تداخل اثر
رژیم کتوژنیک معمولاً همزمان با داروهای ضد صرع آغاز میشود و اگر موفق باشد، داروها را کمکم قطع میکنند. شواهدی موجود است که استفادهٔ همزمانِ این رژیم بههمراه «تحریک عصب واگ» یا داروی زونیساماید، ممکن است اثر همافزایی داشته باشند، و همچنین تجویز همزمان با فنوباربیتال در کودکان موفقیت چندانی ندارد.[4]
عوارض جانبی
رژیم کتوژنیک، یک رژیم جامع، بیخطر و طبیعی برای درمان صرع نیست و همانند هرگونه دارودرمانی دیگر، احتمال بروز عوارض وجود دارد.[31] این عوارض، عموماً کمتر و خفیفتر از عوارض داروهای ضد صرع یا جراحی است.[31] عوارض شایعی که به آسانی درمان میشوند عبارتند از یبوست، اسیدوز خفیف و هیپوگلیسمی، در صورتی که فرد در آغاز گرسنگی طولانی داشته باشد. حدود ۶۰٪ از کودکان دچار افزایش چربی خون میشوند[41] و سطح کلسترول در حدود ۳۰٪ بالا میرود.[31] این مشکل را میتوان با تغییراتی در نوع چربی موجود در رژیم غذایی کنترل کرد و بهعنوان مثال، چربیهای اشباع را به چربیهای غیراشباع چندگانه تغییر داد و اگر مشکل ادامه یافت، نسبت کتوژنیک[persian-alpha 26] را کاهش داد.[41] همچنین برای جبران کاهش ریزمغذیها لازم است مکملهای لازم به آن غذا افزوده شود.[4]
مصرف طولانیمدت این رژیم در کودکان با خطر کاهش نرخ رشد یا حتی توقف آن، شکستگی استخوانها و سنگهای کلیوی همراه است.[4] این رژیم سطح فاکتور رشد شبه انسولین ۱ را کاهش میدهد که برای رشد در دوران کودکی ضروری است. همچون داروهای ضد صرع، این رژیم غذایی بر روی سلامت استخوانها اثرات سوء دارد. عوامل مختلفی همچون بروز اسیدوز و کاهش هورمون رشد در این موضوع دخیلند.[41] در حدود یک نفر از هر ۲۰ کودکی که رژیم کتوژنیک مصرف میکنند دچار سنگ کلیه خواهند شد (در مقام مقایسه، در کودکان سالم سنگ کلیه شیوعی در حدود یک در چندین هزار کودک دارد). یکی از عوارض شناختهشدهٔ داروهای خانوادهٔ بازدارندههای کربنیک آنهیدراز (همچون توپیرامات و زونیساماید) افزایش احتمال ابتلا به سنگهای کلیوی است، اما مصرف همزمان این داروها با رژیم کتوژنیک، این خطر را در مقایسه با مصرف رژیم غذایی بهتنهایی، افزایش بیشتری نمیدهد. سنگهای کلیوی را میتوان درمان کرد و دلیل خوبی برای قطع رژیم کتوژنیک نیست.[42] بیمارستان جانز هاپکینز امروزه به بیماران مکملهای پتاسیم سیترات میدهد که احتمال سنگهای کلیوی را ۷ برابر کم میکند.[43] با اینحال این تجویز تجربی، تاکنون در کارآزماییهای آیندهنگر شاهددار بررسی و تأیید نشدهاست.[9] علت بروز سنگهای کلیوی ناشی از رژیم غذایی ۴ چیز است:[42]
- بهدلیل اسیدوز ایجاد شده، استخوانهای بدن شروع به از دست دادن مواد معدنی خود کرده و بدین ترتیب میزان کلسیم دفعشده در ادرار بالا میرود. استخوانها از ترکیب فسفات کلسیم ساخته شدهاند؛ فسفات با اسید واکنش نشان میدهد، اما کلسیم اضافی از ادرار دفع میشود.[42]
- کاهش سیترات ادرار: در مصرفکنندگان این رژیم، سطح سیترات ادرار بهطور غیرعادی پائین است. سیترات در حالت معمول به انحلال کلسیم آزاد کمک میکند.[42]
- پیاچ ادرار در این بیماران، پائین (اسیدی) است. در نتیجه اجازهٔ انحلال به اوریک اسید نمیدهد و بدین ترتیب کریستالهایی از این ماده تشکیل میشود که همچون هستهای برای سنگهای کلسیمی عمل میکنند.[42]
- بسیاری از مراکز بهطور سنتی میزان مصرف آب بیماران را به ۸۰٪ نیاز روزانه کاهش میدهند و این موضوع خود مزید بر علت است و امروزه دیگر توصیه نمیشود.[4]
در نوجوانان و بالغین، عوارض شایع گزارش شده عبارتند از: کاهش وزن، یبوست، دیسلیپیدمی و در بانوان قاعدگی دردناک.[44]
نحوهٔ اجرا
تجویز رژیم کتوژنیک یک روش درمانی تغذیهای پزشکی است و نیازمند حضور و همکاری متخصصان گوناگونی از حوزههای مختلف سلامت است. اعضا این تیم معمولاً شامل یک «متخصص پروانهدار تغذیهٔ کودکان» که مسئول هماهنگسازی برنامهٔ رژیم غذایی است و یک «پرستار دارای پروانه رسمی» که با صرع کودکان آشنایی کافی داشته باشد. ممکن است به یاری یک «مددکار اجتماعی طبی» جهت همکاری با خانوادهٔ بیمار و همچنین یک داروساز جهت رایزنی و توصیهٔ محتوای کربوهیدرات داروهایی که بیمار مصرف میکند، نیز نیاز باشد. در نهایت، لازم است والدین کودک و همهٔ کسانی که به نحوی از کودک مراقبت میکنند، آموزشهای لازم را در مورد جنبههای مختلف رژیم کتوژنیک گذرانده باشند تا بتوان تا حد امکان، این رژیم را با خطر کمتری اجرا کرد.[6] اجرای این رژیم ممکن است بهسبب نیاز به صرفِ وقت برای اندازهگیری دقیق و برنامهریزی برای نوع و میزان غذاها، با مشکلاتی برای والدین و مراقبین کودک همراه باشد. از آنجایی که مصرفِ هرگونه مادهٔ غذایی خارج از این برنامه، میتواند تعادل لازم برای کارکرد صحیح آن را مختل کند، بسیاری از افراد، مقررات و انضباط لازم برای اجرا و ادامهاش را ناخوشایند و دشوار مییابند. برخی افراد رژیم را رها کرده و به رژیمهای سادهتری همچون «رژیم غذائی اتکینز تعدیلشده» و «رژیم غذایی با شاخص گلوکز پائین» روی میآورند، چرا که مشکلات اجرای رژیم کتوژنیک را بیش از حد میدانند.[45]
آغاز
پروتکل بیمارستان جانز هاپکینز برای آغاز این رژیم، امروزه رواج گستردهای یافتهاست.[46] در آغاز یک جلسهٔ مشاوره با والدین و سایر مراقبین کودک انجام میشود و سپس کودک، به مدت کوتاهی در بیمارستان بستری میشود.[22] از آنجایی که در آغاز این رژیم، خطر عوارض گوناگونی موجود است، بسیاری از مراکز ترجیح میدهند تا شروع آن، تحتِ نظارتِ نزدیک و دقیقِ پزشکی در بیمارستان باشد.[9] در جلسهٔ مشاورهٔ اولیه، والدین را از لحاظ وجود شرایط یا وضعیتی که با این رژیم منع تجویز دارند، غربالگری میکنند. یک تاریخچه کامل از وضعیت تغذیهای کودک تهیه و پارامترهای رژیم غذاییاش انتخاب میشود، این عوامل شامل نسبت کتوژنیک چربی به ترکیبی از پروتئین و کربوهیدرات، نیازهای انرژی (کالری) و میزان مایعات دریافتی میباشد.[22] یک روز قبل از بستری در بیمارستان، محتوای قندی غذای کودک را کاهش داده و کودک پس از شام، دیگر هیچ چیزی نمیخورد. هنگام بستری تا زمان شام، به بیمار فقط مایعات بدون کالری و بدون کافئین داده میشود.[40] شام، شامل اگناگ[persian-alpha 27] و محدود به یک سوم کالری موجود در غذای عادی است. صبحانه و نهار روز بعد هم همین است و در شام روز دوم، محتوای کالری اگناگ را به دو سوم کالری موجود در غذاهای عادی افزایش میدهند. شام روز سوم، محتوای کالریاش کامل است و دیگر اگناگ نیست، بلکه رژیم اصلی کتوژنیک است که آغاز میشود. پس از صبحانهٔ کتوژنیک در روز چهارم، بیمار مرخص میشود. تا حد امکان، تمامی قرصها و داروهای ضد تشنج بیمار را باید به انواعی تغییر داد که فاقد قند در فرمولاسیون خود هستند.[22] هنگامی که کودک در بیمارستان بستری است، قند خون را چندین مرتبه در طی روز، آزمایش میکنند و او را از لحاظ بروز کتوزیس علامتدار زیر نظر میگیرند (که با تجوی مقادیر اندکی از آب پرتقال قابل درمان است). فقدان انرژی و لتارژی بهطور شایع دیده میشود اما ظرف دو هفته برطرف میشوند.[21] والدین سه روز اول را بهطور کامل در کلاسهای آموزشی میگذرانند که شامل مباحثی دربارهٔ تغذیه، مدیریت رژیم غذایی، تهیه غذا، خودداری از مصرف قند و رسیدگی و ادارهٔ بیماری است.[22] سطح آموزش والدین و میزان تعهد آنان به اجرای صحیح رژیم بیشتر از آنانی است که فقط دارو مصرف میکنند.[47]
گوناگونی و چندسانی در اجرای پروتکل بیمارستان جانز هاپکینز شایع است. آغاز رژیم ممکن است در کلینیکهای سرپایی انجام شود و بیمار در بیمارستان بستری نشود. بیشتر مراکز، آن گرسنگی اولیه را به کودک نمیدهند. (گرسنگی طولانی، خطر اسیدوز و کاهش قند خون و از دست رفتن وزن را افزایش میدهد). بهجای افزایش تدریجی میزان غذا در سه روز اول، برخی مراکز درمانی، اندازهٔ غذا را ثابت نگه میدارند، اما نسبت کتوژنیک را از ۲:۱ به ۴:۱ تغییر میدهند.[9]
در بیمارانی که این رژیم مفید واقع میشود، نیمی ظرف ۵ روز، شاهد کاهش تشنجها هستند (در صورتی که رژیم غذایی با ۱ تا ۲ روز گرسنگی اولیه شروع شده باشد)، سه چهارم ظرف ۲ هفته و ۹۰٪ ظرف ۲۳ روز، شاهد کاهش تشنجها خواهند بود. اگر رژیم را با گرسنگی اولیه آغاز نکنند، زمان رسیدن به بهبودی نسبی در نیمی از بیماران کمی طولانیتر (۲ هفته) است، اما میزان کاهش تشنجها در درازمدت، تفاوتی ندارد.[47] والدین تشویق میشوند که پیش از هرگونه قضاوت دربارهٔ اثربخشی این رژیم غذایی، دستکم بهمدت ۳ ماه به آن پایبند مانده و آن را ادامه دهند.[9]
باقی ماندن در درمان و ادامه آن
پس از آغاز رژیم، کودک بهطور منظم در کلینیکهای سرپایی توسط متخصص مغز و اعصاب و متخصص تغذیه ویزیت میشود و آزمایشهای گوناگونی انجام میشود. این ویزیتها و آزمایشها باید در سال اول، هر سه ماه یکبار، و در سالهای بعدی، هر شش ماه یکبار باشد. نوزادان کمتر از یکسال را باید بیشتر و زودتر ویزیت کرد و نخستین ویزیت باید ظرف ۲ تا ۴ هفته از آغاز رژیم باشد.[9] در ابتدا، اصلاح و تعدیلهای اندکی لازم است تا اطمینان حاصل شود کتوزیس به سطح مورد نیاز رسیده و بیمار به برنامه غذایی عادت کند. این اصلاح و تعدیلهای جزئی و دقیق، اغلب توسط متخصص تغذیهٔ بیمارستان و از طریق تلفن انجام میشود[22] و شامل تغییر در میزان کالری، تغییر نسبت کتوژنیک یا افزودن مقداری تریگلیسرید با زنجیره متوسط یا روغن نارگیل به رژیم کلاسیک است.[4] سطح کتون ادرار، روزانه اندازهگیری میشود تا مطمئن شوند کتوزیس دلخواه بدست آمده و بیمار به رژیمش پایبند بوده یا خیر، با این وجود، سطح کتون ادرار ارتباطی با اثرات ضد تشنجی آن ندارد.[22] این آزمایش با نوارهای آزمایش کتون نیتروپروساید انجام میشود که رنگش در حضور اَستواَستون (یکی از سه اجسام کتونی) از «صورتی براق» به «قرمز آلبالویی» تغییر میکند.[48]
یک دورهٔ کوتاهمدت از افزایش تشنجها در طی بیماری یا در اثر نوسان سطح کتونهای خون محتمل است. اگر تشنجها همچنان زیاد باشد یا کودک وزن کم کند، باید رژیم را تعدیل کرد.[22] از دسترفتن کنترل تشنجها، ممکن است دلایل دور از انتظاری داشته باشد. حتی غذاهای بهاصطلاح «بی قند»، ممکن است حاوی کربوهیدراتهایی مثل مالتودکسترین، سوربیتول، نشاسته و فروکتوز باشند. میزان سوربیتول موجود در لوسیونهای ضدآفتاب و سایر محصولات بهداشتی پوست گاهی آن اندازه بالاست که قادر به جذب از طریق پوست و بی اثر کردن کتوزیس باشد.[34]
قطع درمان
حدود ۲۰٪ از کودکان با این رژیم بهطور کامل از تشنجها رهایی مییابند و بسیاری دیگر نیز میتوانند مصرف داروهای ضد صرع را کاهش داده یا به کلی قطع کنند.
بهطور شایع پس از ۲ سال، یا ۶ ماه بعد از قطع کاملِ تشنجها، میتوان اندکاندک ظرف دو تا سه ماه رژیم را قطع کرد. اینکار از طریق کاهش نسبت کتوژنیک انجام میشود تا آنجایی که دیگر کتون در ادرار قابل ردیابی نباشد و سپس، تمامی محدودیتهای کالری برداشته میشود.[49] روش و زمانبندی قطع رژیم کتوژنیک، مشابه قطع تدریجی داروهای ضد صرع، پس از بهبود کاملِ تشنجها در کودکان است. آنگاه که رژیم کتوژنیک برای درمان برخی اختلالات متابولیک استفاده شود، زمانش طولانیتر میگردد. مدت زمان استفاده از رژیم غذایی کتوژنیک بستگی به والدین و تیم تغذیه دارد و دورههای درمانی تا ۱۲ سال هم، بررسی و سودمندیشان ثابت شدهاست.[9]
کودکانی که پس از رهایی کامل از بند تشنجها، این رژیم را قطع میکنند، ۲۰٪ احتمال دارد که تشنجشان مجدداً عود کند. زمان وقوع عود بسیار متغیر، اما بهطور میانگین دو سال است. احتمال عود با «جراحی تکهبرداری» (که بخشی از مغز برداشته میشود) قابل مقایسه میباشد که ۱۰٪ است. این میزان برای داروهای ضد صرع ۳۰–۵۰٪ میباشد. کمی بیش از نصف کسانی که دچار عود میشوند، با داروهای ضد صرع یا اجرای مجدد رژیم کتوژنیک، بهبودی کامل را بازمییابند. کسانی که نوار مغزیشان دارای امواج نیزهای صرعی باشد، حتی اگر بهبود کامل اولیه داشته باشند، احتمال عودشان بیشتر است، چرا که نشان میدهد، هنوز در مغز فعالیتهای تشنجی خفیف موجود است، اما هنوز به آن سطحی نرسیده که تشنج ایجاد کند. همچنین احتمال عود در کسانی که تصویر امآرآی مغزشان، دارای شواهدی از ضایعات موضعی باشد (مثلاً در کودکان مبتلا به توبروز اسکلروزیس) بیشتر است. چنین کودکانی باید بیش از میانگین در این رژیم باقی بمانند و حتی توصیه شده، کودکان مبتلا به توبروز اسکلروزیس تا پایان عمر، رژیم کتوژنیک را اجرا کنند.[49]
انواع
کلاسیک
رژیم کتوژنیک توسط متخصص تغذیه، برای هر کودک بهطور اختصاصی برآورد و طراحی میشود. سن، وزن، میزان فعالیت، فرهنگ و اولویتها و علائق غذایی، طراحی این رژیم را تحتالشعاع خود قرار میدهند. نخست آنکه میزان کالری مورد نیاز را روی ۸۰–۹۰٪ میزان انرژی توصیهشدهٔ روزانه (RDA) برای سن کودک تنظیم میکنند. (رژیم پُرچربی به میزان انرژی کمتری نسبت به رژیمهای قنددار معمولی نیازمند است). کودکانی که فعالیت زیادی دارند یا آنهایی که دچار اسپاستیسیته و گرفتگی ماهیچهای هستند، به انرژی بیشتری نیاز دارند و کودکانی که تحرک کافی ندارند، نیازشان به کالری، کمتر است. نسبت کتوژنیک در این رژیم، مقایسهٔ وزن چربی به ترکیبی از پروتئین و قند است. این نسبت معمولاً ۴:۱ است، اما کودکان کمتر از ۱۸ ماه یا بزرگتر از ۱۲ سال، یا آنهایی که چاق هستند، با نسبت ۳:۱ آغاز میکنند. چربی، سرشار از انرژی است و هر گرم از آن، ۹ کیلوکالری (۳۸ کیلوژول) انرژی دارد. در مقایسه، پروتئین و قند هریک، دارای ۴ کیلوکالری (۱۷ کیلوژول) انرژی به ازای هر گرم وزن هستند، در نتیجه وعدههای غذایی رژیم کتوژنیک معمولاً کمتر از وعدههای غذایی معمولی است. میزان چربی موجود در رژیم را میتوان با توجه به انرژی کلی مورد نیاز و نسبت کتوژنیک، محاسبه کرد. سپس پروتئین آن را بر اساس نیازهای روزانه جهت رشد مناسب بیمار و حفظ سلامت بدن محاسبه میکنند که حدوداً ۱ گرم پروتئین به ازای هر کیلو وزن بدن است. در انتها، کربوهیدرات را بر اساس باقیماندهٔ نیاز انرژی، ضمن حفظ نسبت کتوژنیک، تعیین میکنند. هرگونه قند موجود در ترکیبات دارویی یا مکملهای غذایی را باید از میزان قند محاسبهشده رژیم روزانه کم کرد. سپس میزان کلی چربی، پروتئین و قند روزانه را مابین وعدههای غذایی پخش میکنند.[40]
میتوان از برنامههای کامپیوتری نظیر «کتوکَلکیولیتور»[persian-alpha 28] برای دستورالعمل پخت غذا و تهیه آن استفاده کرد.[50] غذاها اغلب دارای ۴ بخش اصلی هستند: خامهٔ غلیظ زدهشده، یک غذای سرشار از پروتئین (معمولاً گوشت)، میوه یا سبزی و یک منبع چربی همچون کَره، روغن گیاهی یا سس مایونز. تنها میوهها و سبزیجاتی که حاوی مقادیر اندک قند هستند، قابل تجویزند و طبعاً شامل موز، سیبزمینی، نخود فرنگی و ذرت نمیگردد. میوههای و سبزیجات مناسب، بر پایهٔ میزان قندشان، هر کدام به دو گروه تقسیم میشوند. خوراکیهای هر یک از این چهار گروه را به منظور تنوع غذایی، میتوان به راحتی و بدون نیاز به محاسبهٔ مجدد، جابجا کرد. بهعنوان مثال، کلم بروکلی پخته، کلم بروکسل، گل کلم و لوبیا سبز معادل و همارز یکدیگرند. خوراکیهای تازه، کنسروشده یا یخزده نیز معادل هم هستند، اما سبزیجات پخته و خام با هم تفاوت غذایی دارند و غذاهای فراوریشده نیز یک معضل جداگانه محسوب میشوند. والدین میبایست وزن و میزان خوراکیها را با دقت فراوان و با استفاده از یک ترازوی الکترونیک با دقت ۱ گرم، اندازهگیری کنند. کودک باید تمامی غذای خود را بهطور کامل (و نه نصفهنیمه) بخورد و نمیتواند غذای بیشتری در هر وعده دریافت کند. هرگونه میانوعده، خوراکی مختصر یا چاشت، میبایست در رژیم کلی روزانه محاسبه شده باشد. میتوان مقدار اندکی روغن MCT جهت کمک به رفع یبوست یا افزایش میزان کتوز تجویز کرد.[40] رژیم کلاسیک کتوژنیک، رژیمی بینقص و متعادل نیست و تنها مقادیر اندکی میوه، سبزی، غلات غنیشده و خوراکیهای کلیسمدار دارد. بهویژه ویتامینهای گروه ب، کلسیم و ویتامین دی باید به شکلِ مکملهای مصنوعی به غذا افزوده شود. برای این منظور، دو مکملغذاییِ بدون قند که بهطور اختصاصی برای سن بیمار طراحی و محاسبه شده، به غذا میافزایند: یک مولتی ویتامین با مواد مغذی معدنی و دیگری ترکیبی از کلسیم و ویتامین دی.[4] بهعنوان نمونه، یک دستور غذایی روزانه با نسبت کتوژنیک ۴:۱ و انرژی ۱٬۵۰۰ کیلوکالری (۶٬۳۰۰ کیلوژول) شامل موارد زیر است:[31]
- صبحانه: تخممرغ با بیکن
۲۸ گرم تخممرغ، ۱۱ گرم بیکن، ۳۷ گرم از خامهٔ غلیظ زدهشدهٔ ۳۶٪، ۲۳ گرم کره و ۹ گرم سیب. - چاشت یا میانغذا: یک گوی کوچک از کره بادام زمینی
۶ گرم کره بادامزمینی و ۹ گرم کره. - نهار: سالاد تن ماهی
۲۸ گرم ماهی تن، ۳۰ گرم سس مایونز، ۱۰ گرم کرفس، ۳۶ گرم از خامهٔ غلیظِ ۳۶٪ و ۱۵ گرم کاهو. - چاشت یا میانغذا: ماست مخصوص کِتو
۱۸ گرم از خامهٔ غلیظِ ۳۶٪، ۱۷ گرم خامه ترش، ۴ گرم توتفرنگی و شیرینکنندهٔ مصنوعی. - شام: چیزبرگر (بدون نان)
۲۲ گرم گوشت گاو ریزریزشده (چرخکرده)، ۱۰ گرم پنیر آمریکایی، ۲۶ گرم کَره، ۳۸ گرم خامه، ۱۰ گرم کاهو و ۱۱ گرم لوبیا سبز. - چاشت یا میانغذا: کاستارد مخصوص کِتو
۲۵ گرم از خامهٔ غلیظ زدهشدهٔ ۳۶٪، ۹ گرم تخممرغ و طعمدهندهٔ خالص وانیل.
روغن MCT
چربی موجود در رژیم معمولی روزانه بیشتر حاوی «تریگلیسرید با زنجیرهٔ بلند» (LCT) است. تریگلیسرید با زنجیره متوسط (MCT) بیشتر از LCTها، کتوژنیک هستند؛ چرا که هنگام سوختوساز، کتونهای بیشتری بر حسب واحد انرژی تولید میکنند. بدین ترتیب، استفاده از تریگلیسرید با زنجیره متوسط، این اجازه را میدهد تا از چربی کمتر و پروتئین و قند بیشتری در وعدههای غذایی استفاده شود.[4] و بدین ترتیب، وعدههای غذایی پرحجمتر و تنوع غذاها بیشتر شود.[5] رژیم اولیه و اصلی MCT که توسط پیتر هوتنلوخر در دههٔ هفتاد میلادی ارائه شد، ۶۰٪ از روغن MCT تشکیل شده بود.[19] مصرف این میزان از روغن MCT ممکن است در برخی کودکان، منجر به دلپیچه، اسهال و استفراغ شود. میزان ۴۵٪، معمولاً عدد مناسبی است تا ضمن برقراری یک کتوز خوب، عوارض گوارشی آن نیز بهحداقل رسیده و میان این دو، تعادل برقرار شود. رژیم کتوژنیک MCT کلاسیک و تعدیلشده، هر دو به یک اندازه مؤثرند و تفاوتشان در تحملپذیری، بهلحاظ آماری، قابل توجه و چشمگیر نیست.[9] رژیم MCT چندان در ایالات متحده آمریکا رواج ندارد، روغن MCT از سایر چربیهای رژیمی گرانتر بوده و تحت پوشش شرکتهای بیمه هم نیست.[4]
رژیم تعدیلشدهٔ اَتکینز
این رژیم نخستین بار در ۲۰۰۳ میلادی مطرح شد و ایدهٔ استفاده از آن زمانی شکل گرفت که بیماران و والدینشان متوجه شدند، در فاز اولیهٔ شروع رژیم غذائی اتکینز معمولی، تشنجها متوقف میشوند. «تیم رژیم کتوژنیک» در بیمارستان جانز هاپکینز، این رژیم را با حذفِ هدفِ اصلیاش که همانا کاهش وزن است و همچنین با برقراریِ مداوم و نامحدودِ مرحلهٔ القاء (آغازین) آن، و بهویژه تشویق به مصرفِ بیشتر چربی، تعدیل کردند. در مقایسه با رژیم کتوژنیک کلاسیک، رژیم تعدیلشدهٔ اَتکینز (MAD) محدودیتی برای کالری و پروتئین نداشته و بهدلیلِ نسبت کتوژنیک کمتر (در حدود ۱:۱)، ضرورت چندانی به کنترل دقیق و شدید ندارد. این رژیم با تحمیل گرسنگی طولانیمدت به بیمار آغاز نمیشود، نیازی به بستری بیمارستانی ندارد و اتکاء کمتری به متخصص تغذیه دارد. کربوهیدرات در آغاز محدود به ۱۰ گرم در روز در کودکان و ۲۰ گرم در روز در بالغین است و بر حسب میزان کنترل تشنجها، تحملپذیری بیمار و محدودیتهای دیگر، ظرف یکماه تا ۲۰ تا ۳۰ گرم در روز افزایش داده میشود. همانند رژیم کلاسیک کتوژنیک، این رژیم غذایی هم نیازمند مکملهای افزودنی ویتامینها و املاح در کودکان است و به صورت دورهای، در کلینیکهای سرپایی کنترل و تنظیم میشود.[51] رژیم تعدیلشدهٔ اتکینز تعداد تشنجها را در ۴۳٪ بیماران، بیش از ۵۰٪ و در ۲۷٪ از مصرفکنندگان بیش از ۹۰٪ کاهش میدهد.[4] گرچه کلسترول بیمار بالا میرود و مطالعهٔ طولانیمدت نیز بر روی این رژیم انجام نشدهاست،[51] اما عوارض گزارششده با این رژیم اندک است. با آنکه اطلاعات موجود دربارهٔ این رژیم از تعداد کمی بیمار (۱۲۶ کودک و بزرگسال از ۱۱ مطالعه در پنج مرکز درمانی) بدست آمدهاست، اما نتایج نهایی گزارششده در ۲۰۰۹ میلادی، به نحو مطلوبی، قابل مقایسه با رژیم سنتی کتوژنیک است.[4]
درمان با شاخص پائین گلوکز
درمان با شاخص گلوکز کم (LGIT)[52] تلاشی است تا همان سطحِ مطلوب گلوکزِ خون در بیمارانی که رژیم کلاسیک کتوژنیک مصرف میکنند، حاصل شود و در عین حال، کودک محدودیتهای رژیمی کمتری داشته باشد. فرض بر آن است که ثابتماندن سطح گلوکز خون، یکی از مکانیسمهایی است که در عملکرد رژیم کتوژنیک مؤثر است[9] و علت این سطح ثابت قند، آن است که محتوای چربی زیادتر در غذا، باعث میشود که جذب معدود کربوهیدراتهای آن، کمتر شود.[6] با آنکه میزان چربی در این رژیم نیز هنوز بالاست (۶۰٪ انرژی از طریق چربی تأمین میشود)،[6] اما محتوای قندی آن بیشتر از رژیم کلاسیک کتوژنیک و رژیم تعدیلشدهٔ اتکینز و در حدود ۴۰ تا ۶۰ گرم در روز است.[4] با این وجود، کربوهیدراتهایی که در این رژیم بکار گرفته میشوند، محدود به آنهایی هستند که شاخص گلوکز کمتری (کمتر از ۵۰) دارند. همچون رژیم تعدیلشدهٔ اتکینز، رژیم LGIT نیز در کلینیکهای سرپایی آغاز و برقرار میشوند و نیازی به اندازهگیری بسیار دقیق وزن غذاها یا پشتیبانی و نظارت شدید توسط متخصص تغذیه ندارد. هر دو رژیم اخیر، در بسیاری از مراکزی که ارائهدهندهٔ برنامههای رژیمی کلاسیک کتوژنیک هستند، عرضه میشود و در برخی مراکز، رژیم اصلی و عمدهٔ ارائهشونده به نوجوانان مبتلاست.[9]
نتایج کوتاهمدت رژیم LGIT نشان میدهد که دستکم ظرف یک ماه، تقریباً نیمی از بیماران شاهد کاهش بیش از ۵۰٪ از تشنجهایشان هستند و نتایج کلی در درازمدت مشابه رژیم کلاسیک کتوژنیک است. برخی اطلاعات (از یکی از مراکز درمانی با ۷۶ کودک تا ۲۰۰۹ میلادی) نشان میدهد که عوارض جانبی این رژیم کمتر از رژیم کلاسیک کتوژنیک است و بهتر از آن تحمل میشود و غذاهای دلپذیر و خوشمزهتری را شامل میشود.[4][53]
فرمولبندیهای نسخهای و از پیش ساختهشده

شیرخواران و بیمارانی که تغذیهشان از طریق لوله معده انجام میشود نیز، میتوانند رژیم کتوژنیک داشته باشند. والدین بیمار، یک فُرمولاسیون پودری نسخهای نظیر «کتوکَل»[persian-alpha 29] را بهصورت غذای مایع درمیآورند.[22] آنهایی که لوله معده دارند، مشکلی با مسئلهٔ «طعم غذا» ندارند و نوزادان نیز، بهخوبی این فرمولبندی کتوژنیک را میپذیرند.[34] برخی مطالعات نشان میدهد که این خوراکی مایع مؤثرتر از رژیم کتوژنیک جامد معمولی است و در مصرفکنندگان آن، سطح کلسترول خون پائینتر است.[4] کتوکَل یک غذای کامل و جامع است که حاوی پروتئین شیر و مکملهای اسید آمینه، چربی، کربوهیدرات، املاح و عناصر کممقدار است. این پودر در کودکان بالای یک سال، جهت برقراری نسبت کتوژنیک ۴:۱ تجویز میشود. این ترکیب همچنین در نسبتهای کتوژنیک ۳:۱ و ۴:۱ و در انواع بیطعم یا مزهٔ وانیلی شیرینشده توسط شیرینکنندههای مصنوعی در دسترس[54] و برای تغذیهٔ لولهای یا دهانی مناسب است. دو گونه پودر از پیشساختهشده دیگر وجود دارد که «کتووالو»[persian-alpha 30][55] و «کتونیا»[persian-alpha 31][56] نام دارند. از سوی دیگر، یک رژیم کتوژنیک مایع دیگر را میتوان با مخلوط کردنِ شیرخشکِ سویای «راس کربوهیدرات فری»[persian-alpha 32] با «میکرولیپید»[persian-alpha 33] و «پلیکوز»[persian-alpha 34] ساخت.[56]
سایر نقاط جهان
بهلحاظ نظری، هیچگونه محدودیت جغرافیایی در استفاده از رژیم کتوژنیک وجود ندارد و این رژیم، ارزانتر از داروهای ضد صرع است. با این وجود، گرسنگی طولانی (روزهداری) و تغذیه، تحت تأثیر دین و مسائل فرهنگی است. در فرهنگهایی که غذا توسط پدربزرگ و مادربزرگ یا با کمک افراد دیگری از خانواده تهیه میشود، طبیعتاً افراد بیشتری، باید تحت آموزشهای لازم برای اجرای صحیح رژیم کتوژنیک قرار بگیرند. وقتی که خانوادهها با یکدیگر غذا میخورند و همگی نیز از یک غذا استفاده میکنند، جدا کردن غذای یک کودک از بقیه، ممکن است آسان نباشد. در بسیاری از کشورها، خوراکیها، «برچسب تعیین ارزش غذایی» ندارند و در نتیجه، محاسبهٔ میزان چربی، پروتئین و کربوهیدرات غذا راحت نیست. در برخی از کشورها، یافتن داروها و مکملهای عاری از قند، ترازوهای دقیق الکترونیک، یا تهیهٔ روغنهای MCT (بهلحاظ اقتصادی) دشوار است.[57] در آسیا، منبع اصلی دریافت انرژی در رژیم غذایی معمولیِ، برنج و نودل است و به همین دلیل، حذف آنها سخت است؛ بنابراین، رژیم کتوژنیکی که از روغن MCT تشکیل شده باشد (که حاوی کربوهیدرات بیشتری نیز هست)، بسیار سودمند است. در هند، اعتقادات مذهبی، تغذیه را تحت تأثیر قرار میدهد: برخی افراد گیاهخوارند، یا سبزیجات ریشهای نمیخورند، یا از گوشت گاو حذر میکنند. رژیم کتوژنیک هندی به سبب تعارض فرهنگی با مسئله گرسنگی دادن به کودکان، بدون گرسنگی طولانیِ اولیه آغاز میشود. ماهیت کمچرب و پُرقندِ رژیمهای رایج غذایی در هند و آسیا، بدان معناست که رژیمهای کتوژنیک این ناحیه نسبت کتوژنیک پائینتری (۱:۱) نسبت به رژیمهای مشابه اروپایی و آمریکایی دارند. با این وجود، به نظر میرسد که کارایی هر دو رژیم، به یک اندازه باشد.[57]
در بسیاری از کشورهای در حال توسعه، رژیم کتوژنیک گران تمام میشوند؛ چرا که چربی لبنی و گوشت، گرانتر از غلات، میوهها و سبزیجات هستند. رژیم تعدیلشدهٔ اَتکینز جایگزینی ارزانتر برای چنین کشورهایی است. با آنکه رژیم تعدیلشدهٔ اتکینز هم، اندکی گرانتر از رژیم غذایی معمولی است، اما در صورت موفقیت این رژیم غذایی در درمان بیمار، این اختلاف قیمت، از طریق حذف هزینهٔ خرید داروهای ضد صرع جبران میشود. رژیم تعدیلشدهٔ اَتکینز، پیچیدگی کمتری — چه بهلحاظ تهیهٔ غذا و چه بهلحاظِ توضیح آن به والدین — داراست و نیاز کمتری نیز به نظارت و حمایت متخصص تغذیه دارد.[58]
مکانیسم اثر
بیماریشناسی تشنج
مغز انسان از شبکهای از یاختههای عصبی (نورونها) تشکیل شدهاست که تکانههای عصبی را از طریقِ گسترش پتانسیل عمل، گسیل میدارند. انتشار این تکانههای عصبی از یک نورون به نورونی دیگر، توسط پیامرسانهای شیمیایی صورت میپذیرد گرچه مابین برخی نورونها یک مسیر الکتریکی نیز برقرار است. پیامرسانهای شیمیایی قادرند شلیک این تکانهها را مهار کنند که این کار عمدتاً توسط گاما آمینوبوتیریک اسید یا همان «گابا»[persian-alpha 35] انجام میشود؛ این پیامرسانها همچنین قادرند یاختههای عصبی را نسبت به این تکانهها تحریک و تهییج کنند که این کار عمدتاً توسط گلوتامات صورت میگیرد. نورونهایی که پیامرسان مهاری از انتهای خود ترشح میکنند به «نورون مهاری» و آنهایی که پیامرسان تحریکی از انتهایشان ترشح میشود به «نورون تحریکی» شهرت دارند. هرگاه تعادل میان این نورونهای مهاری و تحریکی در بخشی از مغز یا تمامی آن بههم بخورد، تشنج رخ میدهد. سامانهٔ گابا یکی از اهداف مهم داروهای ضد صرع است. چرا که میتوان بروز تشنجها را از طریق افزایش ساخت گابا یا کاهش تجزیهٔ آن یا افزایش اثرات آن بر روی یاختههای عصبی کاهش داد.[8]
مشخصهٔ امواج و تکانههای عصبی هجوم یونهای سدیم به داخل سلول از طریق مجراهایی در غشای یاختهٔ عصبی و سپس خروج یونهای پتاسیم از طریق مجراهایی دیگر است. یاختهٔ عصبی برای مدتی کوتاه پس از نخستین شلیک، قادر به شلیک مجدد نیست (که به آن، «دورهٔ تحریکناپذیری»[persian-alpha 36] میگویند) و توسط یک مجرای پتاسیمی خاص (مجرای پتاسیمی فعالشونده توسط کلسیم) میانجیگری میشود. جریان عصبی از خلال این مجراهای یونی، توسط دریچههایی کنترل میشود که باز شدنشان یا توسط ولتاژهای الکتریکی صورت میگیرد یا وابسته به پیامرسانهای شیمیایی موسوم به لیگاند (مثلاً یک پیامرسان عصبی) هستند. این مجاری یونی، یکی دیگر از اهداف داروهای ضد تشنج هستند.[8]
بروز صرع خود به طرق مختلف صورت میپذیرد. چند نمونه از فیزیولوژیهای بیمارگونه عبارتند از: ارتباطات تحریکیِ نامعمول در درون شبکهٔ عصبی مغز، ساختار غیرطبیعی یاختهٔ عصبی که منجر به تغییر جریان یونی-عصبی میشود، کاهش ساخت پیامرسانهای مهاری، گیرندههای ناکارآمد پیامرسانهای مهاری، تجزیهٔ ناکافی پیامرسانهای تحریکی، تشکیل و تکامل ناتمام و ناقص سیناپسها، و اختلال در عملکرد مجراهای یونی.[8]
کنترل تشنج
گرچه فرضیههای فراوانی دربارهٔ نحوهٔ کارکرد رژیم کتوژنیک در درمان تشنج مطرح است، اما همچنان مکانیسم دقیق آن نامشخص است. فرضیههای رد شده عبارتند از: اسیدوز سیستمیک (سطوح بالای اسید در خون)، تغییرات الکترولیتی و هیپوگلیسمی (گلوکز پائین در خون).[22] گرچه تغییرات بیوشیمیایی زیادی در مغزِ افرادی که رژیم کتوژنیک مصرف میکنند، روی میدهد، اما مشخص نیست که کدامیک از اینها، اثرات ضد تشنجی دارند. نقص دانش پزشکی در این زمینه، مشابه به فقدان دانش انسان دربارهٔ نحوهٔ کارکرد داروهای ضد صرع است.[59] در رژیم کتوژنیک، میزانِ کربوهیدرات محدود است و این میزان، قادر به تأمین تمامی نیازهای متابولیک بدن نیست. در عوض، اسیدهای چرب به عنوان منبع اصلی انرژی بهکار میروند. این مواد از طریق فرایند «سوختوساز اسیدهای چرب»[persian-alpha 37] در میتوکندریِ سلولها (اجزاء تولیدکنندهٔ انرژی در سلول) مورد بهرهبرداری قرار میگیرند. انسانها قادرند چند اسید آمینه را طی فرایندی موسوم به گلوکونئوژنز به قند تبدیل کنند، اما نمیتوانند همین کار را در مورد اسیدهای چرب انجام دهند.[60] از آنجایی که اسیدهای آمینه برای ساخت پروتئینها (که برای رشد و ترمیم بافتهای بدن ضروری هستند) مورد نیازند، نمیتوان از آنها، تنها برای تولید گلوکز، بهره جست. این موضوع برای مغز مشکلساز است، چرا که تنها منبع تأمین انرژی مغز، گلوکز است و بیشتر اسیدهای چرب قادر به عبور از سد خونی مغزی نیستند. با این حال کبد میتواند با استفاده از «اسیدهای چرب زنجیره بلند»، سه جسم کتونی به نامهای بتا-هیدروکسیبوتیریک اسید، اسید استواستیک و استون بسازد. این اجسام کتونی وارد مغز شده و «تا حدودی» بهعنوان منبع تأمین انرژی، جایگزین قند خون میگردند.[59] اجسام کتونی احتمالاً ضد صرع هستند. در مدلهای حیوانی، اَستواَستات و استون، نقش محافظتکننده در برابر تشنج داشتهاند. رژیم کتوژنیک منجر به تغییرات انطباقی در متابولیسم انرژی مغز شده و ذخایر انرژی را افزایش میدهند. اجسام کتونی، نسبت به گلوکز، سوختِ کارآمد و مؤثرتری هستند. تعداد میتوکندریهای مغز نیز افزایش مییابد. تمامی این تغییرات، به یاختههای عصبی مغز کمک میکند تا در جریان تشنج و افزایش نیاز به انرژی، پایداری خود را حفظ کنند و بدین ترتیب، احتمالاً اجسام کتونی دارای اثرات محافظتی برای یاختههای عصبی هستند.[59]
رژیم کتوژنیک در دستکم ۱۴ مدل حیوانی از دستهٔ جوندگان که مبتلا به تشنج بودهاند، مطالعه و بررسی شدهاست. این رژیم در این جانداران، اثرات محافظتی داشته و نمایهٔ محافظتیِ آن، کاملاً متفاوت از انواع شناختهشدهٔ ضد صرع است. از طرف دیگر، فنوفیبرات، که کاربرد بالینی در درمان صرع ندارد، خواص ضد صرعی در موشهای بالغ از خود نشان دادهاست که قابل مقایسه با رژیم کتوژنیک است.[61] این موضوع، در کنارِ شواهد بدستآمده از سایر پژوهشها، نشاندهندهٔ اثربخشی رژیم کتوژنیک در بیمارانی بوده که به درمان دارویی با چندین داروی دیگر، پاسخی ندادهاند و شاهدی بر مکانیسم عمل منحصر بهفرد آن است.[59] تمامی ضد صرعها، تشنجهای صرعی را فرو مینشانند، اما هیچکدام درمانِ قطعی برای صرع نیستند و جلوی استعداد ابتلا به صرع و آسیبپذیری از آن را نمیگیرند. دانش بشر از نحوهٔ ایجاد و شکلگیری صرع (اپیلپتوژنز) ناقص است. بعضی از داروی ضد صرع (والپروات، لوتیراستام، بنزودیازپین) در مدلهای حیوانی، خواص ضد صرع زایی (آنتی اپیلپتوژنز) از خود نشان دادهاند، اما به هرحال هیچ داروی ضدصرعی در کارآزماییهای بالینی در انسان، خواص ضد صرع زایی نداشتهاند. نشان داده شده که رژیم کتوژنیک در موشهای صحرایی خواص آنتی اپیلپتوژنز ازخود بروز دادهاست.[59]
غذاهای مجاز و غیرمجاز
بهطور کلی در این رژیم غذاهای با کربوهیدرات به شدت محدود میشوند. مواردی مانند قند و شکر و نوشابه با محدودیت شدیدی مواجه هستند و در مرحله بعدی نیز غذاهای دارای نشاسته مانند نان و پاستا و برنج قرار دارند. میوهها نیز در این رژیم محدود هستند زیرا قند دارند. از دیگر مواد غذایی محدود میتوان به حبوبات، سبزیجات نشاستهای مثل سیب زمینی، سسها و غذاهای فرآوری شده، چربیهای غیر سالم و الکل اشاره کرد. در عوض گوشتها (مخصوصا از انواع پرچرب آنها)، چربیها و روغنهای سالم مثل روغن زیتون، مغزها و دانهها، تخم مرغ، سبزیجات با کربوهیدرات پایین، کره، پنیر و ماهی مخصوصاً با چربی بالا، در برنامه غذایی این رژیم به وفور یافت میشود.[62]
سایر موارد مصرف
بجز صرع، رژیم کتوژنیک، جهت مصارف بالقوهٔ درمانی در تعدادی دیگر از بیماریهای مغز و اعصاب مورد مطالعه و بررسی بودهاست. این بیماریها عبارتند از: بیماری آلزایمر، اسکلروز جانبی آمیوتروفیک، اوتیسم، سردرد، آسیب مغزی، بیماری پارکینسون و اختلال خواب.[63]
از آنجایی که سلولهای تومور قادر به هضم و استفاده از اجسام کتونی به عنوان منبعی از انرژی نیستند، رژیم کتوژنیک برای درمان کمکیِ احتمالی در سرطانها پیشنهاد شدهاست.[64][65] یک مرور سیستماتیک در ۲۰۱۸ میلادی، شواهد بهدستآمده از مطالعات بالینی و پیشبالینی دربارهٔ استفاده از رژیم کتوژنیک در درمان سرطان را بازبینی و بررسی نمود. مطالعات بالینی در انسانها معمولاً اندک بوده و برخی نشاندهندهٔ شواهد ضعیفی از اثرات ضد تومور بودند، بهویژه در مورد گلیوبلاستوما، اما در مورد سایر سرطانها و همچنین در دیگر مطالعات، هیچگونه اثرات ضد توموری دیده نشد. در مجموع، نتایج حاصل از مطالعات پیشبالینی اگر چه حاوی تناقضاتی بود اما بیشتر به نفع اثرات ضد تومور این رژیم در سرطانهای سفت بود تا اثرات تومورزایی آن.[66] البته شواهد سودمندی این رژیم در سرطان به آن سطح از اعتبار نرسید که بر پایهٔ آن توصیهای پزشکی انجام شود.[9]
رژیم کتوژنیک در بیماری های خاص
از جمله مطالعات جدیدتر، میتوان به پژوهش دربارهٔ اثر این رژیم در دیابت [67]، نارسایی قلبی [68] و عملکرد بیضه در مردان چاق [69] اشاره کرد، اما نیاز به تحقیقات بیشتری در این موارد وجود دارد.
یادداشتها
- Ketogenic diet
- Modified Atkins diet
- در این مقاله، kcal بهمعنای کیلوکالری بهعنوان واحد اندازهگیری انرژی (۴٫۱۸۶۸ کیلوژول) و کالری واحد انرژی بدستآمده از غذاهاست.
- MCT (Medium-chain triglyceride)
- Charlie Foundation
- fasting
- در این مقاله، عبارتهای «پرهیز غذایی» یا «گرسنگی طولانیمدت» (به انگلیسی: fasting)، اشاره دارد به بیغذایی و گرسنه ماندنِ طولانی، ضمنِ مصرفِ مایعاتِ بدون کالری؛ مگر آنکه خلاف آن بیان شود.
- Hippocratic Corpus
- On the Sacred Disease
- Epidemics
- detoxified
- Hugh Conklin
- water diet
- McMurray
- Charles Howland
- the ketosis of starvation
- Rollin Woodyatt
- Russell Wilder
- Mynie Peterman
- Induction
- Maintenance
- Clifford Barborka
- intention-to-treat analysis
- مقصود از یک کاهش خوب و مناسب، کاهش ۵۰ تا ۹۰ درصدی در تعداد تشنجهاست. کاهش عالی، یک کاهش ۹۰ تا ۹۹ درصدی است.
- The low glycaemic index treatment
- Ketogenic Ratio
- اگناگ کتوژنیک در جریان مرحلهٔ القاء (آغازین) این رژیم استفاده میشود و یک نوشیدنی با نسبت کتوژنیک خاص است. بهعنوان مثال، یک اگناگ با نسبت ۴:۱ حاوی ۶۰ گرم از خامهٔ غلیظ ۳۶٪، ۲۵ گرم تخممرغ خام پاستوریزه، ساخارین و طعمدهندهٔ وانیل است. این نوشیدنی حاوی ۲۴۵ کیلوکالری (۱٬۰۲۵ کیلوژول)، ۴ گرم پروتئین، ۲ گرم کربوهیدرات و ۲۴ گرم چربی است. (۲۴:۶ = ۴:۱) اگناگ را همچنین میتوان پُخت و با آن کاستارد درست کرد. یا آنکه منجمد نمود و با آن بستنی درست کرد.
- KetoCalculator
- KetoCal
- KetoVolve
- Ketonia
- Ross Carbohydrate Free
- Microlipid
- Polycose
- GABA
- Refractory period
- Fatty acid metabolism
منابع
- «رژیم کتونزا» [تغذیه] همارزِ «رژیم کتوژنیک» (به انگلیسی: ketogenic diet, high fat diet)؛ منبع: گروه واژهگزینی. جواد میرشکاری، ویراستار. دفتر هفتم. فرهنگ واژههای مصوب فرهنگستان. تهران: انتشارات فرهنگستان زبان و ادب فارسی. شابک ۹۷۸-۹۶۴-۷۵۳۱-۹۴-۸ (ذیل سرواژهٔ رژیم کتونزا)
- Freeman JM, Kossoff EH, Hartman AL. The ketogenic diet: one decade later. Pediatrics. 2007 Mar;119(3):535–43. doi:10.1542/peds.2006-2447. PMID 17332207
- Martin K, Jackson CF, Levy RG, Cooper PN. Ketogenic diet and other dietary treatments for epilepsy. Cochrane Database Syst Rev. 2016 Feb 9;2:CD001903. doi:10.1002/14651858.CD001903.pub3. PMID 22419282.
- Kossoff EH, Zupec-Kania BA, Rho JM. Ketogenic diets: an update for child neurologists. J Child Neurol. 2009 Aug;24(8):979–88. doi:10.1177/0883073809337162. PMID 19535814
- Liu YM. Medium-chain triglyceride (MCT) ketogenic therapy. Epilepsia. 2008 Nov;49 Suppl 8:33–6. doi:10.1111/j.1528-1167.2008.01830.x. PMID 19049583
- Zupec-Kania BA, Spellman E. An overview of the ketogenic diet for pediatric epilepsy. Nutr Clin Pract. 2008 Dec–2009 Jan;23(6):589–96. doi:10.1177/0884533608326138. PMID 19033218
- de Boer HM, Mula M, Sander JW. The global burden and stigma of epilepsy. Epilepsy Behav. 2008 May;12(4):540–6. doi:10.1016/j.yebeh.2007.12.019. PMID 18280210
- Stafstrom CE. An introduction to seizures and epilepsy. In: Stafstrom CE, Rho JM, editors. Epilepsy and the ketogenic diet. Totowa: Humana Press; 2004. ISBN 1-58829-295-9.
- Kossoff EH, Zupec-Kania BA, Amark PE, Ballaban-Gil KR, Bergqvist AG, Blackford R, et al. Optimal clinical management of children receiving the ketogenic diet: recommendations of the International Ketogenic Diet Study Group. Epilepsia. 2009 Feb;50(2):304–17. doi:10.1111/j.1528-1167.2008.01765.x. PMID 18823325
- Wheless JW. History and origin of the ketogenic diet (PDF). In: Stafstrom CE, Rho JM, editors. Epilepsy and the ketogenic diet. Totowa: Humana Press; 2004. ISBN 1-58829-295-9.
- Hippocrates, On the Sacred Disease, ch. 18; vol. 6
- Hippocrates, Epidemics, VII, 46; vol. 5
- Galen, De venae sect. adv. Erasistrateos Romae degentes, c. 8; vol. 11
- Galen, De victu attenuante, c. 1
- Temkin O. The falling sickness: a history of epilepsy from the Greeks to the beginnings of modern neurology. 2nd ed. Baltimore: Johns Hopkins University Press; 1971. p. 33, 57, 66, 67, 71, 78. شابک ۰−۸۰۱۸−۴۸۴۹−۰ .
- Guelpa G, Marie A. La lutte contre l'epilepsie par la desintoxication et par la reeducation alimentaire. Rev Ther med-Chirurg. 1911; 78: 8–13. As cited by Bailey (2005).
- Bailey EE, Pfeifer HH, Thiele EA. The use of diet in the treatment of epilepsy. Epilepsy Behav. 2005 Feb;6(1):4–8. doi:10.1016/j.yebeh.2004.10.006. PMID 15652725
- Kossoff EH. Do ketogenic diets work for adults with epilepsy? Yes! epilepsy.com. 2007, March. Cited 24 October 2009.
- Huttenlocher PR, Wilbourn AJ, Signore JM. Medium-chain triglycerides as a therapy for intractable childhood epilepsy. Neurology. 1971 Nov;21(11):1097–103. doi:10.1212/wnl.21.11.1097. PMID 5166216
- Neal EG, Chaffe H, Schwartz RH, Lawson MS, Edwards N, Fitzsimmons G, et al. The ketogenic diet for the treatment of childhood epilepsy: a randomised controlled trial. Lancet Neurol. 2008 Jun;7(6):500–6. doi:10.1016/S1474-4422(08)70092-9. PMID 18456557
- Vining EP, Freeman JM, Ballaban-Gil K, Camfield CS, Camfield PR, Holmes GL, et al. A multicenter study of the efficacy of the ketogenic diet. Arch Neurol. 1998 Nov;55(11):1433–7. doi:10.1001/archneur.55.11.1433. PMID 9823827
- Hartman AL, Vining EP. Clinical aspects of the ketogenic diet. Epilepsia. 2007 Jan;48(1):31–42. doi:10.1111/j.1528-1167.2007.00914.x PMID 17241206
- Freeman JM, Vining EP, Pillas DJ, Pyzik PL, Casey JC, Kelly LM. The efficacy of the ketogenic diet—1998: a prospective evaluation of intervention in 150 children. Pediatrics. 1998 Dec;102(6):1358–63. doi:10.1542/peds.102.6.1358. PMID 9832569. https://web.archive.org/web/20040629224858/http://www.hopkinsmedicine.org/press/1998/DECEMBER/981207.HTM Lay summary]—JHMI Office of Communications and Public Affairs. Updated 7 December 1998. Cited 6 March 2008.
- Hemingway C, Freeman JM, Pillas DJ, Pyzik PL. The ketogenic diet: a 3- to 6-year follow-up of 150 children enrolled prospectively. Pediatrics. 2001 Oct;108(4):898–905. doi:10.1542/peds.108.4.898.PMID 11581442
- Kossoff EH, Rho JM. Ketogenic diets: evidence for short- and long-term efficacy. Neurotherapeutics. 2009 Apr;6(2):406–14. doi:10.1016/j.nurt.2009.01.005 PMID 19332337.
- Henderson CB, Filloux FM, Alder SC, Lyon JL, Caplin DA. Efficacy of the ketogenic diet as a treatment option for epilepsy: meta-analysis. J Child Neurol. 2006 Mar;21(3):193–8. doi:10.2310/7010.2006.00044. PMID 16901419
- Liu H, Yang Y, Wang Y, Tang H, Zhang F, Zhang Y, Zhao Y. Ketogenic diet for treatment of intractable epilepsy in adults: A meta-analysis of observational studies. Epilepsia Open. 2018 Feb 19;3(1):9-17. doi:10.1002/epi4.12098. PMID 29588983.
- Bergqvist AGC. Indications and Contraindications of the Ketogenic diet. In: Stafstrom CE, Rho JM, editors. Epilepsy and the ketogenic diet. Totowa: Humana Press; 2004. p. 53–61. ISBN 1-58829-295-9.
- Epilepsies: diagnosis and management. National Institute for Health and Care Excellence (NICE). Published January 2012. Updated February 2016. Cited March 2018. ISBN 978-1-4731-1790-7.
- Scottish Intercollegiate Guidelines Network. Guideline 81, Diagnosis and management of epilepsies in children and young people. A national clinical guideline (PDF). Edinburgh: Royal College of Physicians; 2005. ISBN 1-899893-24-5.
- Turner Z, Kossoff EH. The ketogenic and Atkins diets: recipes for seizure control (PDF). Pract Gastroenterol. 2006 Jun;29(6):53, 56, 58, 61–2, 64.
- Stainman RS, Turner Z, Rubenstein JE, Kossoff EH. Decreased relative efficacy of the ketogenic diet for children with surgically approachable epilepsy. Seizure. 2007 Oct;16(7):615–9. doi:10.1016/j.seizure.2007.04.010. PMID 17544706
- Kossoff EH, McGrogan JR, Freeman JM. Benefits of an all-liquid ketogenic diet. Epilepsia. 2004 Sep;45(9):1163. doi:10.1111/j.0013-9580.2004.18504.x. PMID 15329084.
- Kossoff EH, Freeman JM. The ketogenic diet—the physician's perspective. In: Stafstrom CE, Rho JM, editors. Epilepsy and the ketogenic diet. Totowa: Humana Press; 2004. p. 53–61. ISBN 1-58829-295-9.
- Spendiff S. The diet that can treat epilepsy. Guardian. 2008 Aug 15;Sect. Health & wellbeing.
- Wang S, Fallah A. Optimal management of seizures associated with tuberous sclerosis complex: current and emerging options. Neuropsychiatr Dis Treat. 2014 Oct 23;10:2021-30. doi:10.2147/NDT.S51789. PMID 25364257
- Mastriani KS, Williams VC, Hulsey TC, Wheless JW, Maria BL. Evidence-based versus reported epilepsy management practices. J Child Neurol. 2008 Feb 15;23(5):507–14. doi:10.1177/0883073807309785. PMID 18281618
- Wang D, Pascual JM, De Vivo D. Glucose Transporter Type 1 Deficiency Syndrome. In: Adam MP, Ardinger HH, Pagon RA, Wallace SE, Bean LJH, Stephens K, Amemiya A, editors. GeneReviews. Seattle (WA): University of Washington, Seattle; 1993-2018. 2002 Jul 30 [updated 2018 Mar 1]. PMID 20301603.
- Huffman J, Kossoff EH. State of the ketogenic diet(s) in epilepsy (PDF). Curr Neurol Neurosci Rep. 2006 Jul;6(4):332–40. doi:10.1007/s11910-006-0027-6. PMID 16822355
- Zupec-Kania B, Werner RR, Zupanc ML. Clinical Use of the Ketogenic Diet—The Dietitian's Role. In: Stafstrom CE, Rho JM, editors. Epilepsy and the ketogenic diet. Totowa: Humana Press; 2004. p. 63–81. ISBN 1-58829-295-9.
- Bergqvist AG. Long-term monitoring of the ketogenic diet: Do's and Don'ts. Epilepsy Res. 2011 Aug 18;100(3):261–6. doi:10.1016/j.eplepsyres.2011.05.020. PMID 21855296.
- Sampath A, Kossoff EH, Furth SL, Pyzik PL, Vining EP. Kidney stones and the ketogenic diet: risk factors and prevention (PDF). J Child Neurol. 2007 Apr;22(4):375–8. doi:10.1177/0883073807301926. PMID 17621514
- McNally MA, Pyzik PL, Rubenstein JE, Hamdy RF, Kossoff EH. Empiric use of potassium citrate reduces kidney-stone incidence with the ketogenic diet. Pediatrics. 2009 Aug;124(2):e300–4. doi:10.1542/peds.2009-0217. PMID 19596731
- Kossoff E. Is there a role for the ketogenic diet beyond childhood? In: Freeman J, Veggiotti P, Lanzi G, Tagliabue A, Perucca E. The ketogenic diet: from molecular mechanisms to clinical effects. Epilepsy Res. 2006 Feb;68(2):145–80. doi:10.1016/j.eplepsyres.2005.10.003. PMID 16523530
- Vogelstein F. Epilepsy's Big, Fat Miracle. New York Times. 2010 Nov 17.
- Kim DY, Rho JM. The ketogenic diet and epilepsy. Curr Opin Clin Nutr Metab Care. 2008 Mar;11(2):113–20. doi:10.1097/MCO.0b013e3282f44c06. PMID 18301085
- Kossoff EH, Laux LC, Blackford R, Morrison PF, Pyzik PL, Hamdy RM, et al. When do seizures usually improve with the ketogenic diet? (PDF). Epilepsia. 2008 Feb;49(2):329–33. doi:10.1111/j.1528-1167.2007.01417.x. PMID 18028405
- Musa-Veloso K, Cunnane SC. Measuring and interpreting ketosis and fatty acid profiles in patients on a high-fat ketogenic diet. In: Stafstrom CE, Rho JM, editors. Epilepsy and the ketogenic diet. Totowa: Humana Press; 2004. p. 129–41. ISBN 1-58829-295-9.
- Martinez CC, Pyzik PL, Kossoff EH. Discontinuing the ketogenic diet in seizure-free children: recurrence and risk factors. Epilepsia. 2007 Jan;48(1):187–90. doi:10.1111/j.1528-1167.2006.00911.x. PMID 17241227
- Zupec-Kania B. KetoCalculator: a web-based calculator for the ketogenic diet. Epilepsia. 2008 Nov;49 Suppl 8:14–6. doi:10.1111/j.1528-1167.2008.01824.x. PMID 19049577
- Kossoff EH, Dorward JL. The modified Atkins diet. Epilepsia. 2008 Nov;49 Suppl 8:37–41. doi:10.1111/j.1528-1167.2008.01831.x. PMID 19049584
- Pfeifer, Heidi H. Low glycemic index treatment. Epilepsy Foundation. 22 August 2013. Cited 31 March 2018.
- Muzykewicz DA, Lyczkowski DA, Memon N, Conant KD, Pfeifer HH, Thiele EA. Efficacy, safety, and tolerability of the low glycemic index treatment in pediatric epilepsy. Epilepsia. 2009 May;50(5):1118–26. doi:10.1111/j.1528-1167.2008.01959.x. PMID 19220406
- KetoCal Product Information. Nutricia North America. Cited 8 June 2018.
- KetoVOLVE: 4:1 Ratio Powder. Solace Nutrition. Cited 17 June 2013.
- Kossoff EH. The Ketogenic Diet ... in a bottle?. Keto News. Epilepsy.com. Updated July 2009. Cited 29 November 2009.
- Kossoff EH, McGrogan JR. Worldwide use of the ketogenic diet. Epilepsia. 2005 Feb;46(2):280–9. doi:10.1111/j.0013-9580.2005.42704.x. PMID 15679509.
- Kossoff EH, Dorward JL, Molinero MR, Holden KR. The modified Atkins diet: a potential treatment for developing countries. Epilepsia. 2008 Sep;49(9):1646–7. doi:10.1111/j.1528-1167.2008.01580_6.x PMID 18782218
- Hartman AL, Gasior M, Vining EP, Rogawski MA. The neuropharmacology of the ketogenic diet. Pediatr Neurol. 2007 May;36(5):281–292. doi:10.1016/j.pediatrneurol.2007.02.008. PMID 17509459
- Kerndt PR, Naughton JL, Driscoll CE, Loxterkamp DA. Fasting: the history, pathophysiology and complications. West J Med. 1982 Nov;137(5):379–99. PMID 6758355
- Porta N, Vallée L, Lecointe C, Bouchaert E, Staels B, Bordet R, Auvin S. Fenofibrate, a peroxisome proliferator-activated receptor-alpha agonist, exerts anticonvulsive properties. Epilepsia. 2009 Apr;50(4):943–8. doi:10.1111/j.1528-1167.2008.01901.x. PMID 19054409.
- «رژیم غذایی کتوژنیک و عوارض آن + نکات و سوالات متداول». مجله فیت شیپ. ۱۵ مرداد ۱۳۹۹.
- Gano LB, Patel M, Rho JM. Ketogenic diets, mitochondria, and neurological diseases. J Lipid Res. 2014 Nov;55(11):2211-28. doi:10.1194/jlr.R048975. PMID 24847102.
- Barañano KW, Hartman AL. The ketogenic diet: uses in epilepsy and other neurologic illnesses. Curr Treat Options Neurol. 2008;10(6):410–9. doi:10.1007/s11940-008-0043-8. PMID 18990309
- Allen BG, Bhatia SK, Anderson CM, et al. Ketogenic diets as an adjuvant cancer therapy: History and potential mechanism. Redox Biol. 2014 Aug 7;2C:963–70. doi:10.1016/j.redox.2014.08.002. PMID 25460731
- Weber DD, Aminazdeh-Gohari S, Kofler B. Ketogenic diet in cancer therapy. Aging (Albany NY). 2018 Feb 11;10(2):164-165. doi:10.18632/aging.101382. PMID 29443693.
- https://pubmed.ncbi.nlm.nih.gov/33257645/
- https://pubmed.ncbi.nlm.nih.gov/33106690/
- https://pubmed.ncbi.nlm.nih.gov/32998364/
جستارهای وابسته
- Freeman JM, Kossoff EH, Freeman JB, Kelly MT. The Ketogenic Diet: A Treatment for Children and Others with Epilepsy. 4th ed. New York: Demos; 2007. ISBN 1-932603-18-2.
پیوند به بیرون
| در ویکیانبار پروندههایی دربارهٔ رژیم غذایی کتوژنیک موجود است. |
- دوستان مَتیو. یک منبع اطلاعرسانی نیکوکارانه بریتانیایی.
- رژیم غذایی کتوژنیک در کرلی
- بنیاد چارلی. یک منبع اطلاعرسانی نیکوکارانه برپا شده توسط جیم آبراهامز.
- epilepsy.com: درمانهای مبتنی بر رژیم غذایی کتوژنیک و خبرهای مربوط به آن اطلاعات و اخبار پژوهشی بهروز.
- گفتگویی با جان فریمن: تیمار کردن شعلهها. مصاحبهای دربارهٔ رژیم کتوژنیک که در شمارهٔ ۲، جلد ۱۶ از «برینویوز» در پائیز ۲۰۰۳ منتشر شد.
- بیمارستان کودکان لوری: رژیم کتوژنیک چگونه اثر میکند.